九寨沟沉水杉叶藻的叶绿素荧光参数日变化研究
2016-02-06高丽楠
高丽楠
(成都大学 旅游与经济管理学院,四川 成都 610106)
九寨沟沉水杉叶藻的叶绿素荧光参数日变化研究
高丽楠
(成都大学 旅游与经济管理学院,四川 成都 610106)
以来源于九寨沟芳草海、箭竹海和五花海3个湖泊的优势沉水植物杉叶藻(Hippurisvulgaris)为试材,利用Junior-PAM调制叶绿素荧光仪,在夏季对其快速光响应曲线和最大光化学效率(Fv/Fm)日变化动态进行测定,以揭示杉叶藻的光合特征及其与主要环境因子的关系。结果显示:3个湖泊光合有效辐射强度(PAR)日平均值之间无显著差异,五花海的水温(Tw)日平均值极显著高于芳草海和箭竹海。沉水杉叶藻的最大相对电子传递速率(rETRmax)和半饱和光强(Ek)的日变化在箭竹海和五花海均呈双峰曲线,在芳草海呈单峰曲线;3个湖泊沉水杉叶藻光能利用效率一天中均呈早晚高、中午低的近“V”形曲线。五花海沉水杉叶藻的rETRmax和Ek日平均值极显著高于箭竹海和芳草海,rETRmax、Ek在箭竹海和芳草海之间无显著性差异,说明五花海沉水杉叶藻有更强的光合能力和对强光的耐受能力。3个湖泊沉水杉叶藻Fv/Fm日变化都呈“V”形曲线,五花海沉水杉叶藻Fv/Fm恢复速度大于芳草海和箭竹海。研究表明,不同的环境因子,特别是Tw,会导致沉水植物杉叶藻的叶绿素荧光参数在3个湖泊之间存在显著差异,即Tw是九寨沟沉水植物杉叶藻光合作用的主要影响因子,12 ℃为光合最适温度。
九寨沟; 沉水植物; 叶绿素荧光; 快速光响应曲线
青藏高原作为独特的自然地域单元,其自然环境和生态系统在全球占有特殊地位,并且与全球气候与环境变化息息相关。近几十年来,由于气候干暖化和人类经济活动的影响,青藏高原大多数湖泊都有不同程度的变化。对于内陆湖泊尤其是高原腹地内陆区湖泊而言,入湖水系少而短,补给湖泊的水量不多。在干燥气候的影响下,许多湖泊水位下降、湖泊面积缩小、湖水含盐量增加,有的则逐步干涸、消亡[1]。另外在青藏高原东部,由于高原面保持相对完整,西南季风影响较大,形成寒冷半湿润的环境,有利于沼泽发育,因而区域内沼泽分布较普遍,而且面积大[2]。湖泊沼泽化是指经过长期的泥沙淤积和生物沉积,湖水变浅,开始生长沉水植物和挺水植物,可见水生植物在湖泊沼泽化过程中具有非常重要的作用。目前对青藏高原湖泊的研究较少,并且主要集中在高原湖泊水化学特征[3-4]、古湖沼学[5]和湖泊沉积物[6-7]等几个方面,并未开展青藏高原湖泊植物生理生态学的相关研究。
九寨沟自然保护区位于青藏高原东缘,属于对全球气候变化敏感的区域,是联合国世界自然遗产、联合国世界生物保护区、国家级自然保护区、国家级重点风景名胜区,通过了绿色环球21认证,是中国最具吸引力的自然风景旅游目的地。九寨沟区内地质构造复杂,褶皱和断裂发育,特别是钙华地貌发育,形成了钙华湖泊和瀑布、植物岛和滩流等奇观,成为高寒地区独具特色的喀斯特地貌景观。九寨沟的旅游活动呈现空前的繁荣,但是在带来巨额经济收入的同时,巨大的游客人数、大量的旅游活动以及修建旅游基础设施给景区的植被、水体和土壤等造成了一定的负面影响。目前九寨沟一些湖泊泥沙淤积明显,湖泊沼泽化问题严重。伴随着湖泊泥沙淤积还有大量营养盐物质的输入,水生植物大量生长。另外,水生植物促进沉积效应是非常显著的,这样浅滩范围逐步扩大,湖泊面积变小,水生植物大量生长,会加快沼泽化的进程[8],并对湖泊和景区产生不利的影响,也将直接影响到景区景观资源的保护和可持续利用。但是,目前对九寨沟的研究主要集中在地质地貌[9-10]、水文[11]、景观成因[12]、旅游[13]等方面,还未见对九寨沟自然保护区内水生植物生长状况的研究报道。
叶绿素荧光动力学技术能快速灵敏地反映植物生理状态及其与环境的关系,是一种理想的光系统探针,可直接或间接地了解光合作用过程。光合日变化是维持植物光合机构内不同组分响应和适应环境条件平衡能力的一种反映,叶绿素荧光参数则反映光合机构一系列重要的适应调节过程[14]。目前,结合叶绿素荧光参数反映九寨沟水生植物光合作用日变化特征的研究尚无报道。因此,本研究采用在线监测与室内分析相结合的方法,以九寨沟优势沉水植物杉叶藻为试验材料,探讨不同湖泊同一沉水植物杉叶藻的叶绿素荧光参数日变化特征,讨论光强和水温等重要环境因子对水生植物光合作用的影响,为研究九寨沟沉水植物的生长过程、湖泊沼泽化治理、生态与环境保护提供科学依据和基础资料。
1 材料和方法
1.1 试验样地的选择与概况
九寨沟自然保护区位于四川省阿坝藏族羌族自治州九寨沟县中南部(103°46′~104°05′E,32°55′~33°16′N),其地处青藏高原东缘岷山山脉南段尕尔纳峰北麓,是长江水系嘉陵江源头的一条支沟,地貌为高山峡谷区,地势南高北低,海拔1 996~4 764 m。九寨沟具有冷凉干燥的季风气候特征,年平均气温6.5 ℃,极端低温为-19.1 ℃,极端高温为33.7 ℃;年平均降水量681 mm,降雨多集中在5—10月;年日照时数为1 600 h,相对湿度为60%~70%[15]。九寨沟水生植物种类丰富,水生维管植物共有75种(含6变种),隶属于23科41属[16]。
芳草海(Grass Lake,GL)、箭竹海(Arrow Bamboo Lake,ABL)和五花海(Five Colored Lake,FCL) (图1)处于挺水植物阶段,湖泊沉积速度加快。如果今后水量继续下降,湖泊湿地萎缩,沼泽化过程将更快。在经过多次野外实地考察的基础上,选取芳草海、箭竹海、五花海作为本次研究样地,海拔分别为2 934、2 632、2 478 m。将九寨沟分布广泛的优势沉水植物杉叶藻(Hippurisvulgaris)作为研究对象,杉叶藻群落为典型的北极高山分布型,是喜寒冷环境分布的群落类型,是高原高寒环境的一种指示群落[2]。

图1 九寨沟地理位置示意图
1.2 测定项目与方法
1.2.1 叶绿素荧光参数 野外试验选在水生植物生长旺季的7月15—23日进行。选择晴朗无云的天气,分别测定3个湖泊沉水杉叶藻叶绿素荧光参数的日变化,7:00—17:00,每2 h测定一次。叶绿素荧光测量由脉冲调制叶绿素荧光仪Junior-PAM (Walz,Germany)连接到手持三星Q1U-000电脑上进行,由WinControl-3软件控制。测定过程中在水深80 cm以内随机选择受试植物,采集的植株叶片迅速进行叶绿素荧光参数的测定,保持植株叶片浸泡在湖水中同时避免强光照射。测定叶绿素荧光参数过程中,用磁性叶夹将叶片夹住,并且调节光纤末端到样品的距离为2 mm(光纤的直径为1.5 mm)。
用叶绿素荧光仪Junior-PAM测定最大光化学效率(maximal quantum yield,Fv/Fm),随机选择生长一致且叶片受光方向相同的5株植株,测定植株顶端以下第3~4片叶。用暗适应夹夹住叶片20 min后,首先开启检测光[0.1 μmol/(m2·s)],得到暗适应条件下光系统Ⅱ(PSⅡ)最小荧光(Fo),再由饱和脉冲光[10 000 μmol/(m2·s)]激发测得暗适应的最大荧光(Fm)。根据Fo和Fm计算出PSⅡ最大光化学效率,以反映PSⅡ反应中心内禀光能转换效率或潜在的光能转化效率[17]。
Fv/Fm= (Fm-Fo)/Fm
(1)
用叶绿素荧光仪Junior-PAM测定快速光响应曲线(rapid light curves,RLCs),随机选择5株植株,测定植株顶端以下第3~4片叶。测量由电脑控制,光化光强度(photosynthetic active radiation,PAR)梯度设置为66、90、125、190、285、420、625、820 μmol/(m2·s),打开测量光和光化光,适应10 s后打开饱和脉冲,之后提升PAR并适应10 s,再打开饱和脉冲,如此重复8次。打开饱和脉冲前的荧光为Ft,打开饱和脉冲得到最大荧光Fm′,由此可以得出PSⅡ的有效量子产量(Yeild)。
Yeild= (Fm′-Ft)/Fm′
(2)
根据Yeild和PAR可以计算出相对电子传递速率[relative electron transport rate,rETR,μmol/(m2·s)][17],其中0.5是假设吸收光能被光系统Ⅰ(PSⅠ)和PSⅡ平均分配,0.84是植物的经验性吸光系数[18]。
rETR=Yeild×PAR×0.5×0.84
(3)
快速光曲线拟合采用Platt等[19]的方程式:
rETR=rETRmax×(1-e-α×PAR/rETRmax)×
e-β×PAR/rETRmax
(4)
式中,rETRmax为无光抑制时的最大潜在相对电子传递速率[maximum relative electron transport rate,μmol/(m2·s)],α为快速光曲线的初始斜率(photosynthetic efficiency),β为光抑制参数。由此可以得出半饱和光强[saturating photon flux,Ek,μmol/(m2·s)]。
Ek=rETRmax/α
(5)
1.2.2 光合有效辐射强度和水温 与叶绿素荧光参数同步测定,采用AccuPAR Lp-80 Ceptometer测定水面下沉水杉叶藻顶端的光合有效辐射强度(PAR),利用温度计测定水体温度(water temperature,Tw)。
1.2.3 叶绿素含量 将沉水杉叶藻放在装有少量湖水的低温箱,并在最短时间内运至九寨沟实验室。称取新鲜植株顶端叶片约1.6 g,擦净组织表面污物,剪碎,以80%的丙酮进行研磨。用紫外分光光度计(UV-1240-PC,Shimadzu)测定663 nm和645 nm处的吸光度,重复测量6次,计算叶绿素a(Chla,mg/g)、叶绿素b(Chlb,mg/g)和叶绿素(a+b)[Chl(a+b),mg/g]含量[20]。
1.3 数据处理
试验数据采用SPSS 17.0和Origin 7.5统计软件进行处理及统计分析。用One-way ANOVA进行分析,以P<0.05为显著水平。
2 结果与分析
2.1 3个湖泊的环境因子日变化特征
光合有效辐射强度(PAR)与水温(Tw)是影响水生植物光合作用最重要的环境因子。PAR的日变化都呈明显的单峰型曲线,7:00最低,随后迅速升高,在13:00 达到一天中的峰值。3个湖泊的PAR在7:00都小于65 μmol/(m2·s),而在正午时段(12:00—14:00)大于1 800 μmol/(m2·s) (图2A),PAR日平均值在3个湖泊之间无显著差异。3个湖泊Tw日变化也呈明显的单峰型曲线,7:00左右为最低值,芳草海、箭竹海和五花海的最高水温都出现在13:00,分别为11.20、11.16、20.6 ℃。五花海Tw日平均值(15.79 ℃)极显著高于芳草海(8.87 ℃)和箭竹海(9.27 ℃) (P<0.01),而芳草海和箭竹海Tw日平均值之间无显著性差异(图2B)。

图2 3个湖泊水下光合有效辐射强度(A)和水体温度(B)的日变化
2.2 3个湖泊沉水杉叶藻叶绿素荧光参数日变化特征
2.2.1 最大光化学效率 由图3看出,3个湖泊沉水杉叶藻Fv/Fm日变化都呈“V”形曲线。7:00最高,之后随着PAR的增强而逐渐降低,芳草海和箭竹海的沉水杉叶藻Fv/Fm在11:00降至最低值,而五花海Fv/Fm在13:00达到最低值,表明3个湖泊的沉水杉叶藻均发生了光抑制现象。之后随着PAR的降低,Fv/Fm开始恢复,17:00芳草海和箭竹海Fv/Fm分别恢复了92.42%和95.71%,可见傍晚未恢复到清晨水平,而五花海Fv/Fm恢复到清晨时的水平。

图3 3个湖泊沉水杉叶藻的Fv/Fm日变化
2.2.2 快速光响应曲线 rETR反映实际光强下的相对电子传递效率,用于度量光化学反应导致碳固定的电子传递情况,其值由光强、叶片吸收光系数和有效荧光产量计算得到[21]。从图4可以看出,9:00五花海沉水杉叶藻的rETR达到一天中的最高值,而其余2个湖泊均在13:00达到最高值。7:00和17:00,在一定光强范围内,芳草海和箭竹海的沉水杉叶藻的rETR随PAR增强而不断上升,但是当PAR过大,超过饱和光强285 μmol/(m2·s),rETR开始下降;11:00和13:00,rETR随着PAR增强由迅速升高再到缓慢升高;而15:00在PAR为420 μmol/(m2·s)时缓慢下降。7:00和17:00,五花海沉水杉叶藻的rETR在PAR为420 μmol/(m2·s)时降低;9:00和11:00时rETR随着PAR逐渐升高。通过分析RLCs,可获得一系列反映光合能力的参数。

图4 3个湖泊沉水杉叶藻的快速光响应曲线日变化
图5A表明,7:00—17:00,芳草海的沉水杉叶藻rETRmax日变化呈典型的单峰型曲线,7:00 左右最低,为13.14 μmol/(m2·s),而后迅速上升,13:00达到峰值[54.47 μmol/(m2·s)],此时光PAR亦达到一天中的最高值,之后逐渐下降,到17:00降为30.12 μmol/(m2·s)。而箭竹海的沉水杉叶藻rETRmax日变化呈双峰型曲线,9:00时出现第1个峰值,而后下降,13:00为一天中的最高值[53.13 μmol/(m2·s)]。五花海沉水杉叶藻rETRmax日变化也呈典型的双峰型曲线,一天中的最高值[89.55 μmol/(m2·s)]出现在9:00,并且极显著高于其余2个湖泊rETRmax的最高值(P<0.01)。每个湖泊沉水杉叶藻Ek日变化趋势与其rETRmax基本一致(图5C),五花海沉水杉叶藻Ek日均值[249.07 μmol/(m2·s)]、rETRmax日均值[61.88 μmol/(m2·s)]都极显著高于其余2个湖泊(P<0.01),但Ek、 rETRmax日均值在芳草海和箭竹海之间无显著差异。
初始斜率(α)可以反映植物叶片对光能的利用效率,表现了植物叶片捕光能力的大小。3个湖泊沉水杉叶藻α一天中呈早晚高、中午低的近“V”形变化趋势,并且3个湖泊沉水杉叶藻α日平均值之间无显著差异(图5B)。
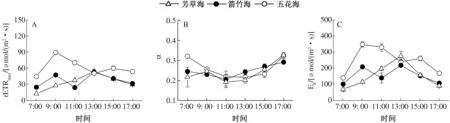
图5 3个湖泊沉水杉叶藻的rETRmax (A)、α(B)和Ek(C)日变化
为进一步说明PAR和Tw对3个湖泊沉水杉叶藻rETRmax的影响,以3个湖泊为整体,将沉水杉叶藻rETRmax分别与PAR、Tw进行回归分析。结果表明,rETRmax分别与PAR、Tw的回归模型均达到显著水平,rETRmax与Tw的决定系数(R2=0.68,P<0.01)显著大于rETRmax与PAR的决定系数(R2=0.33,P<0.05) (图6),表明Tw是导致3个湖泊沉水杉叶藻rETRmax差异的主要因子。
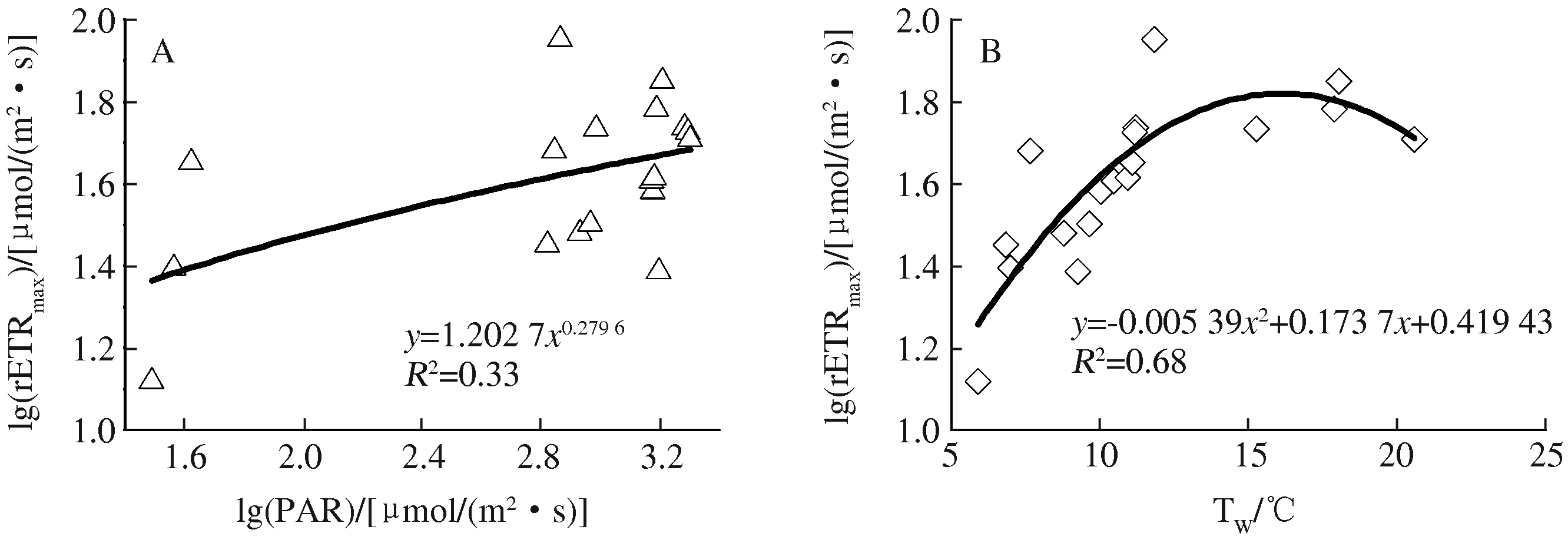
图6 3个湖泊沉水杉叶藻的rETRmax与环境因子的回归关系
2.3 3个湖泊沉水杉叶藻的叶绿素含量
叶绿素是绿色植物叶绿体内参与光合作用的重要色素,叶片中的光合色素是植物光合作用的基础,植株功能叶中叶绿素含量的高低在很大程度上反映了植株光合能力和生长状况。本试验结果显示,沉水杉叶藻的Chla、Chl(a+b)和Chla/b在3个湖泊之间均有显著性差异(P<0.05) (表1),其中芳草海和箭竹海的沉水杉叶藻Chla、Chl(a+b)和Chla/b均显著大于五花海,而Chlb在3个湖泊沉水杉叶藻之间无显著差异。
表1 3个湖泊沉水杉叶藻的叶绿素含量
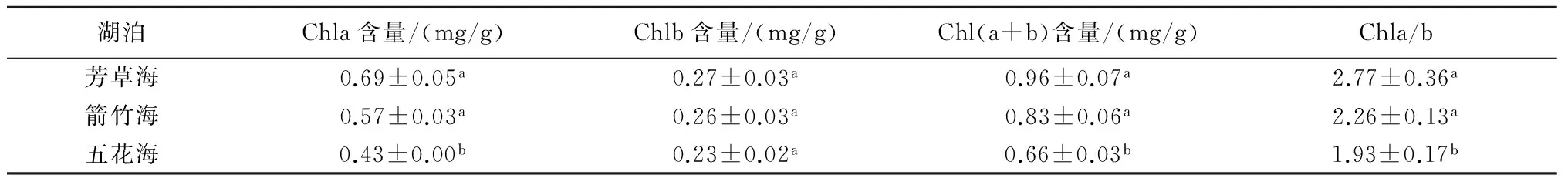
湖泊Chla含量/(mg/g)Chlb含量/(mg/g)Chl(a+b)含量/(mg/g)Chla/b芳草海0.69±0.05a0.27±0.03a0.96±0.07a2.77±0.36a箭竹海0.57±0.03a0.26±0.03a0.83±0.06a2.26±0.13a五花海0.43±0.00b0.23±0.02a0.66±0.03b1.93±0.17b
注: 表中数据为平均值±标准差,同一参数同一列内不同小写字母表示差异达到显著水平(P<0.05)。
3 结论与讨论
3.1 3个湖泊沉水杉叶藻叶绿素荧光参数日变化特征比较
本研究通过对3个湖泊沉水杉叶藻的快速光响应曲线日变化的研究表明,3个湖泊PAR之间无显著差异,而五花海沉水杉叶藻的rETRmax日平均值极显著高于其他2个湖泊,而芳草海和箭竹海的rETRmax日平均值之间无显著差异,因五花海的Tw较高使rETRmax升高,这与对汕头海域龙须菜(Gracilarialemaneiformis)的研究结果一致,温度升高使其光合速率提高[22]。另外,3个湖泊沉水杉叶藻rETRmax与Tw的决定系数(R2=0.68,P<0.01)显著大于rETRmax与PAR的决定系数(R2=0.33,P<0.05),表明Tw是导致3个湖泊沉水杉叶藻rETRmax差异的主要因子。沉水植物都有适合其正常生命活动的温度范围,当外界环境温度在该温度范围内时,酶促反应会随温度升高而加快,在一定程度上能促进光合作用;而低温可直接引起植物光合作用酶活性下降[23]。
3个湖泊沉水杉叶藻rETRmax达到一天中最高值时,每个湖泊的Tw都为12 ℃,因此,12 ℃可能为九寨沟沉水杉叶藻的光合最适温度,而热带和亚热带大多数植物光合最适温度为23~32 ℃[24]。从芳草海和箭竹海rETRmax的日变化来看,随着Tw升高,rETRmax增强,但Tw在13:00升高到光合最适温度(12 ℃)时,rETRmax也达到一天的峰值。但箭竹海沉水杉叶藻的rETRmax日变化中,11:00有所降低,因箭竹海湖泊水体的pH值(8.4)较高[25]。有研究表明,湖泊水具有较高pH值时,溶解的无机碳源(可利用的CO2)浓度会降低[26]。为了适应水体中低CO2环境,促使光合作用正常进行,虽然部分水生植物在进化过程中演变成能利用HCO3-作为光合作用的无机碳源,但是CO2仍是水生植物最容易利用和主要的无机碳源[27]。因此,pH值变化显著影响水中溶解的无机碳源,从而影响沉水植物光合作用。另外,五花海沉水杉叶藻rETRmax日变化中,13:00出现光抑制现象,因高于光合作用的最适温度12 ℃。有研究表明,植物光合作用日变化过程中,常伴随着高光强和高温,这时高温起主导作用,引起酶活性降低[28]。
3个湖泊沉水杉叶藻α日变化趋势表现为清晨和傍晚较高、正午较低,表明其具有调控光合作用和高效利用PAR的能力。而这与某些学者研究相反,由于喜盐草(Halophilaovalis)长期生长在深水域(>10 m),PAR低,正午时α并未出现降低[29]。九寨沟3个湖泊沉水杉叶藻生长在0.5~0.8 m的浅水域,较高的PAR使其具有适应强光的能力。与本研究结果相一致,浅水域生长的巨藻(Macrocystispyrifera),正午时PAR较强,促使α降低[30]。事实上,九寨沟位于青藏高原东缘,高海拔地区加上九寨沟湖泊水体透明度高,具有更强PAR、UV-B,正午时段(12:00—14:00) PAR均大于1 800 μmol/(m2·s),与低海拔地区水生植物相比沉水杉叶藻更耐强光。本研究结果显示,Tw日均值在3个湖泊之间存在显著差异,但PAR日均值无显著差异,沉水杉叶藻α日均值也无显著差异。有研究表明,Posidoniasinuosa的α随着温度的增加几乎无变化,这是因为快速光响应曲线是电子传递速率随PAR变化的曲线,而α为快速光响应曲线的初始斜率,且表示光能利用效率与温度无关[31]。
9:00—17:00,3个湖泊沉水杉叶藻Ek均低于PAR,沉水杉叶藻一天中几乎有10 h处在光饱和状态。3个湖泊沉水杉叶藻Ek随着Tw的变化而变化,五花海Tw较高,其Ek也较高。有研究表明,Posidoniasinuosa和Amphibolisgriffithii的Ek也随着Tw的升高而增强[32]。五花海沉水杉叶藻Ek显著高于其他2个湖泊,说明其耐受强光。另外,沉水杉叶藻rETRmax和Ek的变化趋势一致,因为Ek反映了植物耐受强光的能力,而对强光耐受能力强的植物具有较高rETRmax[33],因此,五花海沉水杉叶藻有更强的光合能力和对强光的耐受能力,光保护能力更强。
已有研究表明[34],Fv/Fm不受物种的影响,非胁迫条件下,该参数的变化极小,多数高等植物Fv/Fm约为0.83;当植物受到胁迫时,Fv/Fm会显著降低。从本试验结果可以看出,3个湖泊沉水杉叶藻Fv/Fm均小于0.80,表明3个湖泊沉水植物均可能受到胁迫,且外界胁迫对沉水植物PSⅡ反应中心造成一定损伤[35]。目前已有关于UV-B辐射、多环芳烃污染以及网状藻的附着对水生植物Fv/Fm影响的报道[36-37],其他因子胁迫对Fv/Fm的影响还未见相关报道。结合采样区域的环境状况,可能引起采样区域沉水植物Fv/Fm值降低的原因为高原较强UV-B辐射和植物体上附着的藻类[38],至于植物本身Fv/Fm对胁迫因子的耐受性如何,还有待进一步研究。叶片光合机构吸收过剩光能后会引起开放PSⅡ反应中心Fv/Fm降低,即产生光抑制现象,严重的光抑制可以导致反应中心的不可逆破坏[39]。3个湖泊沉水杉叶藻的Fv/Fm日变化中,随着PAR增强,Fv/Fm均呈显著的降低趋势,表明均发生光抑制,这与对喜盐草的研究结果一致[33]。另外,17:00五花海沉水杉叶藻Fv/Fm基本恢复到7:00水平,表明此时光抑制基本消失,说明沉水杉叶藻叶片日间光抑制现象并非光合机构被破坏所致,而是光合机构可逆失活造成的一种保护性反应。午后,随着PAR降低,五花海沉水杉叶藻Fv/Fm恢复速度大于芳草海和箭竹海。这与Franklin[40]研究结果相似,25 ℃时Ulvarotundata的Fv/Fm恢复速度至少是 10 ℃时的2倍。但是,芳草海和箭竹海Fv/Fm在17:00分别恢复了92.42%和95.71%,并未恢复到清晨水平,这主要是由于低温加剧了UV-B对重要生理参数Fv/Fm的负面影响[40]。
3.2 3个湖泊沉水杉叶藻叶绿素含量的比较
芳草海和箭竹海的沉水杉叶藻Chla含量大于五花海,可见随着水温的降低,Chla含量增加。这与Madsen等研究相似,在水温低时,Ranunculusaquatilis的Chla含量最大[41]。但是也有研究发现,Ruppiadrepanensis和Potamogetongramineus随着温度上升Chla含量增加[42]。九寨沟高原湖泊的沉水杉叶藻的叶绿素含量较低,特别是Chlb的降低减少了摄取过剩光能对光合反应中心的伤害。因生长于高海拔地区的植物,长期受低温、强辐射的胁迫,逐渐形成了以较低的叶绿素含量来适应该环境的特性[43],说明九寨沟高原生境对沉水杉叶藻产生了胁迫效应,减少了叶片对光能的捕获,降低光合机构遭受破坏的风险,这也是沉水植物适应九寨沟高原生境的一种自身调节机制。
3.3 气候变化对九寨沟沉水杉叶藻生长的影响
不同的环境因子,特别是Tw,会导致沉水植物杉叶藻叶绿素荧光参数在3个湖泊之间存在显著差异。本研究结果显示,Tw是九寨沟沉水杉叶藻光合作用的主要影响因子。
目前,有些学者通过利用复杂的生态系统模型预测气候变化对湖泊水质的影响,结果表明气候变化会导致湖泊水质恶化[44]。然而,九寨沟位于青藏高原的东缘,具有高海拔、低水温、钙华等特点,属于对全球气候变化敏感的区域。普遍认为,全球气候变化导致湖泊水温升高,从而提高水生植物光合作用能力和生产力。然而,水生植物能够抑制风浪和湖流,固持底泥,保护湖底免受风浪侵蚀,促进湖水中悬浮物的沉降,减少再悬浮和营养元素的溶解释放,增加水体透明度,因此更加有利于水生植被发育;另外,由于大型水生植物的凋落物分解较慢或不能完全分解,这些分解残渣就会沉积在湖底,从而又将其吸收的一部分营养盐以分解残渣的形式归还给底泥,分解残渣沉积到表层沉积物又会使湖泊产生“生物淤积效应”,因而影响底泥的状态[45]。有研究表明,水生植物从底泥所吸收的营养物质远远小于其枯枝落叶所增加湖泊的沉积物[46]。本研究结果表明,Tw是九寨沟水生植物光合作用的主要影响因子,九寨沟的芳草海和箭竹海Tw日平均值都低于沉水杉叶藻的光合最适温度(12 ℃),全球变暖可能会加快九寨沟高原湖泊沼泽化进程。
综上所述,九寨沟独特的环境因子对3个湖泊沉水杉叶藻的叶绿素荧光参数日变化产生了影响。研究结果显示,3个湖泊PAR日均值之间无显著差异,五花海的Tw日平均值极显著高于芳草海和箭竹海,Tw升高使五花海沉水杉叶藻rETRmax和Ek上升,所以五花海沉水杉叶藻有更强的光合能力和对强光的耐受能力。五花海沉水杉叶藻Fv/Fm恢复速度大于芳草海和箭竹海,较低的Tw使其余2个湖泊沉水杉叶藻的光抑制恢复缓慢。所以,Tw是九寨沟沉水杉叶藻光合作用的主要影响因子,12 ℃为光合最适温度,全球变暖可能会加快九寨沟高原湖泊沼泽化进程。
[1] 汤懋苍,程国栋,林振耀.青藏高原近代气候变化及对环境的影响[M].广东:广东科技出版社,2007.
[2] 王东.青藏高原水生植物地理研究[D].武汉:武汉大学,2003.
[3] 郑绵平,刘喜方.青藏高原盐湖水化学及其矿物组合特征[J].地质学报,2010,84(11):1585-1600.
[4] 王海雷,郑绵平.青藏高原湖泊水化学与盐度的相关性初步研究[J].地质学报,2010,84(10):1517-1522.
[5] 乔程,骆剑承,盛永伟,等.青藏高原湖泊古今变化的遥感分析——以达则错为例[J].湖泊科学,2010,22(1):98-102.
[6] 李明慧,康世昌.青藏高原湖泊沉积物对古气候环境变化的响应[J].盐湖研究,2007,15(1):63-72.
[7] 田庆春,杨太保,张述鑫,等.青藏高原腹地湖泊沉积物磁化率及其环境意义[J].沉积学报,2011,29(1):143-150.
[8] Havens K E.Submerged aquatic vegetation correlations with depth and light attenuating materials in a shallow subtropical lake[J].Hydrobiologia,2003,493(1/3):173-186.
[9] 郭建强,彭东,曹俊,等.四川九寨沟地貌与第四纪地质[J].四川地质学报,2000,20(3):183-192.
[10] 杨更.四川九寨沟地质遗迹保护探讨[J].四川地质学报,2005,25(3):178-179.
[11] 尹观,范晓,郭建强,等.四川九寨沟水循环系统的同位素示踪[J].地理学报,2000,55(4):487-494.
[12] 杨俊义,万新南,席彬,等.九寨沟黄龙地区钙华漏斗的特征与成因探讨[J].水文地质工程地质,2004,31(2):90-93.
[13] 万基财,张捷,卢韶婧,等.九寨沟地方特质与旅游者地方依恋和环保行为倾向的关系[J].地理科学进展,2014,33(3):411-421.
[14] Poormohammand-Kiani S,Maury P,Sarrafi A.QTL analysis of chlorophyll fluorescence parameters in sunflower (HelianthusannuusL.) under well-watered and water-stressed conditions [J].Plant Science,2008,175(4):565-573.
[15] 邓贵平,颜磊,章小平.九寨沟自然保护区景观变化与保护[J].山地学报,2011,29(2):173-182.
[16] 齐代华,王力,钟章成.九寨沟水生植物群落β多样性特征研究[J].水生生物学报,2006,30(4):446-452.
[17] Schreiber U,Gademann R,Ralph P,etal.Assessment of photosynthetic performance ofProchloroninLissoclinumpatellain hospite by chlorophyll fluorescence measurements[J].Plant and Cell Physiology,1997,38(8):945-951.
[18] Cohen I,Neori A.Ulvalactucabiofilters for marine fishpond effluents.Ⅰ.Ammonia uptake kinetics and nitrogen content[J].Botanica Marina,1991,34(6):475-482.
[19] Platt T,Gallegos C L,Harrison W G.Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton[J].Journal of Marine Research,1980,38(4):687-701.
[20] Arnon D I.Copper enzymes in isolated chloroplasts.Polyphenoloxidase inBetavulgaris[J].Plant Physiol,1949,24(1):3-15.
[21] 夏红霞,李爽,马澜睿,等.铜胁迫对鸢尾叶片叶绿素荧光参数的影响[J].河南农业科学,2014,43(9):79-82.
[22] 丁柳丽,邹定辉,刘露,等.气候变化对海藻龙须菜生长与光合作用耐热特性的影响[J].生态学报,2015,35(10):1-14.
[23] Li X B,Wu Z B,He G Y.Effects of low temperature and physiological age on superoxide dismutase in water hyacinth(EichhorniacrassipesSolms)[J].Aquatic Botany,1995,50(2):193-200.
[24] Lee K S,Park S R,Kim Y K.Effects of irradiance,temperature,and nutrients on growth dynamics of seagrasses:A review[J].Journal of Experimental Marine Biology,2007,350(1/2):144-175.
[25] 苏君博.九寨沟水文地球化学特征及对景观演化影响研究[D].成都:成都理工大学,2005.
[26] Invers O,Romero J,Péres M.Effects of pH on seagrass photosynthesis: A laboratory and field assessment[J].Aquatic Botany,1997,59(3/4):185-194.
[27] Beer S.Mechanisms of inorganic carbon acquisition in marine macroalgae(with special reference toChlorophyta)[J].Progress in Phycological Research,1994,10(1):179-207.
[28] Ralph P J.Photosynthetic response ofHalophilaovalis(R.Br.) Hook.f.to combined environmental stress[J].Aquatic Botany,1999,65(1/2/3/4):83-96.
[29] Campbell S J,Kerville S P,Coles R G,etal.Photosynthetic responses of subtidal seagrasses to a daily light cycle in Torres Strait: A comparative study[J].Continental Shelf Research,2008,28(16):2275-2281.
[30] Edwards M S,Kwang Y K.Diurnal variation in relative photosynthetic performance in giant kelpMacrocystispyrifera(Phaeophyceae,Laminariales)at different depths as estimated using PAM fluorometry[J].Aquatic Botany,2010,92(2):119-128.
[31] Masini R J,Cary J L,Simpson C J,etal.Effects of light and temperature on the photosynthesis of temperate meadow-forming seagrasses in Western Australia[J].Aquatic Botany,1995,49(4):239-254.
[32] Masini R J,Manning C R.The photosynthetic responses to irradiance and temperature of four meadow-forming seagrasses[J].Aquatic Botany,1997,58(1):21-36.
[33] Ralph P J,Gademann R,Dennison W C.In situ seagrass photosynthesis measured using a submersible,pulse-amplitude modulated fluorometer[J].Marine Biology,1998,132(3):367-373.
[34] 曹永慧,周本智,张汝民,等.披针叶茴香叶绿素荧光参数对不同光环境的响应[J].西北植物学报,2012,32(3):525-531.
[35] Dawson S P,Dennison W C.Effects of ultraviolet and photosynthetically active radiation on five seagrass species[J].Marine Biology,1996,125(4):629-638.
[36] Marwood C A,Solomon K R,Greenberg B M.Chlorophyll fluorescence as a bioindicator of effects on growth in aquatic macrophytes from mixtures of polycyclic aromatic hydrocarbons[J].Environmental Toxicology and Chemistry,2001,20(4):890-898.
[37] 李强,王国祥,马婷,等.水网藻附着对亚洲苦草光合特性的影响[J].湖泊科学,2007,19(3):315-320.
[38] 宋玉芝,蔡炜,秦伯强.太湖常见浮叶植物和沉水植物的光合荧光特性比较[J].应用生态学报,2009,20(3):569-573.
[39] 吕艳伟,王光全,孟庆杰,等.增温对毛白杨幼苗叶绿素及叶绿素荧光参数的影响[J].河南农业科学,2011,40(10):115-119.
[40] Franklin L A.The effects of temperature acclimation on the photoinhibitory responses of Ulva rotundata Blid[J].Planta,1994,192(3):324-331.
[41] Madsen T V,Brix H.Growth,photosynthesis and acclimation by two submerged macrophytes in relation to temperature[J].Oecologia,1997,110(3):320-327.
[42] Santamaría L,Hootsmans M J M.The effect of temperature on the photosynthesis,growth and reproduction of Mediterranean submerged macrophyte,Ruppiadrepanensis[J].Aquatic Botany,1998,60(2):169-188.
[43] 何涛,吴学明,王学仁,等.不同海拔火绒草光合特性的研究[J].西北植物学报,2005,25(12):2519-2523.
[44] Mooij W M,Janse J H,De-Senerpont-Domiso L N.Predicting the effect of climate change on temperate shallow lakes with the ecosystem model PCLake[J].Hydrobiologia,2007,584(4):443-454.
[45] Madsen J D,Chambers P A,James W F.The interaction between water movement,sediment dynamics and submersed macrophytes[J].Hydrobiologia,2001,444(1/2/3):71-84.
[46] Schulz M,Kozerski H P,Pluntke T,etal.The influence of macrophytes on sedimentation and nutrient retention in the lower River Spree(Germany)[J].Water Research,2003,37(3):569-578.
Diurnal Variation in Chlorophyll Fluorescence Parameters of SubmergedHippurisvulgarisin Jiuzhaigou
GAO Linan
(College of Tourism and Economic Management,Chengdu University,Chengdu 610106,China)
In summer,we selected a dominantHippurisvulgarisin Jiuzhaigou to examine diurnal rapid light curves(RLCs) and maximal quantum yield(Fv/Fm) in three lakes,namely Grass Lake(GL),Arrow Bamboo Lake(ABL)and Five Colored Lake(FCL),in order to investigate the photosynthetic characteristics and its relation with the main environmental factors. The results showed that there was no significant difference in daily averages of photosynthetic active radiation(PAR) of submergedHippurisvulgarisamong the three lakes,the daily averages of water temperature(Tw) was significantly higher in FCL than that in GL and ABL. The diurnal variation of relative electron transport rate(rETRmax) and saturating photon flux(Ek) of submergedHippurisvulgarisin GL showed a single-peak cuve,but in ABL and FCL showed double-peak cuve.In three lakes,the photosynthetic efficiency ofHippurisvulgarisshowed a V type diurnal cycle with the highest values in the early morning and evening,but the lowest at noon.The daily averages of rETRmax,Ekof submergedHippurisvulgaris in FCL were significantly greater than those in other two lakes,there was no significant difference between the other two lakes,which indicated that the submergedHippurisvulgaris in FCL had higher photosynthetic capacity and tolerance to strong light.In three lakes,Fv/Fm ofHippurisvulgarisshowed a V type diurnal cycle,the recovery of Fv/Fm in FCL was faster than that in GL and ABL.The results indicated that in three different lakes,the chlorophyll fluorescence parameters of submergedHippurisvulgariswere significantly different caused by a diversity of place-dependent environmental conditions,especially water temperature.In summary the most important photosynthesis factor appeared to be water temperature,the optimal temperature for photosynthesis of submergedHippurisvulgarisin Jiuzhaigou was about 12 ℃.
Jiuzhaigou; submerged macrophyte; chlorophyll fluorescence; rapid light curves
2015-07-29
高等学校学科创新引智计划项目(B08037)
高丽楠(1983-),女,内蒙古呼伦贝尔人,讲师,博士,主要从事植物生理生态学研究。 E-mail:gaolinan20081212@163.com
Q945.79
A
1004-3268(2016)02-0119-08
