10种白僵菌菌株发酵液对植物线虫和昆虫病原线虫的生物活性
2016-02-06路文雅关美娟董建臻
路文雅,张 丽,关美娟,董建臻*
(1.河北农业大学 植物保护学院,河北 保定 071000; 2.河北省植保植检站,河北 石家庄 050000)
10种白僵菌菌株发酵液对植物线虫和昆虫病原线虫的生物活性
路文雅1,张 丽2,关美娟1,董建臻1*
(1.河北农业大学 植物保护学院,河北 保定 071000; 2.河北省植保植检站,河北 石家庄 050000)
为了获得高效的杀线虫生防菌资源,以山药短体线虫(Pralylenchussp.)、黄瓜根结线虫(Meloidogynesp.)为靶标,对10种白僵菌菌株发酵液的杀线虫活性进行测定,同时测定了白僵菌菌株发酵液对昆虫病原线虫小卷蛾斯氏线虫(SteinernemacarpocapsaeAll) 的生物活性。结果表明,菌株BD-B173、BD-B180、BD-B061-3和BD-B315对山药短体线虫具有高毒力,24 h校正死亡率分别为97.20%、96.50%、91.16%、90.32%;48 h校正死亡率分别为97.30%、97.67%、92.45%、94.40%。菌株BD-B061-3、BD-B198、BD-B118和BD-B173对黄瓜根结线虫具有高毒力,24 h校正死亡率分别为97.47%、91.65%、81.37%、68.92%;48 h校正死亡率分别为98.73%、95.27%、87.53%、96.53%。10种白僵菌菌株发酵液对小卷蛾斯氏线虫24 h及48 h的校正死亡率均不超过10%。说明10种白僵菌菌株发酵液对2种植物线虫的杀虫活性具有特异性,且对昆虫病原线虫小卷蛾斯氏线虫的毒力均较弱。
白僵菌; 发酵液; 线虫; 生物活性
植物寄生线虫是一类重要的病原微生物,分布广、种类多。目前全世界已报道的植物线虫有 200 多属 5 000 余种,给农林业生产造成了严重危害[1]。山药短体线虫(Pralylenchussp.)是一种给山药带来毁灭性危害的植物寄生线虫。近年来随着农业产业结构的调整,山药种植面积逐年增加,且给农民带来了可观的经济效益,其开发前景极为广阔。然而,山药因重茬连作,遭受短体线虫病的危害也逐年增加,从而严重制约着山药生产的发展。根结线虫(Meloidogynespp.)可以侵染很多作物,其中蔬菜和果树受害较严重[2],近年来随着蔬菜产业的迅速发展,蔬菜种植规模越来越大,标准化程度越来越高,蔬菜根结线虫的危害程度逐年增加[3],给国家的蔬菜产业造成了巨大损失。
长期以来生产中主要采用化学方法防治植物寄生线虫,由于人工合成的杀线虫剂毒性均较高,导致线虫产生抗药性,更重要的是严重污染人类生存环境。同时,也致使农产品农药残留和杀伤天敌等副作用日益严重[4-5],因此化学防治已不适应农林业生产发展的需要。近年来,随着国家大力倡导农业生产的可持续发展,生物防治越来越受到重视,特别是利用真菌的代谢产物控制线虫病害在国内外已取得了显著的成果[6-7]。
目前已记载的杀虫真菌约100属800多种,白僵菌是研究和应用较多的一种,它的杀虫谱非常广泛,能寄生700余种昆虫和螨[8-10]。至1999年,在国际上白僵菌已有17种产品注册登记[11]。近年来有研究发现,白僵菌可产生白僵菌素[12]、球孢白僵菌素[13]、卵孢毒素以及其他毒素,其对植物线虫也具有活性[14]。刘霆等筛选出了1株具有杀线虫毒力的球孢白僵菌菌株Snf907,明确了其对根结线虫[14]、甘薯茎线虫[15]和大豆胞囊线虫[16]都有很强的毒杀作用。之后陈增齐等[17]研究发现,该菌株发酵液处理接种线虫的番茄幼苗后,对番茄根结线虫病害具有较好的防治效果,并且随着发酵液浓度的升高,番茄幼苗根内几种防御酶活性上升。刘丹丹等[18]通过活体检测方法,分别测定了不同浓度的球孢白僵菌发酵液对线虫死亡率的影响,并对杀虫活性物质进行了分离纯化,其纯度达97.38%。刘琼等[19]研究了球孢白僵菌代谢产物对南方根结线虫的作用机制,明确其通过抑制南方根结线虫的运动能力、呼吸作用和降低乙酰胆碱酯酶活性,同时干扰线虫体内糖和蛋白质的代谢,以及增加虫体内容物的渗漏,从而起到毒杀植物线虫的作用。
目前关于白僵菌发酵液对植物寄生线虫生物活性的研究仍较少,尤其对山药短体线虫的防治效果还未见报道。因此,本研究测定10种白僵菌菌株发酵液对山药短体线虫和黄瓜根结线虫的毒力,以期筛选出对2种线虫具有高毒力的菌株,为植物线虫防治提供理论依据,同时对1种昆虫病原线虫小卷蛾斯氏线虫(SteinernemacarpocapsaeAll)进行了生物活性测定,以明确白僵菌发酵液对生防线虫的影响。
1 材料和方法
1.1 试验材料
1.1.1 供试线虫 山药短体线虫(Pralylenchussp.)和黄瓜根结线虫(Meloidogynesp.)由河北农业大学植物保护学院生物防治实验室分离并保存,小卷蛾斯氏线虫(SteinernemacarpocapsaeAll)也由该实验室保存。
1.1.2 供试菌株及培养基 白僵菌菌株BD-B173、BD-B198、BD-B161、BD-B118、BD-B008-2、BD-B180、BD-B015、BD-B061-3、BD-B315、BD-B511由河北农业大学植物保护学院生物防治实验室提供。
菌种保存培养基为PDA培养基:马铃薯(去皮)200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 000 mL;发酵培养基为改良查氏液体培养基:蛋白胨5 g、酵母粉5 g、葡萄糖20 g、K2HPO40.5 g、MgSO40.5 g、KCl 0.5 g、蒸馏水1 000 mL。
1.2 试验方法
1.2.1 白僵菌发酵液的制备 25 ℃下用PDA培养基培养白僵菌7 d,在菌落边缘用5 mm直径的打孔器打菌饼2个,接种于装有50 mL灭菌改良查氏液体培养基的三角瓶内,25 ℃摇床振荡培养(150 r/min)7 d,培养好的白僵菌发酵液经8 000 r/min离心10 min去除孢子和菌丝体,将滤液置于4 ℃冰箱中保存备用。
1.2.2 植物线虫的分离和保存 山药短体线虫的分离和保存:将带有山药短体线虫的山药切成小块,放入铺有3层面巾纸、孔径大小为0.15 mm的筛子上,将筛子放入适宜大小的托盘内,然后向托盘内加水直至病组织完全浸没,静置24 h。将收集到的线虫液用灭菌水洗3次,放入4 ℃冰箱保存备用。
黄瓜根结线虫的分离与保存:将带有根结线虫的黄瓜根部剪成3~5 cm长的根段,放在盛有清水的培养皿中,剥掉根的表皮,挑出卵囊和雌虫。将卵囊和雌虫放在培养皿中,用0.5%次氯酸钠处理3 min,再用无菌水冲洗3次,置于25 ℃培养箱中进行孵化。3 d后将孵化的2龄幼虫放在培养皿中并加少量水,10 ℃保存备用。
1.2.3 白僵菌发酵液对线虫的活性测定 取洁净灭菌的24孔板,分别加入 200 μL 线虫悬液(内含线虫2龄幼虫约 130 条),再向其中滴加 200 μL白僵菌发酵液,混匀。以清水处理为对照(CK),每个处理重复3次,分别于24 h、48 h镜检并记录供试线虫总数和死亡数,计算线虫死亡率和校正死亡率。将处理靶标线虫24 h及48 h后校正死亡率分别达到80%及90%以上作为筛选标准[20]。
线虫死亡率=死亡线虫数/供试线虫数×100%
校正死亡率=(处理线虫死亡率-对照线虫死亡率)/(1-对照线虫死亡率)×100%。
所得数据经DPS软件统计处理,用Duncan氏新复极差法进行差异显著性分析。
2 结果与分析
2.1 白僵菌发酵液对山药短体线虫的室内毒力
由表1可知,10种白僵菌菌株发酵液对山药短体线虫的毒力存在显著性差异。处理24 h后,10株白僵菌菌株发酵液对山药短体线虫的毒力大小依次为:BD-B173>BD-B180>BD-B061-3>BD-B315>BD-B008-2>BD-B511>BD-B118>BD-B198>BD-B015>BD-B161。对山药短体线虫校正死亡率超过80%的菌株有BD-B173、BD-B180、BD-B061-3和BD-B315,其校正死亡率分别为97.20%、96.50%、91.16%、90.32%。
处理48 h后,10株白僵菌菌株发酵液对山药短体线虫的毒力大小依次为: BD-B180>BD-B173>BD-B315>BD-B061-3>BD-B511>BD-B008-2>BD-B118>BD-B198>BD-B015>BD-B161。对山药短体线虫的校正死亡率超过90%的菌株有BD-B180、BD-B173、BD-B315、BD-B061-3,其校正死亡率分别为97.67%、97.30%、94.40%、92.45%。虽然菌株BD-B511毒力也较高,在处理山药短体线虫48 h后校正死亡率达到82.14%,但尚未达到筛选标准。因此,处理24 h及48 h对山药短体线虫的校正死亡率超过80%及90%的菌株有BD-B173、BD-B180、BD-B061-3和BD-B315,这4株可以作为对山药短体线虫有高毒性潜力的生防菌株。
白僵菌菌株BD-B511和BD-B008-2的发酵液在处理山药短体线虫24 h与48 h的校正死亡率存在显著性差异。BD-B511处理山药短体线虫24 h后的校正死亡率为14.83%,48 h后的校正死亡率达到82.14%;BD-B008-2处理山药短体线虫24 h后的校正死亡率为17.73%,48 h后的校正死亡率为58.13%。
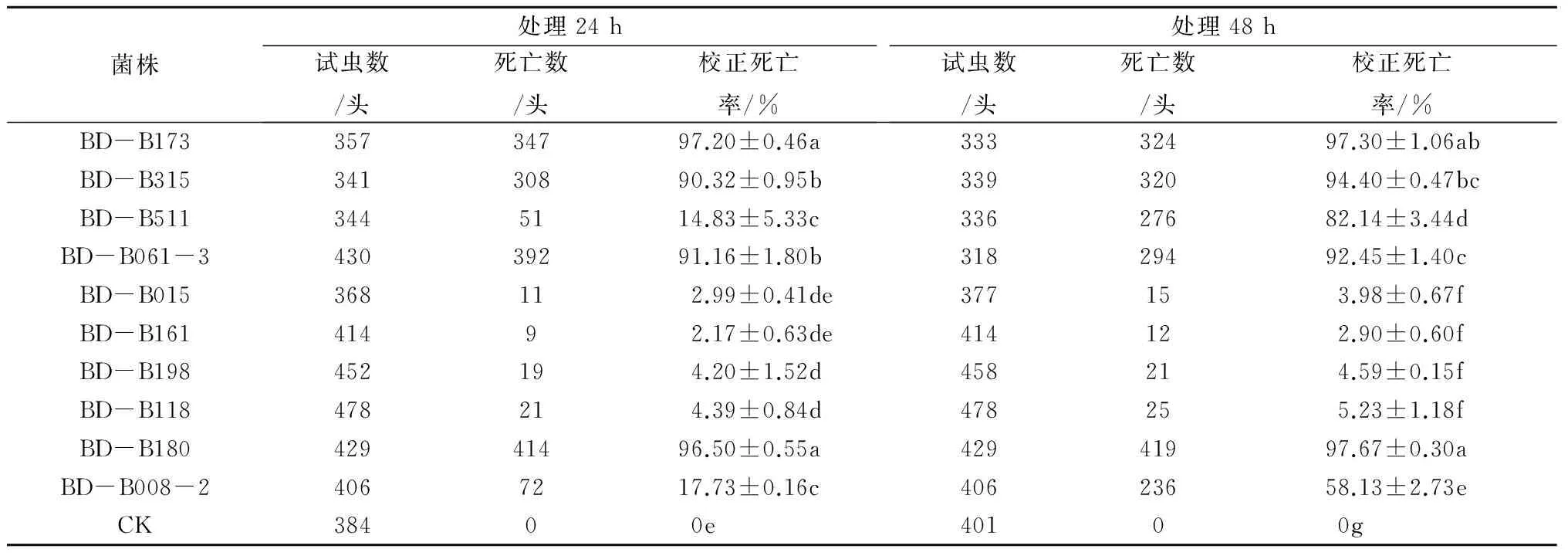
表1 白僵菌发酵液对山药短体线虫的室内毒力
注:同列数据后相同小写字母表示数据间无显著差异(P>0.05),下同。
2.2 白僵菌发酵液对黄瓜根结线虫的室内毒力
由表2可知,10种白僵菌菌株发酵液对黄瓜根结线虫的毒力存在显著性差异。处理24 h后,10株白僵菌菌株发酵液对黄瓜根结线虫的毒力大小依次为:BD-B061-3>BD-B198>BD-B118>BD-B008-2>BD-B173>BD-B511>BD-B315>BD-B180>BD-B015>BD-B161。对黄瓜根结线虫的校正死亡率超过80%的菌株有BD-B061-3、BD-B198、BD-B118,其校正死亡率分别为97.47%、91.65%、81.37%。
处理48 h后,10株白僵菌菌株发酵液对黄瓜根结线虫的毒力大小依次为:BD-B061-3>BD-B173>BD-B198>BD-B180>BD-B008-2>BD-B118>BD-B511>BD-B015>BD-B315>BD-B161。对黄瓜根结线虫校正死亡率超过90%的菌株有BD-B173、BD-B061-3、BD-B198,其校正死亡率分别为96.53%、98.73%、95.27%。虽然菌株BD-B180、BD-B008-2、BD-B118、BD-B511毒力也较高,在处理黄瓜根结线虫48 h后校正死亡率均达到80%以上,但尚未达到筛选标准。因此,处理24 h及48 h对黄瓜根结线虫的校正死亡率超过80%及90%的菌株有BD-B061-3、BD-B198、BD-B118、BD-B173,这4株可以作为对黄瓜根结线虫有高毒性潜力的生防菌株。
白僵菌菌株BD-B015和BD-B180的发酵液在处理黄瓜根结线虫24 h与48 h的校正死亡率存在显著性差异。BD-B015处理黄瓜根结线虫24 h后的校正死亡率为19.71%,48 h后的校正死亡率为78.98%;BD-B180处理黄瓜根结线虫24 h后的校正死亡率为28.68%,48 h后校正死亡率达到89.51%。
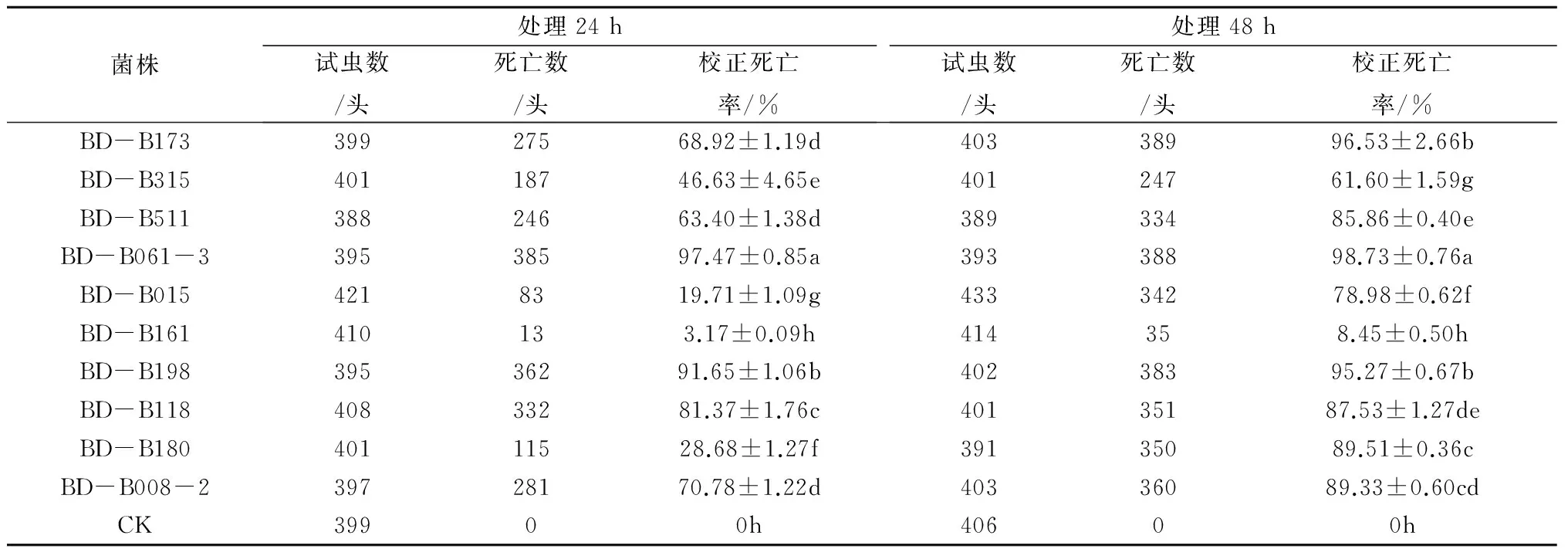
表2 白僵菌发酵液对黄瓜根结线虫的室内毒力
2.3 白僵菌发酵液对小卷蛾斯氏线虫的室内毒力
小卷蛾斯氏线虫是研究最多的昆虫病原线虫种类,用其作靶标对白僵菌菌株发酵液进行筛选有重要意义。由表3可知,10种白僵菌菌株发酵液对小卷蛾斯氏线虫的活性均较低,处理24 h和48 h校正死亡率均在10%以下,表明这10种菌株对昆虫病原线虫小卷蛾斯氏线虫均无强毒杀作用。

表3 白僵菌发酵液对小卷蛾斯氏线虫的室内毒力
3 结论与讨论
本试验结果表明,10种白僵菌菌株发酵液对植物线虫的毒力存在特异性,筛选出4株对山药短体线虫具有高毒力的菌株,分别为BD-B173、BD-B180、BD-B061-3、BD-B315,以及4株对黄瓜根结线虫具有高毒力的菌株,分别为BD-B061-3、BD-B198、BD-B118和BD-B173。其特异性的原因可能是白僵菌菌株发酵液中含有多种杀线虫活性物质,不同物质对不同种类线虫的作用位点不同,所以不同菌株的发酵液对线虫的生物活性存在差异,这与陈立杰等[21]的研究结果相同。研究还发现,白僵菌菌株BD-B173和BD-B061-3的发酵液对山药短体线虫和黄瓜根结线虫均有较高毒力,表现出较宽的杀虫谱。陈立杰等[21]研究发现,白僵菌发酵液对生防线虫小杆线虫表现出很强的活性,被杀死的小杆线虫体壁以及虫体内部物质不同程度消解,但本研究筛选出的对植物线虫具有高毒力的白僵菌菌株发酵液对昆虫生防线虫小卷蛾斯氏线虫均无强毒杀作用。至于这些白僵菌菌株发酵液有效杀线虫活性成分以及杀虫机制等问题,还有待进一步的研究。
[1] 冯志新.植物线虫学[M].北京:中国农业出版社,2001.
[2] 孙海生,王忠跃,樊秀彩,等.24份葡萄种质抗根结线虫特性的田间自然鉴定[J].中国南方果树,2008,37(1):56-59.
[3] 余永志,童凤林.两种新型杀线虫剂对黄瓜根结线虫的防治试验[J].长江蔬菜,2014(4):61-63.
[4] 刘奇志,童越敏,马涛,等.新生物杀线虫剂对线虫致死力室内测定[J].植物保护,2005,31(1):87-89.
[5] 姜双林,韩芬茹.杀虫剂对绣线菊蚜及其天敌的敏感性和选择性研究[J].甘肃农业大学学报,2005,40(2):157-160.
[6] 董锦艳,李国红,张克勤.真菌杀线虫代谢物的研究进展[J].菌物系统,2001,20(2):286-296.
[7] 向红琼,冯志新.粗皮侧耳生物学特性及其与杀线虫毒力的关系[J].植物病理学报,2000,30(3):271-278.
[8] 邓春生,张燕荣,张曼曼,等.球孢白僵菌可湿性粉剂对马铃薯甲虫的防治效果[J].中国生物防治学报,2012,28(1):62-66.
[9] Hatting J L,Wraight S P,Miller R M.Efficiency ofBea-weriabassianafor control of Russian wheat aphid on resistant wheat under yield conditions[J].Biocontrol Sci Techn,2004,14:459-473.
[10] Pu X Y,Feng M G,Shi C H.Impact of three application methods on the efficacy of aBeaweriabassiana-based mycoinsecticide against the false-eye leafhopper,Empoascavitisin tea canopy[J].Crop Protection,2005,24(2):167-175.
[11] 李增智.菌物在害虫、植病和杂草治理中的现状和未来[J].中国生物防治,1999,15(1):35-40.
[12] Hamill P L,Higgeus C E,Boan H E.The structure of beauvericin,a new depsipeptide antibiotic toxic toArtemiasalina[J].Tetrahedron Letters,1969,49:4255-4258.
[13] Suzuki A,Kanaoka M,Isogai A,etal.Bassianolide,a new insecticidal cyclodepsipeptide fromBeauveriabassianaandVerticilliumlecanii[J].Tetrahedron Letters,1977,18(25):2167-2170.
[14] Liu T,Wang L,Duan Y X,etal.Nematicidal activity of culture filtrate ofBeauveriabassianaagainstMeloidogynehapla[J].World J Microbiol Biotech,2008,24(1):113-118.
[15] 刘霆,王莉,段玉玺,等.Snf907真菌代谢物对甘薯茎线虫活性的影响[J].河南农业科学,2007(6):63-65.
[16] 刘霆,王莉,段玉玺,等.Snf907真菌代谢物对大豆胞囊线虫卵及二龄幼虫的影响[J].大豆科学,2006,25(3):325-328.
[17] 陈增齐,段玉玺,陈立杰,等.球孢白僵菌 Snf907 发酵液对番茄根结线虫病的控病效果及防御酶活性影响[J].农药,2009,48(4):304-306.
[18] 刘丹丹,段玉玺,陈立杰.Snf907-76发酵液杀线虫活性测定及活性物质分离纯化[J].农药,2007,46(9):644-646.
[19] 刘琼,刘晓宇,王媛媛,等.球孢白僵菌次生代谢产物对南方根结线虫的作用机制初探[J].农药学学报,2014,16(4):420-426.
[20] 赵迪,刘彬,李玲玉,等.白僵菌及其伴生菌发酵液对线虫的毒力研究[J].农药学学报,2013,15(2):178-182.
[21] 陈立杰,刘彬,段玉玺,等.白僵菌发酵液对不同种类线虫生物活性的影响[J].沈阳农业大学学报,2008,39(3):305-308.
Bioactivities of Fermentation Filtrate of 10BeauveriabassianaStrains on Plant Nematode and Entomopathogenic Nematode
LU Wenya1,ZHANG Li2,GUAN Meijuan1,DONG Jianzhen1*
(1.College of Plant Protection,Hebei Agricultural University,Baoding 071000,China;2.Plant Protection and Quarantine Station of Hebei Province,Shijiazhuang 050000,China)
To obtain efficient biocontrol resources for controlling nematodes,this study evaluated the to-xicity of fungal culture filtrates of 10Beauveriabassianastrains to two target nematodes,Pralylenchussp.andMeloidogynesp..Then their bioactivity was measured againstSteinernemacarpocapsaeAll,an entomopathogenic nematode.Results showed that BD-B173,BD-B180,BD-B061-3 and BD-B315 were high virulence strains forPralylenchussp..After 24 h,the corrected mortalities were 97.20%,96.50%,91.16% and 90.32%;After 48 h,the corrected mortalities were 97.30%,97.67%,92.45% and 94.40%,respectively.BD-B061-3,BD-B198,BD-B118 and BD-B173 were high virulence strains forMeloidogynesp..After 24 h,the corrected mortalities were 97.47%,91.65%,81.37% and 68.92%;After 48 h,the corrected mortalities were 98.73%,95.27%,87.53% and 96.53%,respectively.After treated with fermentation filtrates of 10Beauveriabassianastrains for 24 h and 48 h,the corrected mortality ofSteinernemacarpocapsaeAll was less than 10%.In comparison,there were significant differences among 10Beauveriabassianastrains in virulence against two species of plant nematodes.Almost all of the 10Beauveriabassianastrains had lower activity againstSteinernemacarpocapsaeAll.
Beauveriabassiana; fermentation filtrates; nematodes; biological activity
2015-07-01
河北蔬菜线虫防治专项;河北农业大学科研发展基金计划项目(1502013)
路文雅(1990-),女,河北衡水人,在读硕士研究生,研究方向:害虫生物防治。E-mail:xiaoyaya820815@163.com
*通讯作者:董建臻(1959-),男,河北博野人,教授,主要从事害虫生物防治和系统发育研究。E-mail:djz116@sina.com
S476.1
A
1004-3268(2016)02-0082-05
