miR-551b-3p在胰腺癌细胞和组织中的表达及其临床意义
2016-02-06吕小慧陈芦斌
郭 欣 吕小慧 吕 行 陈 勇 陈芦斌
miR-551b-3p在胰腺癌细胞和组织中的表达及其临床意义
郭 欣 吕小慧 吕 行 陈 勇 陈芦斌
目的 研究miR-551b-3p在胰腺癌细胞和组织中的表达,探讨其在胰腺癌发生发展中的临床意义。方法 利用实时定量聚合酶链反应(RT-PCR)技术分别检测4种胰腺癌细胞和正常胰腺导管上皮细胞,以及76对胰腺癌组织和癌旁组织中miR-551b-3p的表达水平,并对miR-551b-3p的表达与胰腺癌患者临床病理学特征进行分析。结果 miR-551b-3p在PANC-1、Aspc-1、SW1990和Miapaca-2四种胰腺癌细胞中的相对表达量分别为(0.125±0.012)、(0.179±0.005)、(0.672±0.025)、(0.577±0.019),低于其在正常胰腺导管上皮细胞HPDE6C-7中的相对表达量,差异有统计学意义(P<0.05)。在胰腺癌组织和癌旁组织中miR-551b-3p的ΔCt值分别为(7.254±0.112)和(3.993±0.098),差异有统计学意义(P<0.001)。TNM分期Ⅰ、Ⅱ、Ⅲ和Ⅳ期胰腺癌组织中miR-551b-3p的ΔCt值分别为(4.343±0.032)、(5.325±0.112)、(6.987±0.098)和(9.132±0.212),差异有统计学意义(P<0.001)。有淋巴结转移和无淋巴结转移患者的胰腺癌组织中miR-551b-3p的ΔCt值分别为(8.492±0.021)和(6.676±0.103),差异有统计学意义(P=0.012)。高、中、低分化胰腺癌组织中miR-551b-3p的ΔCt值分别为(5.349±0.092)、(6.129±0.112)、(8.454±0.065),差异有统计学意义(P=0.002)。结论 miR-551b-3p的表达与胰腺癌的分化程度、淋巴结转移以及TNM分期相关。miR-551b-3p可能是提示胰腺癌临床进展的潜在标志物。
胰腺癌;miR-551b-3p;淋巴结转移;临床分期
胰腺癌(PC)是恶性程度较高的恶性肿瘤之一[1],因其较强的侵袭性和早期转移能力,在中国肿瘤相关死亡中位列第四[2-3]。流行病学研究提示,胰腺癌的发病率在中国呈逐年升高趋势[4]。由于胰腺癌高度恶性的潜能和缺乏有效的早期症状,多数患者就诊时已有局部浸润或远处转移,此时以手术为主的综合治疗并不能显著改善预后[5]。因此,早期发现胰腺癌的恶性进展并加以干预,是改善预后的一种有效办法[6]。
微小核糖核酸(microRNA,miRNA)是一类普遍存在于动植物体内高度保守的非编码单链RNA,可通过与mRNA的3′非编码区完全或不完全结合来调控靶基因的转录和翻译功能,从而影响肿瘤细胞的生物学行为[7-8]。miR-551b-3p在多种恶性肿瘤中发挥着重要作用,与肿瘤的恶性进展密切相关[9-10]。本研究通过分析miR-551b-3p与胰腺癌细胞和胰腺癌患者的临床病理学特征的相关性,初步发现了miR-551b-3p在胰腺癌进展中的作用,为进一步研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 临床标本 收集2013年6月至2015年2月期间解放军第451医院确诊的胰腺癌患者的肿瘤组织和癌旁组织,所有组织标本均经病理检查证实,且患者术前均未接受放射治疗或化学治疗。临床标本共76对(肿瘤组织和癌旁组织),其中男性45例,女性31例;有淋巴结转移41例,无淋巴结转移35例;TNM分期Ⅰ期15例,Ⅱ期21例,Ⅲ期29例,Ⅳ期11例;高分化14例,中分化35例,低分化27例。所有组织标本于术后经生理盐水清洗后即放入液氮中冷却1 h,随后放入-80 ℃冰箱中长期保存。
1.1.2 细胞 人胰腺癌细胞株PANC-1、Aspc-1、SW1990和Miapaca-2以及人正常胰腺导管上皮细胞HPDE6C-7购自中科院上海生命科学研究院细胞研究所。
1.1.3 主要试剂 RPMI1640培养基和DMEM高糖培养基购自美国Gibco公司,胎牛血清购自杭州四季青公司,10%胰蛋白酶购自美国Sigma公司,miRNA抽提试剂盒、反转录试剂盒、聚合酶链反应(PCR)试剂盒购自美国Takara公司。
1.2 方法
1.2.1 miRNA抽提 常规培养细胞,按照抽提试剂盒说明书提取细胞或组织总的miRNA,应用紫外分光光度计测定miRNA的纯度和浓度,测定A260和A280吸光值,计算A260/A280,正常范围为1.8~2.1。
1.2.2 RT-PCR 按照反转录试剂盒说明书对miRNA加尾并进行cDNA合成,反应条件为37 ℃ 60 min、100 ℃ 1 min、4 ℃ 5 min。按照RT-PCR试剂盒说明书进行PCR检测,每个样品均设置3个复孔,反应条件为95 ℃ 15 min、58 ℃ 30 s、65 ℃ 30 s,共40个循环。利用Thermo480实时定量PCR仪检测,U6作为内参,细胞的结果以2-ΔΔCt代表相对表达量,组织的结果以Ct值反映cDNA的起始含量,起始含量越高则Ct值越低,相对表达量越高。
1.3 统计学处理
利用SPSS18.0软件进行统计学处理,结果以均数±标准差表示,两样本均数之间比较采用t检验,多样本均数之间采用方差分析,以α=0.05为检验水准,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-551b-3p在胰腺癌细胞中的表达
RT-PCR结果表明,在胰腺癌细胞株和正常的胰腺导管上皮细胞内均检测到miR-551b-3p表达。在PANC-1、Aspc-1、SW1990和Miapaca-2四种胰腺癌细胞株中,miR-551b-3p的相对表达量分别为(0.125±0.012)、(0.179±0.005)、(0.672±0.025)、(0.577±0.019),均显著低于正常胰腺导管上皮细胞内的表达(表达量设定为1,P<0.05)。
2.2 miR-551b-3p在肿瘤组织和癌旁组织的表达
RT-PCR结果表明,在76对标本中,在胰腺癌组织和癌旁组织中miR-551b-3p的ΔCt平均值分别为(7.254±0.112)和(3.993±0.098),miR-551b-3p在胰腺癌组织中的表达显著低于癌旁组织(P<0.001)。在有淋巴结转移和无淋巴结转移患者的胰腺癌组织中miR-551b-3p的ΔCt平均值分别为(8.492±0.021)和(6.676±0.103),差异有显著统计学意义(P=0.012)。
TNM分期Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期的患者miR-551b-3p的ΔCt平均值分别为(4.343±0.032)、(5.325±0.112)、(6.987±0.098)和(9.132±0.212),各组间差异有统计学意义(P<0.001);相应癌旁组织中miR-551b-3p的ΔCt平均值分别为(3.918±0.015)、(4.023±0.027)、(4.102±0.032)、(4.094±0.019),差异无统计学意义(P>0.05)。高、中、低分化胰腺癌组织中miR-551b-3p的ΔCt平均值分别为(5.349±0.092)、(6.129±0.112)、(8.454±0.065),各组间差异有统计学差异(P=0.002);相应癌旁组织中miR-551b-3p的ΔCt平均值分别为(3.877±0.015)、(3.989±0.032)、(4.121±0.041),差异无统计学意义(P>0.05)。详见表1。
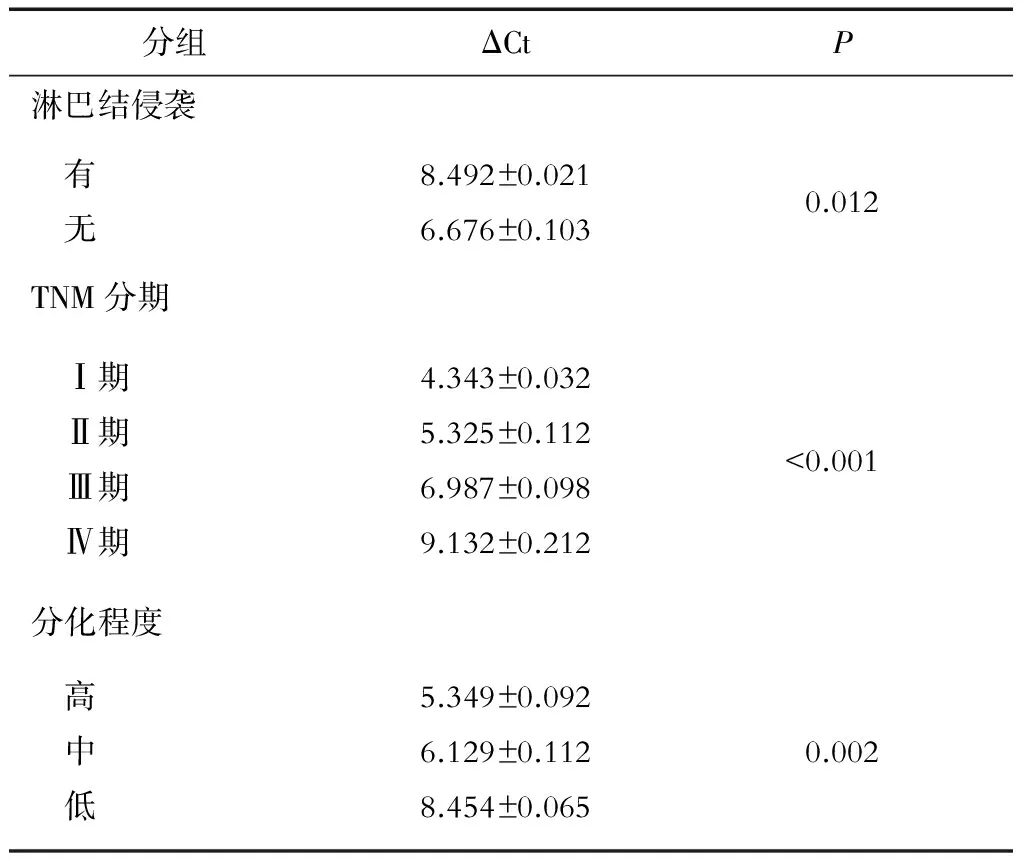
表1 miR-551b-3p在胰腺癌组织中的表达
2.3 miR-551b-3p的表达与胰腺癌患者临床病理学特征的关系
以胰腺癌组织miR-551b-3p平均表达水平为临界值(ΔCt=7.254),将所有患者分为高表达(ΔCt<7.254)和低表达(ΔCt>7.254)。分析显示,miR-551b-3p表达与胰腺癌患者的年龄、性别、肿瘤部位和大小无关(P>0.05),而与淋巴结侵袭、肿瘤分化程度和TNM分期相关(P<0.05)。见表2。
3 讨论
miRNA由miRNA基因转录形成初始的miRNA,随后经过一系列细胞内酶的作用,剪接为成熟的miRNA[11]。其后可通过与靶mRNA分子的互补配对结合,进而影响mRNA的稳定性和翻译过程,从而调控基因的表达[12]。一种miRNA可调控多种基因的表达,多种miRNA也可调控一种基因的表达。miRNA与肿瘤的关系十分密切,起到类似癌基因或抑癌基因的功能,从而调控肿瘤的多种生物学行为[13]。miRNA的表达在不同肿瘤中具有组织特异性,每种肿瘤有其特异的miRNA表达谱[14]。若miRNA在某种肿瘤中表达下调,则这些miRNA可能正性调节肿瘤细胞的某些生物学行为,如促进凋亡、抑制增殖等,从而发挥抑癌基因的作用;若miRNA表达上调,则可能负性调控细胞凋亡,进而发挥癌基因的作用[15]。
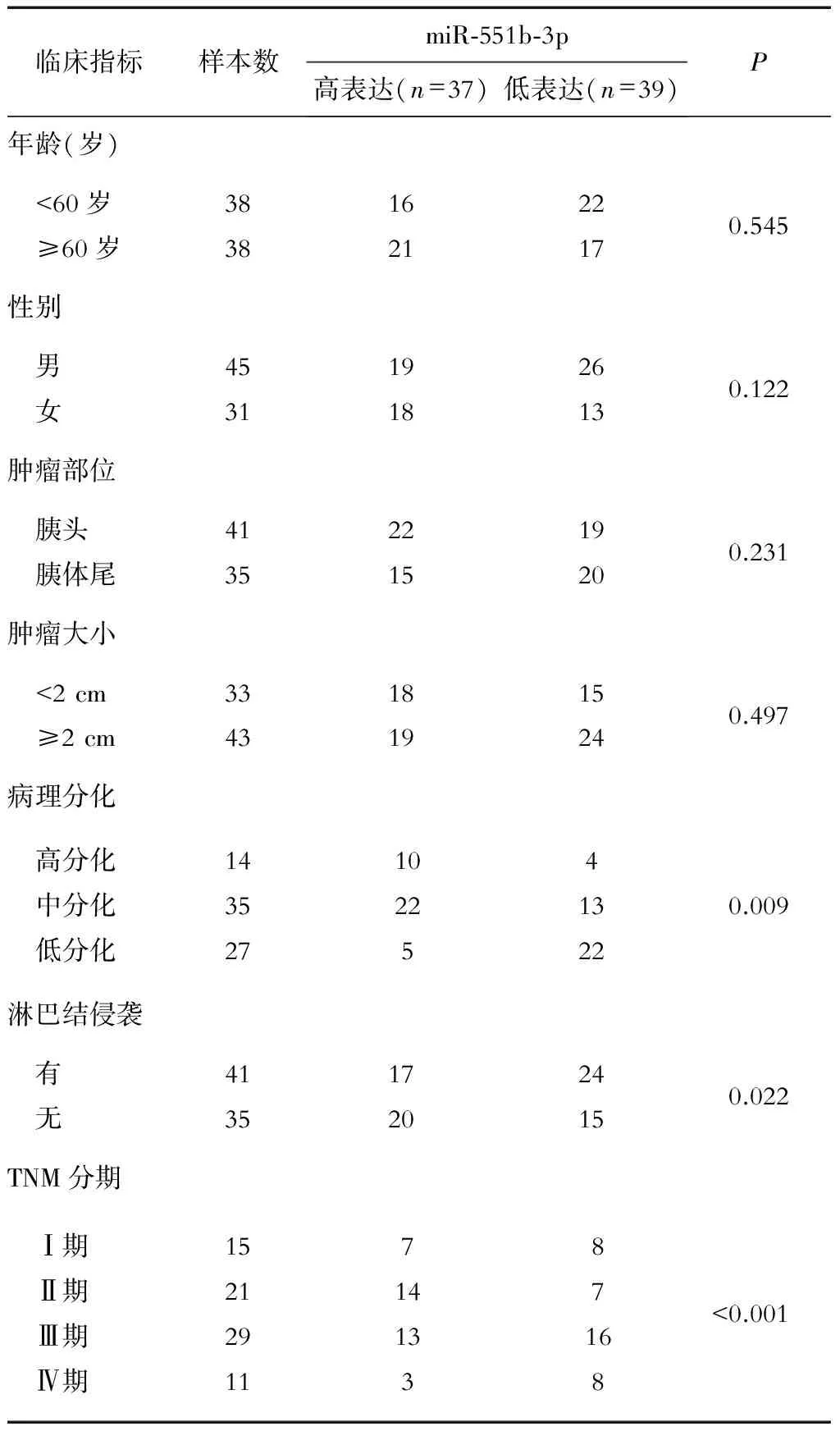
表2 胰腺癌患者miR-551b-3p表达水平与临床病理学特征的关系/例
Chen等通过高通量芯片技术发现在胃癌组织中miR-551b-3p呈低表达状态,并发挥抑癌基因作用[9]。另有研究表明,miR-551b-3p在胃癌组织中表达显著降低,并通过调控PRL-3基因的表达影响肿瘤细胞的侵袭和迁移能力[10]。Swierniak等[16]的研究发现,在乳头状甲状腺癌中miR-551b-3p呈高表达状态,并与肿瘤的发生发展密切相关。上述研究表明miR-551b-3p在肿瘤中表达的特异性。本研究发现,在胰腺癌组织中miR-551呈低表达,低于癌旁组织中的表达。miR-551b-3p在有淋巴结侵袭患者的胰腺癌组织中的表达低于无淋巴结侵袭的患者,表明miR-551b-3p的表达能负性调控胰腺癌的淋巴结侵袭。miR-551b-3p在Ⅰ~Ⅳ期胰腺癌组织中的表达水平逐渐降低,并且在高、中、低分化胰腺癌组织中的表达亦呈逐渐降低趋势,表明miR-551b-3p可能与胰腺癌的恶性进展呈负相关,即miR-551b-3p在胰腺癌中可能发挥抑癌基因的作用,负性调控肿瘤细胞的生长。临床病理学特征的分析提示,miR-551b-3p与胰腺癌患者的年龄、性别、肿瘤部位和大小无关,而与肿瘤的病理分化程度、淋巴结侵袭和TNM分期相关,与RT-PCR结果一致,也证明了miR-551b-3p在胰腺癌中的抑癌基因作用。
综上所述,miR-551b-3p的表达在胰腺癌的不同发展阶段存在差异,并与肿瘤的恶性行为相关,提示miR-551b-3p可能是一个新发现的在胰腺癌发生发展过程中起重要作用的分子,可能发挥抑癌基因作用,并可能成为提示胰腺癌临床进展的潜在标志物。
1 中华医学会外科学分会胰腺外科学组. 胰腺癌诊治指南(2014)[J]. 中华普通外科杂志, 2015, 30: 73-79.
2 胡应霞, 张海蓉. 微小RNA与胰腺癌关系研究进展[J]. 医学研究生学报, 2014, 27: 435-438.
3 姚汝铖, 郑军, 邢荣春. 微小RNA在胰腺癌中的研究进展[J]. 中华普外基础与临床杂志, 2012, 19: 911-915.
4 黄陈, 裘正军, 江弢, 等. 沉默STAT3基因对人胰腺癌细胞体内生长能力的影响[J]. 中华普通外科杂志, 2011, 26: 324-327.
5 孟庆才, 古宏晨, 黄新余. 微小RNA在胰腺癌诊疗中的研究进展[J]. 国际肿瘤学杂志, 2014, 41: 837-840.
6 潘峰, 闻洋, 马士杰, 等. 血浆miRNA表达谱与胰腺癌相关性的研究[J]. 南京医科大学学报:自然科学版, 2012, 32: 1541-1544.
7 王书艺, 焦锋, 王理伟. 微小RNA在胰腺癌早期诊断、疗效预测及预后判断中的研究进展[J]. 肿瘤, 2013, 33: 1023-1026.
8 王宇欣, 王凯旋, 李兆申. MicroRNA与胰腺癌疼痛关系的研究进展[J]. 中华胰腺病杂志, 2015, 15: 214-216.
9 Chen Z, Liu X, Hu Z, et al. Identification and characterization of tumor suppressor and oncogenic miRNAs in gastric cancer[J]. Oncol Lett, 2015, 10: 329-336.
10 Chen Z, Liu X, Liu M, et al. Expression of miR-551b-3p in gastric cancer cell lines and tissues and its clinical significance[J]. Zhonghua Zhong Liu Za Zhi, 2014, 36: 903-904.
11 杨增俊, 陈安. MicroRNAs在胰腺癌研究中的新进展[J]. 国际检验医学杂志, 2014, 35: 1755-1758.
12 新标志物有望微创诊断胰腺癌[J]. 标记免疫分析与临床, 2015, 22: 817.
13 尹健, 朱光辉, 单远洲, 等. miRNA在胰腺癌转移中的研究进展[J]. 肿瘤研究与临床, 2015, 27: 355-357.
14 张美霞, 徐细明, 余婷婷, 等. 肿瘤干细胞与微小RNA的研究进展[J]. 中国医药, 2015, 10: 1723-1725.
15 张伟, 陈国栋, 贺更生, 等. 微小RNA在胰腺癌侵袭转移中的作用及机制[J]. 国际肿瘤学杂志, 2014, 41: 454-457.
16 Swierniak M, Wojcidka A, Czetwertynska W, et al. In-depth characterization of the microRNA transcriptome in normal thyroid and papillary thyroid carcinoma[J]. J Clin Endocrinol Metab, 2013, 98: E1401-E1409.
(本文编辑:林磊)
Expression of miR-551b-3p in pancreatic cancer cells and tissues and its role in progression of pancreatic cancer
GUOXin,CHENLubin.
DepartmentofEndoscopicSurgery, 451Hospital,People′sLiberationArmy,Xian(710054),China;LVXiaohui.DepartmentofGynecologyandObstetrics,XijingHospitalAffiliatedtotheFourthMilitaryMedicalUniversity,Xian(710032),China;LVXing,CHENYong.DepartmentofHepatobiliarySurgery,XijingHospitalAffiliatedtotheFourthMilitaryMedicalUniversity,Xian(710032),China
Objective This paper intends to analyze the correlation between the expression of miR-551b-3p and the clinicopathological characteristics in pancreatic cancer (PC). Methods The expression of miR-551b-3p was analyzed by quantitative real-time PCR (RT-PCR) in pancreatic cancer cells, normal pancreatic ductal epithelial cells, and 76 paired PC samples. The relation between miR-551b-3p expression and clinicopathological characteristics was analyzed. Results The relative expression of miR-551b-3p in PC cells were lower than that in normal pancreatic ductal epithelial cells [(0.125±0.012), (0.179±0.005), (0.672±0.025), (0.577±0.019) vs 1,P<0.05]. The relative expression of miR-551b-3p in PC tissues was also lower than that in peritumoral tissues [(7.254±0.112) vs (3.993±0.098),P<0.001]. The relative expression of miR-551b-3p in tumors with different TNM stages were in stages Ⅰ, Ⅱ, Ⅲ, and Ⅳ, with a significant difference among them [(4.343±0.032), (5.325±0.112), (6.987±0.098), (9.132±0.212),P<0.001]. There was a significant difference between the relative expression of miR-551b-3p in PC with lymph node invasion and without lymph node invasion [(8.492±0.021) vs (6.676±0.103),P=0.012]. Different differentiation grades showed significantly different expression of miR-551b-3p [(5.349±0.092), (6.129±0.112), (8.454±0.065),P=0.002]. Conclusions The expression of miR-551b-3p is correlated with the differentiation grade, the TNM stage and the lymph node invasion, which may be a potential biomarker for the progression of PC.
Pancreatic cancer; MiR-551b-3p; Lymph node invasion; TNM stage
710054 陕西西安,解放军第451医院全军内镜中心(郭欣,陈芦斌);710032 陕西西安 第四军医大学附属西京医院妇产科(吕小慧),肝胆外科(吕行,陈勇)
陈芦斌,Email: aa175893204@126.com
10.3969/j.issn.1673-534X.2016.06.010
2016-05-18)
