蕙兰CfCIN基因克隆及其功能分析
2016-02-06李玉霞杨玉霞孙玉英王广东
李玉霞,杨玉霞,孙玉英,刘 松,王广东
(南京农业大学 园艺学院,南京 210095)
蕙兰CfCIN基因克隆及其功能分析
李玉霞,杨玉霞,孙玉英,刘 松,王广东*
(南京农业大学 园艺学院,南京 210095)
以蕙兰(CymbidiumfaberiRolfe)为试验材料,采用RT-PCR技术克隆了TCP家族的CIN同源基因,开放阅读框长1 161 bp,编码386 个氨基酸,将其命名为CfCIN(GenBank 登录号为KJ956809)。为进一步分析CfCIN的功能,构建了植物表达载体,采用农杆菌介导法转化非洲紫罗兰叶片,获得了转化植株并对转基因植株进行了性状分析。结果显示:与野生型非洲紫罗兰叶片相比,转基因植株的叶片更大,由圆形变为卵圆形,叶缘由平整光滑变为有缺刻且稍向后卷曲,叶脉明显,叶柄红,花器官形状变化不明显。研究表明,CfCIN可能参与调控植物叶片的形态建成。
蕙兰;CfCIN;基因克隆;转化;非洲紫罗兰
TCP 蛋白质是植物特有的含有一个TCP结构域的一类转录因子[1],它们广泛存在于从藻类到高等植物的基因组中,与细胞的增殖和生长有关[2-5]。TCP结构域命名来源于TeosinteBranched1(TB1)、Cycloidea(CYC)和ProliferatingCellFactors(PCFs)的第一个英文字母[1],凡具有这个结构域的基因都称为TCP结构域基因。TCP基因家族根据TCP结构域的差异性可分为2个亚族,一类以PCF1和PCF2为代表,一类以CIN和CYC/TB1为代表,后者可再细分为CYC/TB1分支和CIN分支[6]。其中CYC/TB1分支基因只在被子植物中存在,其大多数成员编码的蛋白质具有保守的 TCP 结构域、R 区(精氨酸富集)和 ECE(谷氨酸-半胱氨酸-谷氨酸)结构[7-8],它们在植株的分枝特性[9-10]和花的对称性[1-2, 11]方面发挥重要作用。与CYC/TB1分支不同,CIN分支成员编码的蛋白质结构差异较大,除均具有TCP 结构域外,部分具有R区或miR319靶序列,或者两者均不具有[6]。目前,CIN分支在物种中的功能研究相对较少,在金鱼草、拟南芥和番茄中,CIN同源基因限制了叶缘原基的细胞增殖。在金鱼草和拟南芥突变体中,叶片细胞持续分离影响了叶片的形状、大小和卷曲程度[12-16]。在番茄中,突变体叶缘不断生长导致复叶的小叶更大[17]。而在单子叶植物中对其功能的研究尚未见相关报道。
蕙兰(CymbidiumfaberiRolfe)是观赏价值较高的兰属植物,是中国栽培历史悠久和范围广泛的兰花之一。蕙兰叶带形、直立性强、叶姿雄伟,瓣型奇特、唇瓣发达,有别于其它已对CIN和CYC/TB1分支基因进行过详细研究的物种。研究蕙兰CIN和CYC/TB1分支基因,对认识该类基因的功能多样性以及培育叶形和株形改良的花卉新品种具有重要意义。
本研究的初衷是以单子叶植物蕙兰为材料,从其花器官中克隆TCP基因家族中调控花对称性的CYC分支基因,而通过序列分析发现所克隆基因中除CYC之外,有一个TCP基因属于CIN分支成员,因此拟通过转化试验进一步验证CIN分支基因的功能,已明确该基因是否对植物叶片形态建成及花发育等具有调控作用。
1 材料和方法
1.1 试验材料
试验于2012~2014年在南京农业大学进行。蕙兰幼嫩花蕾取自南京农业大学园艺学院观赏植物生物技术课题组资源圃。用于转化的非洲紫罗兰为在16 h光照,白天25℃、夜晚20℃条件下生长4周至长出幼嫩叶片的无菌苗。
1.2 方 法
1.2.1 DNA 和RNA 提取与cDNA合成 采用Trizol试剂盒(上海生工生物工程技术服务有限公司)提取蕙兰花蕾总RNA,采用CTAB试剂(上海生工生物工程技术服务有限公司)提取转基因非洲紫罗兰植株的基因组DNA和总RNA。采用TaKaRa 公司PrimeScriptTM RT reagent Kit 反转录试剂盒合成cDNA。
1.2.2 序列克隆与分析 采用Trizol试剂法提取总RNA, 取2 μL RNA样品于1.2%琼脂糖凝胶上进行电泳(125 V,25 min),GelRed荧光染料(Biotium公司)染色,用凝胶成像系统(Tanon GIS2500)进行观察拍照,检测RNA条带的完整性。于Microtube 管中混合下列试剂:Total RNA 1 μL, Oligo (dT)18 Primer (50 μmol/L) 1 μL, RNase Free ddH2O 5 μL, 70 ℃水浴保温10 min,迅速冰上冷却超过2 min。瞬时离心,使模板RNA/引物的变性混合液聚集于Microtube管底。在上述Microtube管中加入下列反转录反应液:上述模板RNA/引物变性混合液7 μL, 5× M-MLV Buffer 2 μL, dNTPs Mixture (10 mmol/L) 0.5 μL, RNase Inhibitor (40 U/μL) 0.25 μL, RTase M-MLV (RHase H-,200 U/μL)0.25 μL, 共10 μL,42 ℃延伸1 h。70 ℃保温15 min 后冰上冷却,得到的cDNA置于-20 ℃保存备用。
从GenBank 上下载已登录的金鱼草(AntirrhinummajusY16313)、拟南芥(ArabidopsisthalianaNP_567553)、水稻(OryzasativaNP_001044333)和非洲菊(GerberahybridaEU429303)等 TCP同源基因序列的保守区设计特异性引物ZJF和ZJR扩增TCP基因的保守区。

表1 引物序列及使用
通过PCR 扩增中间片段,根据所测中间片段序列(包含5′端)设计1个上游特异性引物F-3(表1),根据蝴蝶兰(PhalaenopsisamabilisPATC135086)TCP基因的3′端保守区域设计一个下游特异性引物R-3(表1)。94℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃延伸10 min;4 ℃保存。
利用UNIQ-10 柱式DNA 胶回收试剂盒(上海生工生物工程技术服务有限公司)将扩增产物回收,凝胶电泳检测后,采用Biomiga公司pEASY-T3 Cloning Kit 连接,转化于DH5α感受态细胞,蓝白斑筛选,经菌液PCR 初步鉴定后送上海华大基因公司测序。 最后根据DNAMAN 5.0 软件拼接序列获得蕙兰CfCIN完整开放阅读框序列。根据拼接出的序列利用Primer Premier 5.0 设计开放阅读框特异性引物QF和QR(表1)扩增CfCIN完整ORF,同样将扩增产物回收、连接、转化、筛选后测序。
利用NCBI网站进行基因的序列比对和最大开放阅读框(Open Reading Frame,ORF)在线分析(http://www.ncbi.nlm.nih.gov),通过Blast进行氨基酸序列比对和保守域的查找分析(http://blast.ncbi.nlm.nih.gov/blast.cgi),利用DNAMAN 5.0软件对不同物种间氨基酸序列的同源性进行比对分析以及构建不同物种间的系统进化树。
1.2.3 载体构建与非洲紫罗兰转化 测序正确的转化子利用BglII和SpeI双酶切,连接到含有Hyg抗性基因的pCambia1302 载体上,经过酶切和测序(测序用载体引物CfCIN-F/CfCIN-R,表1),检测正确的重组质粒利用冻融法转入农杆菌LBA4404。
CfCIN基因采用农杆菌介导法转化非洲紫罗兰:取大小约为1.0 cm2的非洲紫罗兰幼嫩叶片,接种于分化培养基(MS + 0.5 mg·L-16-BA + 0.02 mg·L-1NAA + 30 g·L-1蔗糖+ 6.5 g·L-1琼脂,pH5.8)上,预培养2 d。预培养的叶片,放入农杆菌悬浮菌液中震荡侵染 30 min;吸干表面菌液,将侵染叶片接种于共培养培养基,分化培养基添加100 μmol·L-1乙酰丁香酮(AS),暗培养3 d。以本实验室确定的潮霉素(Hyg)浓度40 mg·L-1作为筛选压,转接叶片于筛选培养基[分化培养基 + 头孢霉素(Cef) 500 mg·L-1+ Hyg 40 mg·L-1],每20 d更新一次筛选培养基,直至长出抗性芽。当小苗长至2 cm左右时,转至生根培养基(MS + 0.1 mg·L-1NAA + 30 g·L-1蔗糖+ 6.5 g·L-1琼脂,pH5.8)中,待长出根系后移栽至温室,长至开花。
1.2.4 转基因非洲紫罗兰的鉴定 采用CTAB法提取抗性植株的基因组DNA和总RNA,分别设计CfCIN基因的特异性引物CIN-F1、CIN-R1和CIN-F2、CIN-R2,进行PCR和RT-PCR检测。验证目的基因是否整合以及在转录水平的表达。将验证成功的非洲紫罗兰转基因植株和野生型植株,同时移栽到蛭石∶草炭土∶珍珠岩=9∶3∶1的基质中,定植于南京农业大学园艺学院温室中,在25 ℃,自然光照条件下,观察非洲紫罗兰转化植株和野生型植株的生长情况,对比叶形和花型特征。
2 结果与分析
2.1 CfCIN序列的获得
对扩增产物分别进行回收、连接、转化、筛选后测序,得到长534 bp中间序列(包含5′端;图1,A),Blast 在线对比发现含有TCP保守结构域,初步证实属TCP基因家族。根据设计的3′端特异性引物,最终获得873 bp 3′端cDNA 片段序列(图1,B)。利用引物QF 和QR 特异性扩增出蕙兰CfCIN完整开放阅读框序列(图1,C),测序结果显示ORF序列长为1 161 bp,不具有R区、ECE结构域及miR-NA319靶序列,推测其编码的蛋白质由386个氨基酸残基组成(图2)。NCBI 在线分析同源性后,命名该基因为CfCIN(登录号KJ956809)。
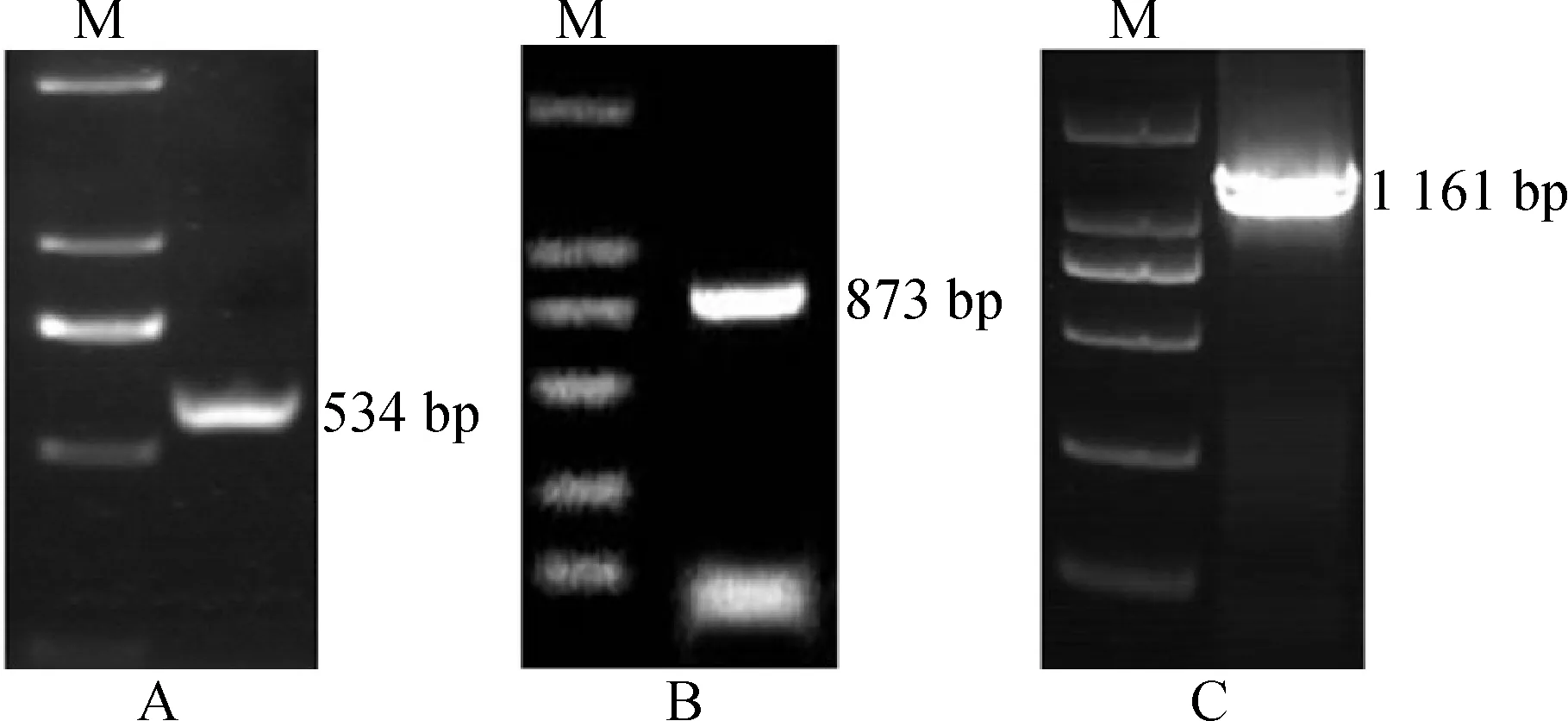
M. Marker图1 蕙兰CfCIN 基因中间片段(A)、3′ 端(B)及全长(C)扩增结果Fig.1 The PCR results of conservative fragments(A), 3′ fragments(B)and full-length of CfCIN (C)

方框部分代表TCP-domain图2 蕙兰CfCIN的ORF和推导氨基酸序列The TCP-domain is the boxFig.2 The ORF and amino acid sequence of CfCIN
2.2 CfCIN基因氨基酸序列同源比较
利用DNAman对蕙兰CfCIN编码氨基酸和其他物种TCP基因编码氨基酸进行序列比对,发现该蛋白质与金鱼草、番茄及黄瓜等植物蛋白质氨基酸序列相似性较高,且具有TCP基因家族共同特征,都含有一个相对较保守的TCP结构域(图3),说明该蛋白质属于TCP蛋白质家族。
2.3 CfCIN与其他物种TCP 的系统进化树分析
利用DNAMAN软件将蕙兰CfCIN基因与GenBank数据库中已登录的15种TCP氨基酸序列构建系统进化树(图4),可见蕙兰CfCIN与金鱼草、番茄及黄瓜亲缘关系最近,与金鱼草AmCIN在进化上具有相同的起源,推测蕙兰CfCIN同样具有AmCIN参与叶形态发生的功能。
2.4 转基因非洲紫罗兰的获得及验证
CfCIN基因经双酶切从TA克隆中卸载,并且经分子操作成功连接到了pCambia1302载体,所获得的pC1302-CfCIN表达载体经过测序和双酶切,证实构建正确(图5)。
经潮霉素(Hyg)抗性筛选,共获得32株抗性植株。分别利用CfCIN基因的特异性引物对随机挑选的5株非洲紫罗兰转化植株进行PCR和RT-PCR扩增,结果表明CfCIN基因已转入非洲紫罗兰,并能在转录水平表达(图6)。
2.5 转CfCIN基因非洲紫罗兰植株的表型分析
本研究所用的野生型非洲紫罗兰叶片为圆形,正面全被毛,背部带紫色,稍肉质,叶缘平整光滑,叶脉不明显,叶柄稍红(图7, A, C~E)。利用农杆菌介导法,将CfCIN基因导入非洲紫罗兰植株中,以观察外源基因对异源物种叶型的影响。
从获得的32株转化植株中随机挑选10株,分别从每一株转化植株中随机挑选3片叶片,对其叶片形态进行观察。发现与野生型非洲紫罗兰叶片相比,转化非洲紫罗兰叶片的结构受到不同程度的影响。主要有以下几种表型变化:叶片更大,由圆形变为卵圆形,叶缘由平整光滑变为有较浅的缺刻且稍向后卷曲,叶脉更明显,叶柄更红(图7, A, B, F~H)。转化植株与野生型植株在温室自然光照条件下生长至开花,观察其花器官特征,发现转化植株与野生型植株花器官结构基本相同,均会出现单瓣和重瓣表型(可能受光照等环境条件影响),但转化植株与野生型植株相比花瓣数有增加的趋势,且花瓣多不规则,卷曲程度明显,少量花器官内部又分化出多层花瓣,部分花器官花药顶部分化出不完整花瓣(图7, I),这些变化表明CfCIN基因除了影响非洲紫罗兰叶片的表型,使叶片形态发生了一定程度的改变,同时对花器官发育也具有一定的影响,但CfCIN单个基因影响较弱,未能明显改变叶形和花型,可能需要与其他基因共同作用参与叶片和花器官的发育过程。

图3 CfCIN 编码氨基酸序列与其它植物的TCP序列比对分析Fig.3 Alignment of amino acid sequence of CfCIN with TCP sequence from other plants

图4 CfCIN的系统进化树分析Fig.4 The phylogeny of plant TCP polypeptides
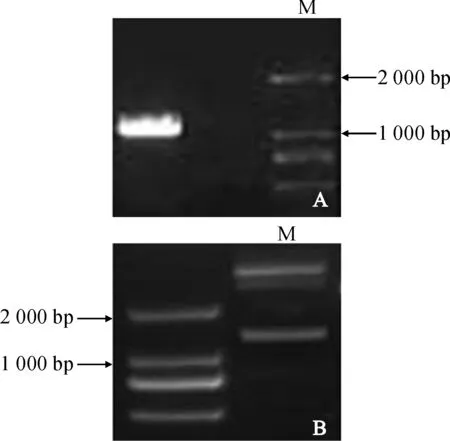
图5 CfCIN的PCR 扩增(A)及重组质粒pC1302-CfCIN(B)酶切结果Fig.5 PCR amplification of CfCIN(A)and identification of the construct by digestion of pC1302-CfCIN with Bgl Ⅱ and Spe I(B)
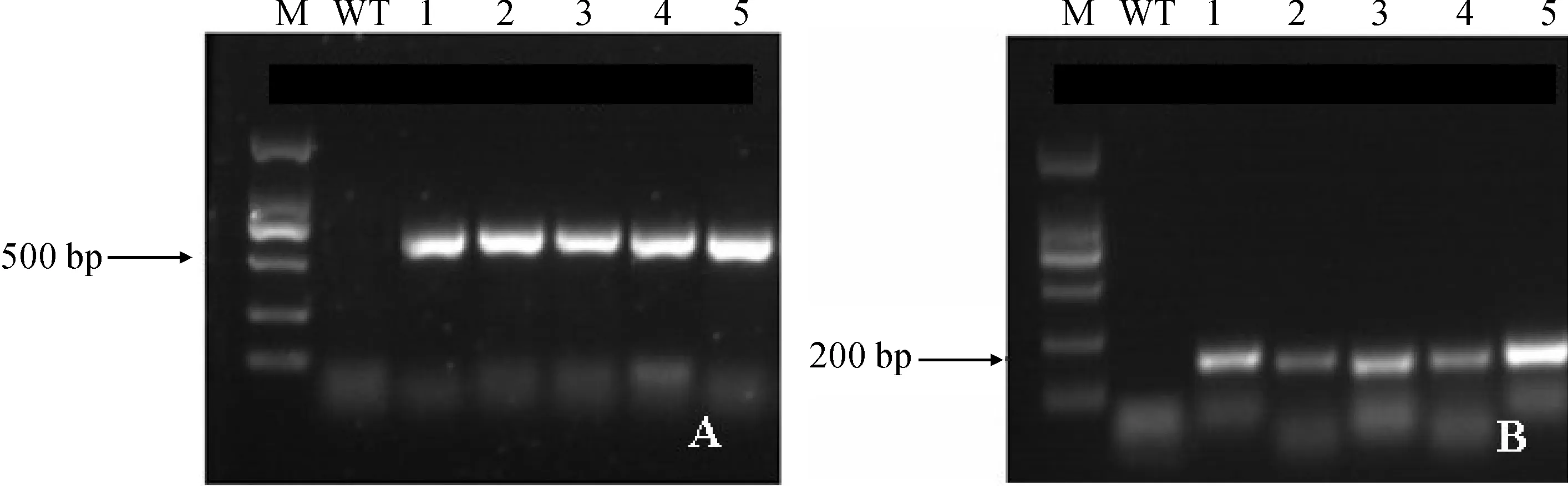
M. Marker; WT. 野生型非洲紫罗兰; 1~5. 转基因非洲紫罗兰图6 CfCIN基因的PCR(A)和RT-PCR(B)检测结果M. Marker; WT. Wild type Saintpaulia ionantha; 1-5. Transgenic S. ionanthaFig.6 PCR (A) and RT-PCR (B) results of CfCIN

A. 野生型与转化非洲紫罗兰; B. 野生型(WT)与转化非洲紫罗兰叶片(a. 明显叶脉; b. 缺刻叶缘; c. 卷曲叶缘); C~H.野生型(C~E)和转化非洲紫罗兰不同株系(F~H)的开花状态; I. 野生型(WT)与转化植株的花器官对比。标尺=1 cm图7 转CfCIN基因非洲紫罗兰叶片和花器官的特征A. Wild type(WT) and transgenic plant; B. Leaf of wild type(WT)and transgenic plants (a. Obvious veins; b. Nicked leaf margin; c. Curly leaf margin); C-H. Flowering of wild type(C, D, E)and transgenic plants(F, G, H); I. Single flower of wild type(WT)and transgenic plants. Bar=1 cmFig.7 Characters of leaf and flower of wild type and transgenic plant in S. ionantha
3 讨 论
迄今,已经在多个物种中发现并克隆了TCP结构域基因。作为一个多基因家族,TCP基因家族成员在单子叶和双子叶植物中分布极其广泛,推测在进化过程中,各个成员可能在不同时期被招募来控制不同的发育途径,从而开始功能的进化,执行不同的功能。通过对已有TCP家族基因功能的研究发现,TCP基因在多种植物中与花器官发育、腋芽生长和茎叶发育等过程密切相关,它的不同成员在不同物种中参与了不同形态发生和发育过程[1, 3, 9, 18-20]。本研究从蕙兰中克隆到一个CIN分支成员CfCIN,仅具有TCP保守区域,编码含有386个氨基酸的完整开放阅读框,综合氨基酸序列同源性比对及系统进化树分析,CfCIN与金鱼草AmCIN在进化上具有相同的起源,可能同样具有AmCIN参与调控植物叶形态发生的功能。
目前,CIN分支成员控制叶片形态发生的功能已经在双子叶植物如金鱼草[13]、拟南芥[14]、番茄[17]中有研究报道,且以在拟南芥中研究最多。在拟南芥中已发现包含TCP2~5、10、13、17、24等8个CIN成员。其中TCP2~4、10和24等5个成员的编码区域都含有miR319作用序列,在miR319的超表达突变体jaw-D中,这5个基因表达量显著下调,与野生型相比,突变体表现出叶片褶皱、叶缘卷曲等表型。有趣的是,单独的过表达TCP2或TCP4没有表现出明显的表型,推测是miR319靶序列可以降解这类基因,而对TCP基因内部的miR319进行人为突变,阻遏其降解基因的转录后,35S:mTCP2、35S:mTCP4表现为杯状子叶及狭长叶片等表型[14]。Schommer 等[16]也同样证实了这点,发现具有miR319靶序列的CIN同源基因的单突变体无明显的表型,而双突变体TCP2,TCP4及三突变体TCP2、TCP4、TCP10均具有类似jaw-D的表型,并且突变基因数量越多,表型越明显。认为具有靶序列miR319的CIN小组成员受到其强烈调控,而不具有靶序列miR319的CIN分支基因的单突变体表型明显[17, 21-22 ]。本研究得到的CfCIN不具有miR319靶序列,没有受到其强烈调控,因此在CfCIN过表达的转基因非洲紫罗兰植株中,发现其叶片的大小、形状及卷曲度均发生了轻微的改变,但对花型变化影响较小,这与之前研究结果一致。表明CfCIN可能参与调控蕙兰叶片形态建成,但可能需要与其他基因协同作用,研究结果对深入研究TCP基因的功能及培育叶形性状改良的花卉新品种具有一定的参考价值。
[1] CUBAS P, LAUTER N, DOEBLEY J,etal. The TCP domain: a motif found in proteins regulating plant growth and development[J].PlantJ, 1999, 18:215-222.
[2] LUO D, CARPENTER R, COPSEY L,etal. Origin of floral asymmetry inAntirrhinum[J].Nature, 1996, 383: 794-799.
[3] KOSUGI S, OHASHI Y.PCF1 andPCF2 specifically bind to cis elements in the riceproliferatingcellnuclearantigengene[J].PlantCell, 1997, 9: 1 607-1 619.
[4] LI C, POTUSCHAK T, COLON-CARMONA A,etal.ArabidopsisTCP20 links regulation of growth and cell division control pathways[J].ProcNatlAcadSciUSA, 2005, 102: 12 978-12 983.
[5] KIEFFER M, MASTER V, WAITES R,etal.TCP14 andTCP15 affect internode length and leaf shape inArabidopsis[J].PlantJ, 2011, 68: 147-158.
[6] MARTⅠN-TRILLO M, CUBAS P. TCP genes: A family snapshot ten years later[J].TrendsinPlantScience, 2010, 15: 31-39.
[7] HOWARTH DG, DONOGHUE MJ. Phylogenetic analysis of the ‘ECE’ (CYC/TB1) clade reveals duplications predating the core eudicots[J].ProNatlAcadSciUSA, 2006, 103: 9 101-9 106.
[8] NAVAUD O, DABOS P, CARNUS E,etal. TCP transcription factors predate the emergence of land plants[J].JMolEvol., 207, 65: 23-33.
[9] DOEBLEY J, STEC A, HUBBAED L. The evolution of apical dominance in maize[J].Nature, 1997, 386(6 624): 485-488.
[10] STUDER A, ZHAO Q, ROSS-IBARRA J,etal. Identification of a functional transposon insertion in the maize domestication gene tb1[J].NatGenet, 2011, 43: 1 160-1 163.
[11] BROHOLM SK, TAHTIHARJU S, LAITINEN RA,etal. A TCP domain transcription factor controls flower type specification along the radial axis of theGerbera(Asteraceae) inflorescence[J].ProcNatlAcadSciUSA, 2008, 105: 9 117-9 122.
[12] HUBBARD L, MCSTEEN P, DOEBLEY J, HAKE S. Expression patterns and mutant phenotype of teosinte branched1 correlate with growth suppression in maize and teosinte[J].Genetics, 2002, 162: 1 927-1 935.
[13] NATH U, CRAWFORD BC, CARPENTER R,etal. Genetic control of surface curvature[J].Science, 2003, 299: 1 404-1 407.
[14] PALATNIK JF, ALLEN E, WU X,etal. Control of leaf morphogenesis by microRNAs[J].Nature, 2003, 425: 257-63.
[15] EFRONI I, BLUM E, GOLDSHMIDT A,etal. A protracted and dynamic maturation schedule underliesArabidopsisleaf development[J].PlantCell, 2008, 20: 2 293-2 306.
[16] SCHOMMER C, PALATNIK JF, AGGARWAL P,etal. Control of jasmonate biosynthesis and senescence bymiR319 targets[J].PLoSBiol, 2008, 6: e230.
[17] ORI N, COHEN AR, ETZIONI A,etal. Regulation ofLANCEOLATEbymiR319 is required for compound-leaf development in tomato[J].NatGenet, 2007, 39: 787-91.
[18] KOSUGI S, OHASHI Y. DNA binding and dimerization specificity and potential targets for the TCP protein family[J].PlantJ, 2002, 30: 337-348.
[19] 赵 忠. 豆科模式植物百脉根中TCP domain 基因的生物学功能与花瓣发育的研究[D]. 上海: 复旦大学, 2003.
[20] CUBAS P. Floral zygomorphy: the recurring evolution of a successful trait[J].Bioessays, 2004, 26(11): 1 175-1 184.
[21] PALATNIK JF, WOLLMANN H, SCHOMMER C,etal. Sequence and expression differences underlie functional specialization ofArabidopsismicroRNAsmiR159 andmiR319[J].DevCell, 2007, 13: 15-25.
[22] NAG A, KING S, JACK T.MiR319a targeting ofTCP4 is critical for petal growth and development inArabidopsis[J].ProcNatlAcadSciUSA, 2009, 106: 22 534-22 539.
(编辑:宋亚珍)
Isolation and Functional Verification ofCfCINinCymbidiumfaberi
LI Yuxia, YANG Yuxia, SUN Yuying, LIU Song, WANG Guangdong*
(College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China)
Flower bud ofCymbidiumfaberiwas chosen as experiment material for gene cloning. ACIN-like gene of TCP family was amplified through RT-PCR technique and named asCfCIN(GenBank accession number KJ956809). The Open Reading Frame (ORF) ofCfCINis 1 161bp in length and encodes a protein with 386 amino acids. To investigate the specific functions ofCfCIN, we constructed the expression vector and introduced it intoSaintpauliaionanthabyAgrobacterium-mediated method. Phenotypic analysis showed that the leaves of transgenic plants were bigger and changed from circular to oval. Margin of leaves changed from flat and smooth to slightly notched and back curly. Leaf veins were obvious and petioles were redder than wild type plants. There was no obvious difference in flower shape between the transgenic plants and wild type plants. These result indicated thatCfCINmight participate leaf development.
Cymbidiumfaberi;CfCIN; gene cloning; transformation;Saintpauliaionantha
1000-4025(2016)12-2354-07
10.7606/j.issn.1000-4025.2016.12.2354
2016-10-16;修改稿收到日期:2016-12-09
国家自然科学基金(31372101)
李玉霞(1988-), 女, 硕士研究生, 主要从事园林植物与观赏园艺研究。E-mail: 2011104128@njau.edu.cn
*通信作者:王广东, 博士, 副教授, 主要从事观赏植物生物技术研究。E-mail: gdwang@njau.edu.cn
Q785;Q789
A
