盐酸沃尼妙林与猪鸡兔血浆蛋白结合率的检测和比较
2016-02-06周文杰周宇峰何杰舜刘雅红
周文杰 , 周宇峰 , 李 晓 , 何杰舜 , 刘雅红 , 孙 坚
(华南农业大学兽医学院 , 广东广州510642)
盐酸沃尼妙林与猪鸡兔血浆蛋白结合率的检测和比较
周文杰 , 周宇峰 , 李 晓 , 何杰舜 , 刘雅红 , 孙 坚
(华南农业大学兽医学院 , 广东广州510642)
本试验采用超滤法结合高效液相色谱-串联质谱法(HPLC-MS/MS)测定沃尼妙林与猪、鸡和兔血浆蛋白结合率,并对血浆中不同浓度沃尼妙林的蛋白结合率进行比较。结果表明,建立的液相色谱-串联质谱联用法用于沃尼妙林生物样品的测定具有简便、灵敏与选择性高的特点。沃尼妙林具有较强的血浆蛋白结合率,其在猪、鸡和兔血浆中的平均蛋白结合率分别为84.4%±1.07%,87.5%±1.83%和86.6%±1.96%。沃尼妙林的血浆蛋白结合率在0.1~10 μg/mL的考察浓度范围内无显著性差异,蛋白结合呈现非浓度依赖的特性。
沃尼妙林;血浆蛋白结合率;超滤法;HPLC-MS/MS
沃尼妙林是新一代兽医专用的截短侧耳素(pleuromutilin)类半合成抗生素,因其抗菌谱广、吸收快、分布广、毒性小、残留低,且不易产生耐药性等特点,常用于预防和治疗猪痢疾、结肠螺旋体病和地方性肺炎等,同时也被欧盟批准用于防治鸡慢性呼吸道病和兔的流行性肠炎[1]。研究表明,沃尼妙林对革兰阳性菌、胸膜肺炎放线杆菌、副猪嗜血杆菌、支原体和螺旋体等具有良好的抗菌作用[2-3]。药物血浆蛋白结合率是指药物与血浆蛋白结合的百分数,是药代动力学的重要参数之一,其通过影响药物在体内的分布、代谢与排泄过程,从而影响药物药理作用的发挥,尤其对药物的临床应用具有重要的指导意义[4]。本试验拟采用超滤法结合HPLC-MS/MS法对沃尼妙林的血浆蛋白结合率进行研究,通过分别测定沃尼妙林与猪、鸡、兔三种靶动物血浆的蛋白结合率,为指导临床上沃尼妙林的科学合理用药提供数据依据。
1 材料与方法
1.1 药品与试剂 盐酸沃尼妙林原料药(含量为99.2%,广东大华农动物保健品有限公司);乙腈(德国Merck公司,色谱纯);甲酸(美国Fluka公司,色谱纯);三氯乙酸(广州化学试剂厂,分析纯);去离子水(Milli-Q超纯水系统,Academic A10型),其他试剂为分析纯。
1.2 仪器 高效液相色谱仪(美国Agilent公司1200型,配备四元泵、脱气机、自动进样器、柱温箱等);电喷雾-串联四极杆质谱仪(API 4000质谱仪,美国AB SCIEX公司);高速冷冻离心机(美国Thermo Fisher Scientific公司);超滤离心管(美国Millipore公司,Amicon Ultra-0.5系列,MWCO 10 kDa),Strata-X-C固相萃取小柱(60mg,3 mL,美国Phenomenex公司);氮气浓缩仪(美国Oranomation Associates,Jnc.公司);电子分析天平(日本岛津公司,AUW120D型);涡旋混合器(美国SCILOGEX公司);隔热式培养箱(美国Thermo Fisher Scientific公司)。1.3 溶液的配制 沃尼妙林储备液:精密称取53.66 mg盐酸沃尼妙林于50 mL容量瓶中,去离子水定容得1 g/L的沃尼妙林储备液。磷酸缓冲液(PBS):精密称取磷酸氢二钾19.03 g,磷酸二氢钾2.08 g,氯化钠4.4 g于1 L容量瓶中,去离子水溶解并定容得pH值7.4磷酸缓冲液。
1.4 血浆的采集 新西兰兔(雌性和雄性各2只,体重1.8 ± 0.17 kg),购自广东省医学实验动物中心。耳缘静脉采血,3 000 r/min离心10 min,分离血浆,置于4 ℃冰箱中冷冻备用。空白猪血浆和鸡血浆,购自广州蕊特生物科技有限公司。
1.5 超滤液前处理方法 取100 μL超滤液,加入400 μL水混匀后进行固相萃取(SPE)处理:2 mL甲醇活化小柱,2%甲酸水平衡,超滤液过柱,依次用2%甲酸水和甲醇淋洗,用2 mL 5%氨甲醇洗脱,洗脱液于45 ℃下氮气吹干,500 μL 50%乙腈水复溶。
1.6 色谱与质谱条件[5]色谱柱:Waters Symmetry C18 (50 mm×2.1 mm,3.5 μm);流动相:乙腈(A)和0.1%甲酸水(B),流速0.25 mL/min;梯度洗脱程序如下:0%~0.5 min 15%~95%A,0.5~3.0 min 95%A,3.0~3.5 min 95%~15%A,3.5~9.0 min 15%A;柱温:35 ℃;进样量:5 μL。采用多反应监测扫描模式;正离子扫描;电喷雾离子源;喷雾电压4.5 kV,雾化气压力55 psi,辅助气流速40 L/min,气帘气压力20 psi,离子源温度650 ℃,碰撞室压力7 psi。监测离子对为565.5→263.1,565.5→285.3,其中565.5→263.1为定量离子对。
1.7 测定方法考察
1.7.1 标准曲线的制备 取沃尼妙林储备液,用50%乙腈水依次稀释得到0.01,0.02,0.05,0.1,0.2,0.5 μg/mL的系列浓度,进行HPLC-MS/MS测定。以药物浓度(C)对峰面积(X)进行线性回归,得到沃尼妙林的标准曲线和相关系数(R)。
1.7.2 准确度与精密度 用pH值7.4 PBS分别配制低、中、高3个浓度(0.1,1.0,10 μg /mL)的沃尼妙林标准溶液,按照1.5方法处理后测定相应的药物浓度。考察方法的日内和日间精密度(CV)和准确度。每个浓度5个重复,共3个批次,不同批次间隔1 d或者数天。
1.8 血浆蛋白结合率测定 用pH值7.4 PBS配制1.0,10,100 μg/mL的沃尼妙林溶液,分别吸取0.5 mL药液,至4.5 mL猪、鸡和兔血浆中,涡旋混匀1 min,37 ℃水浴孵育2 h,取500 μL含药血浆,置于超滤管置中,于8 000 r/min(4 ℃),离心20 min,以10%的三氯乙酸检测无血浆蛋白渗漏后,另取100 μL超滤液,按照1.5方法进行前处理后,进行HPLC-MS/MS分析测定,每种浓度平行5份。
1.9 超滤膜非特异性结合考察 取含沃尼妙林浓度0.1,1.0,10 μg /mL的PBS稀释液,置于超滤管上,于离心机中8 000 r/min离心20 min,取超滤液100 μL进行分析测定,计算超滤膜的回收率均大于95%,表明沃尼妙林与超滤膜无特异性吸附。
2 结果
2.1 测定方法考察 沃尼妙林在本试验建立的色谱与质谱条件下的保留时间为4.82 min (图1),峰形好且灵敏度高,未见超滤液中杂质干扰,具有较好的专属性。该方法检测限为5 ng/mL,定量限为10 ng/mL。将沃尼妙林的峰面积与相应浓度进行线性回归,得到的标准曲线在10 ng/mL至500 ng/mL的范围内线性良好,相关系数在0.999以上。
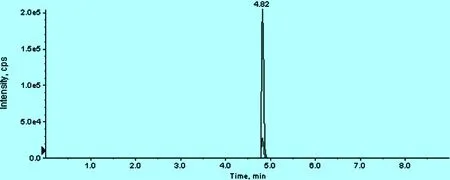
图1 含沃尼妙林的血浆超滤液的总离子流图
2.2 准确度与精密度 通过测定添加水平为0.1、1、10 μg/mL的3个分析批样品的浓度,沃尼妙林的回收率为88.5%~96.2%,批内与批间变异系数分别为4.15%~6.36%和3.11%~8.76%(表1)。在高、中、低3个浓度的添加回收试验,验证了该方法的可靠性。

表1 沃尼妙林的回收率和变异系数(CV)
2.3 沃尼妙林的血浆蛋白结合率 采用高、中、低的药物添加浓度,对沃尼妙林与3种动物血浆的蛋白结合率进行测定,结果表明,沃尼妙林与猪、鸡和兔血浆的蛋白结合率均在80%以上,分别为84.4%±1.07%,87.5%±1.83%和86.6%±1.96%(表2)。此外,试验数据经SPSS软件进行方差分析,结果表明,高、中、低不同浓度的沃尼妙林血浆蛋白结合率之间无显著性差异(P>0.05),蛋白结合呈现非浓度依赖的特性,且药物在测定浓度范围内未发现结合饱和的现象。

表2 沃尼妙林在猪、鸡和兔血浆的蛋白结合率(n=5)
3 讨论
血浆蛋白结合率与药物在体内的分布、代谢和排泄密切相关。药物经吸收进入循环后,只有游离部分的药物,才能随血液转运到各器官和组织,进行生物转化和排泄。因此,测定药物的血浆蛋白结合率对临床上给药方案的调整尤为重要。目前常用的测定药物血浆蛋白结合率的方法包括平衡透析法(equilibrium dialysis)和超滤法(ultrafiltration)[5]。平衡透析法可直接测定处于平衡状态下的游离药物浓度,成本较低,但静置透析达到平衡的时间较长(37 ℃透析平衡通常需要24~48 h),难以批量处理样品[6]。而超滤法是以多孔薄膜作为分离介质,依靠超滤膜两侧压力差使溶剂和小分子的化合物通过薄膜,截留大分子的血浆蛋白,实现血浆中不同分子量物质的快速分离[7]。该方法只需1~2 h即可完成样品的处理,便于快速测定大批量血浆样品中的游离药物浓度。因此,本研究采用超滤法测定的猪、鸡和兔血浆中沃尼妙林的蛋白结合率在84.4%~87.5%之间,其结果与同类药物瑞他妙林94%的血浆蛋白结合率接近[8]。
根据药效学理论,药物与血浆蛋白结合后相当于暂时储存在体内,随着游离型药物的不断代谢和排泄,结合型药物被血浆蛋白缓慢释放,使游离型药物能够保持相对稳定,对药物在体内持续发挥疗效起到了重要的调节作用[9]。通常来说,蛋白结合率高意味着较低的有效药物浓度、缓慢的清除和延长的半衰期。而对于治疗指数低的药物,高血浆蛋白结合的药物在临床使用时具有一定的安全风险,一旦有影响蛋白结合率的因素产生,包括病理因素和药物的不当联合使用,均会使游离型药物迅速增加,从而导致严重的毒副作用产生[10]。与大多数氟喹诺酮类药物20%~30%的血浆蛋白结合率相比[11],沃尼妙林较高的蛋白结合率(80%以上),提示治疗时应根据实际临床疗效,监测有效药物浓度的变化情况,以便于及时调整给药剂量,避免可能的不良反应。
[1] Karlsson M,Gunnarsson A,Franklin A.Susceptibility to pleuromutilins inBrachyspira(serpulina)hyodysenteriae[J].Anim Health Res Rev,2001,2(1):59-65.
[2] Heilmann C,Jensen L,Jensen J S,etal.Treatment of resistantMycoplasmainfection in immunocompromised patients with a new pleuromutilin antibiotic [J].J Infect,2001,43(4):234-238.
[3] Hogenauer G.The mode of action of pleuromutilin derivatives.Location and properties of the pleuromutilin binding site on Escherichia coli ribosomes [J].Eur J Biochem,1975,52(1):93-98.
[4] 梁文权.生物药剂学与药物动力学[M].3版.北京:人民卫生出版社,2007:106.
[5] Wang R,Yuan L G,He L M,etal.Pharmacokinetics and bioavailability of valnemulin in broiler chickens [J].J Vet Pharmacol Ther,2011,34(3):247-251.
[5] 刘睿,谢跃生,潘桂湘,等.药物血浆蛋白结合率测定方法的研究进展[J].天津中医药,2007(6):526-528.
[6] Lin Z J,Musiano D,Abbot A,etal.Invitroplasma protein binding determination of flunarizine using equilibrium dialysis and liquid chromatography-tandem mass spectrometry [J].J Pharm Biomed Anal,2005,37(4):757-762.
[7] Schwarzwald C C,Sams R A.Determination of plasma protein binding of diltiazem in horses by ultrafiltration [J].J Vet Pharmacol Ther,2006,29(6):579-580.
[8] DragBank.http://www.drugbank.ca/drugs/DB01256.
[9] Kunin C M,Craig W A,Kornguth M,etal.Influence of binding on the pharmacologic activity of antibiotics[J].Ann N Y Acad Sci,1973,226:214-224.
[10] Merrikin D J,Briant J,Rolinson G.Effect of protein binding on antibiotic activityinvivo[J].J Antimicrob Chemother,1983,11:233-238.
[11] Bergogne-Berezin E.Clinical role of protein binding of quinolones [J].Clin Pharmacokinet,2002,41:741-750.
Determination and Comparison of Plasma Protein Binding Rates of Valnemulin in Pig,Chicken and Rabbit
ZHOU Wen-jie, ZHOU Yu-feng, LI Xiao, HE Jie-shun, LIU Ya-hong, SUN Jian
(Department of Pharmacology and Toxicology,College of Veterinary Medicine,South China Agricultural University,Guangzhou 510642,China)
The plasma protein binding rates of valnemulin was determined using the ultrafiltration method combined with high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) and compared in various animal species and different drug levels.The results showed that this method was simple,sensitive and selective for the determination of biological sample of valnemulin.The plasma protein binding rates of valnemulin in pig,chicken and rabbit were 84.4 ± 1.07%,87.5 ± 1.83% and 86.6 ± 1.96%,respectively.After spiking with valnemulin concentrations from 0.1 to 10 μg/mL,the protein binding rates showed no significant differences and indicated a character of non-specific concentration independent.
valnemulin; protein binding; ultrafiltration; HPLC-MS/MS
SUN Jian
2016-03-16
长江学者和创新团队发展计划(IRT13063);2015年华南农业大学大学生创新训练计划项目(201510564101)
周文杰(1993-),男,硕士生,研究方向为兽医药理与毒理学,E-mail:zwjscau@126.com
孙坚,E-mail:jiansun@scau.edu.cn
S859.79
A
0529-6005(2016)12-0096-03
