蛋白酶体抑制剂乳胞素对胶质母细胞瘤U87MG的抑制作用
2016-02-06张扬朱晓波赵金川韩志国孙阳高显峰王伟柳敬伟侯坤
张扬朱晓波赵金川韩志国孙阳高显峰王伟柳敬伟侯坤
(吉林大学第一医院神经外科,吉林 长春 130031)
蛋白酶体抑制剂乳胞素对胶质母细胞瘤U87MG的抑制作用
张 扬 朱晓波 赵金川 韩志国孙 阳 高显峰 王 伟 柳敬伟 侯 坤
(吉林大学第一医院神经外科,吉林 长春 130031)
目的 目的 探讨蛋白酶体抑制剂乳胞素对人胶质母细胞瘤U87MG的抑制作用。方法 培养人胶质母细胞瘤U87MGM,分别以5、10、15 μmol/L作用于细胞株。MTT 法检测细胞存活率;bcl-2、Bax及caspase-3 mRNA水平用RT-PCR法检测;Rh123法检测线粒体膜电势;Hoechst 33342检测细胞凋亡情况;U87MG细胞Bax及bcl-2的蛋白表达用Western印迹法检测。结果 与未处理组相比对,U87MG细胞在实验组的存活率下降,bcl-2、Bax mRNA及蛋白表达和线粒体膜电势均下降,caspase-3 mRNA表达水平上升。结论 在体外条件下,乳胞素对胶质母细胞瘤U87MG细胞具有较强的抑制效应。
蛋白酶体抑制剂;乳胞素;胶质母细胞瘤
胶质瘤是中枢神经系统原发性肿瘤中最高发的类型,约占全部颅内肿瘤的30%,颅内恶性肿瘤的80%〔1〕。据报道,台湾胶质母细胞瘤患者的中位生存期是15.1个月〔2〕。最大限度的手术切除是新诊断胶质瘤尤其是胶质母细胞瘤最主要的治疗手段。手术切除可提供组织学诊断、缓解临床症状和减少肿瘤负荷。然而由于胶质母细胞瘤呈浸润性生长且常和重要神经结构邻近,临床实践中很难完全切除。所以胶质瘤的正规治疗方法应包括一期外科切除和后续放疗、化疗等在内的综合治疗方案。有文献提示,手术切除后接受放化疗患者的中位生存期可延长10个月〔2〕。
泛素-蛋白酶体途径是真核生物蛋白降解的重要途径,对正常细胞周期、细胞功能和细胞存活至关重要。泛素-蛋白酶体途径代谢障碍可导致肿瘤进展。因此,抑制蛋白酶体途径的活性是当代恶性肿瘤诊疗的一个新方向〔3〕。乳胞素(LAC)是一种蛋白酶体抑制剂,与蛋白酶体的催化中心结合,进而达到抑制后者活性的作用。实验显示,LAC可诱导大鼠C6和人性胶质细胞瘤(U87MG)细胞凋亡〔4〕。本研究拟进一步明确LAC对人胶质瘤细胞的作用机制及临床意义。
1 材料与方法
1.1 细胞与试剂 上海生工生物工程技术公司提供引物;于TAKARA 公司购买DNA Marker (DL2000)、逆转录酶、PCR高保真TaqDNA聚合酶;溴乙锭、四甲基乙二胺(TEMED)、 Lactacystin 、二甲基亚砜(DMSO)、噻唑蓝(MTT)购于Sigma 公司;Hoechst33342、Rhodamine 123购自北京百奥莱博科技有限公司;在Invitrogen购买Trizol、RT-PCR试剂盒;十二烷基硫酸钠(SDS)、丙烯酰胺(PAGE)、N,N-二甲基双丙烯酰胺、琼脂糖购于上海宝曼生物科技有限公司;新生牛血清、IMEM购于Gibco 公司。
1.2 分组 分为对照组(Con)和实验组。实验组的LAC 浓度分别为5、10、15 μmol/L组。
1.3 MTT 法检测细胞存活率 以2×104/孔将4组细胞均匀接种在96 孔板中,每组细胞9复孔,分别加入5、10、15 μmol/L浓度的LAC后再培养,然后加入5 g/L的MTT 20 μl,4 h后清除孔中培养基,每个孔加入150 μl DMSO,孔板振荡直至完全溶解,用BIO-TEK酶标仪检测每孔的光吸收值。
1.4 采取RT-PCR 法检测bcl-2、Bax和半胱氨酸蛋白酶(caspase-3)mRNA 总RNA用Trizol试剂提取,先将总RNA逆转录成cDNA,然后取1 μl cDNA用于PCR反应。将磷酸甘油脱氢酶(GAPDH)调平后再扩增目的片段。
用10 g/L琼脂糖凝胶电泳和凝胶成像系统(GIS)分析扩增产物电泳条带光密度值,以目的基因和内参磷酸盐缓冲液GAPDH的比值进行量化分析。
1.5 罗丹明(Rh123)检测线粒体膜电势 将细胞铺于24孔板中,5×104/孔,各种浓度LAC处置细胞后8 h,磷酸盐缓冲液(PBS)洗2次,弃去上清,加上1 μg/ml的Rh123,37℃孵育10~30 min,PBS洗2次,在共聚焦显微镜下观察细胞中荧光强度。
1.6 Hoechst 33342检测细胞凋亡 将细胞铺于24孔板中,5×104/孔,各种浓度LAC处置细胞后8 h,PBS洗2次,除上清,加1 μg/ml的Hoechst 33342,37℃孵育20 min,PBS洗2次,显微镜下观察染色质凝集情况及其形态变化。
1.7 Western印迹法检测U87MG细胞中Bax、bcl-2蛋白的表达水平 LAC处理细胞后倒掉培养液,加入胰酶,离心细胞,PBS洗2遍,各瓶加入150 μl细胞蛋白裂解液,细胞粉碎仪超声粉碎细胞3次,放入4℃冰箱(约45 min),离心后上清即为胞质总蛋白,对蛋白进行定量分析,以总蛋白45 μg作SDS-PAGE电泳分离蛋白样本。浓缩胶100 V 30 min,分离胶200 V 60 min,电泳后以转膜仪将蛋白转移至聚偏氟乙烯(PVDF)膜上 100 V 80 min,转膜完毕后5%脱脂处理奶粉封闭2 h,PBST洗4遍,每遍20 min,加入一抗(1∶200),4℃孵育12 h,PBST洗膜3次(15 min/次),加入过氧化物酶标记的二抗(1∶1 000~1∶2 000),水平摇床处理40 min。PBST洗3遍(10 min/遍)。加入二氨基联苯胺(DAB)进行PVDF膜显色后拍照,内参为β-actin。电泳条带中以灰度×面积/参照物的值记录表达的变化。
1.8 统计学方法 应用SPSS16.0软件行单因素方差分析。
2 结 果
2.1 MTT检测U87MG细胞增殖率 与对照组(100%)比较,LAC 5 μmol/L组〔(70.02± 2.3)%〕、LAC 10 μmol/L组〔(65.09±3.5)%〕及LAC 15 μmol/L组〔(55.1± 2.1)%〕中U87MG细胞的增殖率明显降低(P<0.05)。
2.2 RT-PCR检测bcl-2/Bax、caspase-3 mRNA表达水平 与对照组比较,LAC 5、10及15 μmol/L组bcl-2/Bax的表达均显著降低,caspase-3显著升高(P<0.05),提示线粒体凋亡途径可能参与了此过程。见图1,图2。
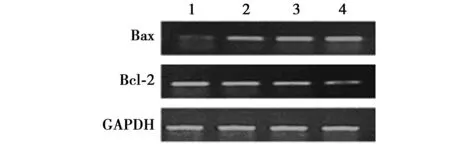
1 Con;2.LAC 5 μmol/L;3.LAC 10 μmol/L;4.LAC 15 μmol/L图1 各组细胞bcl-2/Bax水平比较

1 Con;2.LAC 5 μmol/L;3.LAC 10 μmol/L;4.LAC 15 μmol/L图2 各组细胞caspase-3水平比较
2.3 Rh123检测线粒体膜电势 与对照组比较,LAC 5、10、15 μmol/L组U87MG细胞内红色荧光强度明显减弱,提示线粒体膜电势明显减低及细胞凋亡的存在。见图3。
2.4 Hoechst 33342检测细胞凋亡 与对照组比较,LAC 5、10、15 μmol/L组U87MG细胞形态发生明显改变。细胞核皱缩及核分裂普遍存在提示凋亡的发生。见图4。
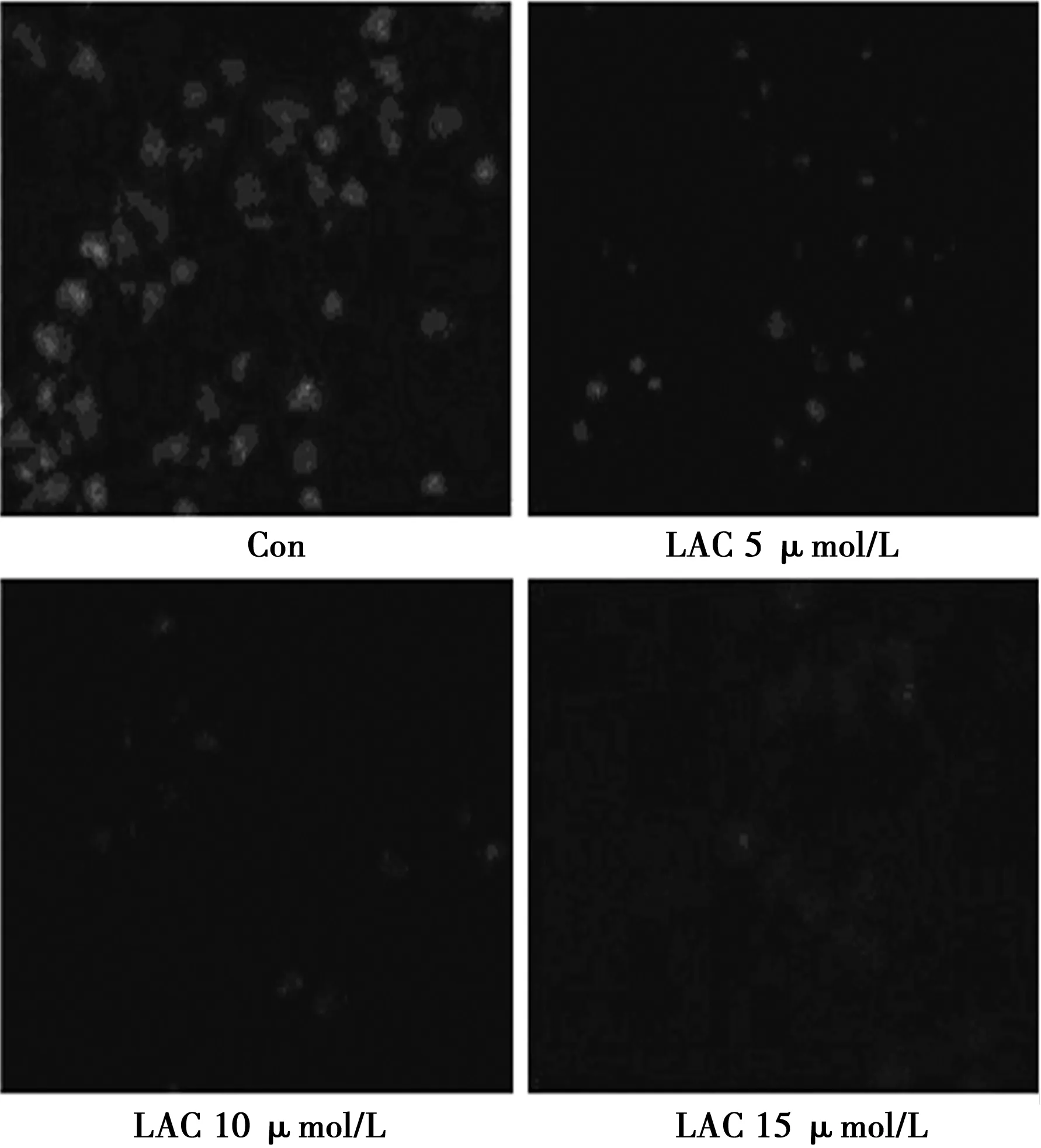
图3 各组细胞线粒体膜电势比较
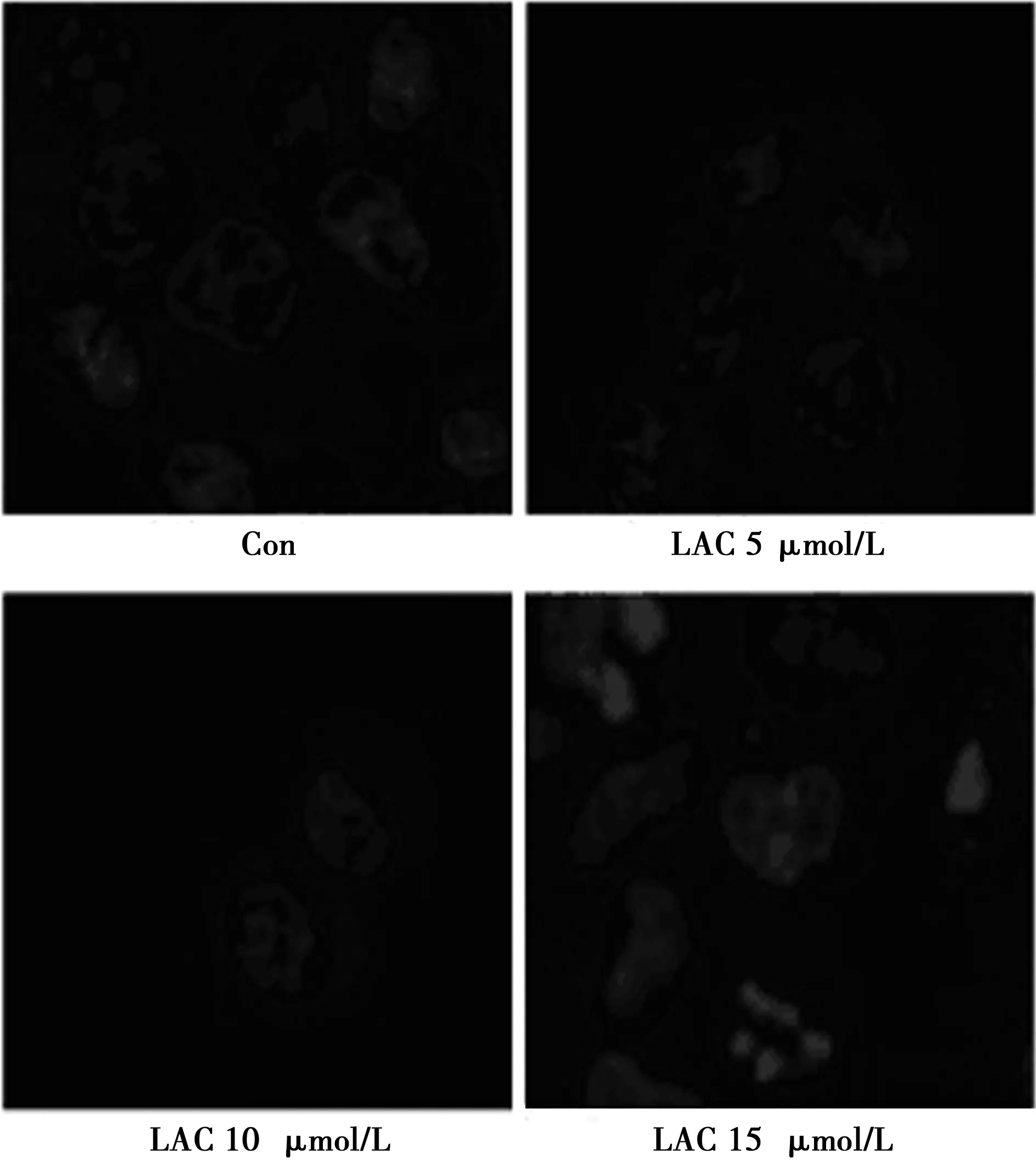
图4 各组细胞核形态比较
2.5 Western印迹电泳检测bcl-2/Bax蛋白表达水平 与对照组比较,LAC 5、10、15 μmol/L组bcl-2/Bax水平显著降低(P<0.05),说明可能有线粒体凋亡的发生。见图5。
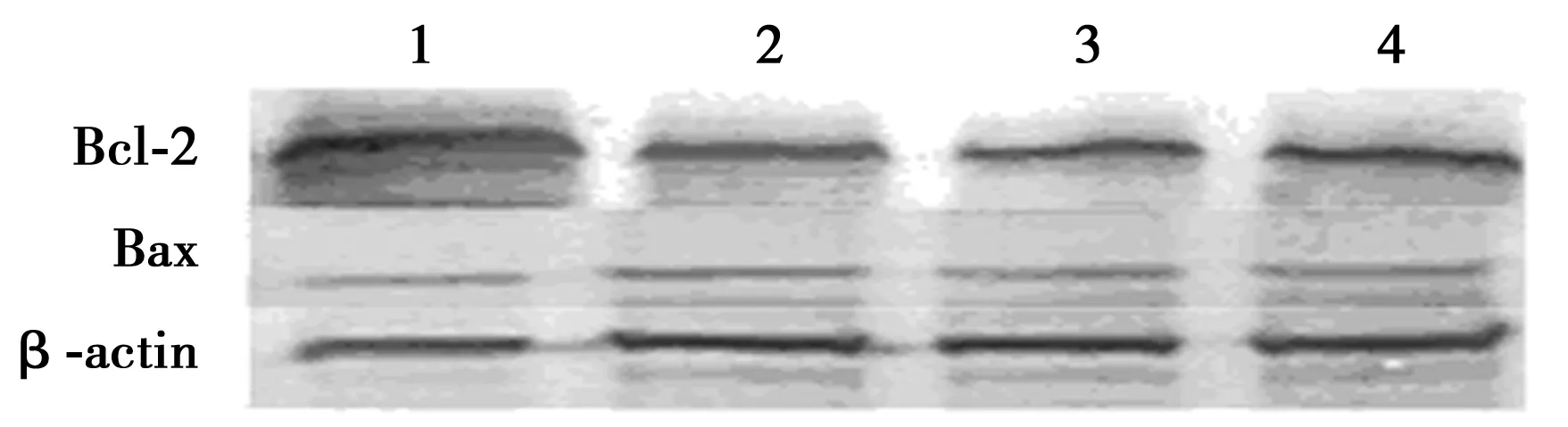
1.Con;2.LAC 5 μmol/L;3.LAC 10 μmol/L;4.LAC 15 μmol/L图5 各组细胞bcl-2/Bax水平比较
3 讨 论
泛素蛋白酶体途径对细胞蛋白质的有序降解对于信号转导、转录调节、应激反应和受体功能调控至关重要。此途径控制核因子κB的激活。蛋白酶体在抗原提呈方面也扮演重要角色。罹患癌症时,这一代谢途径的失调将导致肿瘤进展、耐药和肿瘤监控失效。因此,抑制蛋白酶体系统可导致多种调节蛋白失衡,细胞周期停滞和凋亡〔3〕。
蛋白酶体途径可降解某些转录因子、调控蛋白、肿瘤抑制蛋白以及原癌基因。抑制蛋白酶体可引起细胞凋亡。许多研究证实,蛋白酶体抑制剂对恶性、增殖活跃的细胞的作用要比正常细胞敏感。目前已有数种蛋白酶体抑制剂用于肿瘤的基础研究。如Imajoh-Ohmi等〔5〕证实,作为蛋白酶体β亚基的一种不可逆性抑制剂,LAC可诱导人U937细胞凋亡。
LAC是从链霉菌中分离的,具有抑制鼠科动物神经母细胞瘤细胞增殖和诱导轴突分支的作用〔6〕。LAC的抗肿瘤作用主要通过蛋白酶体起作用,而后者广泛分布于内质网和真核生物细胞核内。蛋白酶体识别并分解已被泛素标记的蛋白。LAC抑制泛素蛋白酶体主要通过细胞色素C依赖性和非依赖性途径。LAC与26S蛋白酶体的20S核心特异性结合,抑制细胞内肽链的降解。LAC对肿瘤细胞具有选择性蛋白酶体抑制作用。当与化疗药物联合应用时,它拥有叠加效应,能提高恶性细胞对放、化疗的敏感性〔7〕。有实验显示,LAC促进c-Myc蛋白稳定化和向胞内集聚,增加Fas-ligand(FasL)的表达,并通过激活caspase-3触发细胞凋亡〔8〕。蛋白酶体抑制剂理论上可影响正常组织,而LAC中肿瘤细胞具有特异性抑制作用。胶质母细胞瘤具有生长迅速、侵袭性和高度的血管生成作用,因此其蛋白代谢较快且对蛋白酶体系统具有高度依赖性。以上特点使得蛋白酶体抑制剂成为一个理想的治疗选择。
综上所述,LAC在体外条件下对胶质母细胞瘤U87MG细胞具有较强的抑制作用。然而离临床应用还有很大一段距离。进一步的动物和人的在体实验可对其安全性和临床应用前景进行评估。
1 de Robles P,Fiest KM,Frolkis AD,etal.The worldwide incidence and prevalence of primary brain tumors:a systematic review and meta-analysis〔J〕.Neuro Oncol,2015;17(6):776-83.
2 Chien LN,Ostrom QT,Gittleman H,etal.International differences in treatment and clinical outcomes for high grade glioma〔J〕.PLoS One,2015;10(6):e0129602.
3 Rajkumar SV,Richardson PG,Hideshima T,etal.Proteasome inhibition as a novel therapeutic target in human cancer〔J〕.J Clin Oncol,2005;23(3):630-9.
4 牟 荣,闫 明,刘 威,等.蛋白酶体抑制剂对胶质瘤 U251 细胞增殖的抑制作用〔J〕.中国实验诊断学,2011;15(2):306.
5 Imajoh-Ohmi S,Kawaguchi T,Sugiyama S,etal.Lactacystin,a specific inhibitor of the proteasome,induces apoptosis in human monoblast U937 cells〔J〕.Biochem Biophys Res Commun,1995;217(3):1070-7.
6 Fenteany G,Standaert RF,Lane WS,etal.Inhibition of proteasome activities and subunit-specific amino-terminal threonine modification by lactacystin〔J〕.Science,1995;268(5211):726-31.
7 Legnani FG,Pradilla G,Thai QA,etal.Lactacystin exhibits potent anti-tumor activity in an animal model of malignant glioma when administered via controlled-release polymers〔J〕.J Neurooncol,2006;77(3):225-32.
8 Tani E,Kitagawa H,Ikemoto H,etal.Proteasome inhibitors induce Fas-mediated apoptosis by c-Myc accumulation and subsequent induction of FasL message in human glioma cells〔J〕.FEBS Lett,2001;504(1-2):53-8.
〔2015-12-17修回〕
(编辑 袁左鸣)
吉林大学第一医院二部科研专项基金资助(No.B11)
侯 坤(1986-),男,主治医师,主要从事神经系统疾病的外科治疗研究。
张 扬(1978-),男,主治医师,主要从事颅内肿瘤和脑血管疾病的研究。
R651.1+9
A
1005-9202(2016)24-6087-03;
10.3969/j.issn.1005-9202.2016.24.019
