人脑胶质瘤GDNF基因启动子Ⅰ区H3组蛋白乙酰化修饰情况研究
2016-01-27戴燕燕陈茂华
戴燕燕 陈茂华
[摘要] 目的 分析GDNF基因启动子在人体胶质瘤Ⅰ区区间的H3组蛋白乙酰化(acetylization)修饰情况以及人体胶质瘤的GDNF基因启动子表达方式。 方法 选取正常脑组织20例,实施反转录(RT-PCR)的检测方法来检测GDNF基因启动子的相关表达方式,在实时定量荧光PCR(Real-time PCR)的基础上建立好染色质免疫沉淀(CHIP)。 选取人体胶质瘤20例,实施反转录的检测方法来检测GDNF基因启动子的相关表达方式,在此基础上建立好CHIP方法分析GDNF基因启动子在Ⅰ区区间的H3组蛋白乙酰化的相关修饰情况。 结果 实时定量荧光PCR方法在检查人体胶质瘤GDNF基因启动子方式的表达方面,随着RT-PCR的检测水平级别升高而升高,转录水平中的正常组以及高低级别组之间差异有统计学意义(P<0.05)。 结论 GDNF基因启动子在人体胶质瘤Ⅰ区区间的H3组蛋白乙酰化修饰情况很有可能会影响到GDNF基因的相关表达方式。
[关键词] 人体胶质瘤;GDNF;基因启动子;蛋白乙酰化;修饰情况
[中图分类号] R739.4 [文献标识码] A [文章编号] 1673-9701(2015)35-0001-04
[Abstract] Objective To analyze the H3 protein histone acetylation modification conditions in I region of human gliomas GDNF gene promoter and to explore the expression of human glioma GDNF gene promoter. Methods A total of 20 cases of patients with normal brain tissue were chosen, and the detection method of reverse transcription (RT-PCR) was used to detect the associated expression method of GDNF gene promoter. On the basis of real-time quantitative fluorescent PCR (Real-time PCR), Chromatin immunoprecipitation (CHIP) was established. 20 cases of patients with human glioma were chosen, and reverse transcription method was implemented to detect the relevant expression of GDNF gene promoter. On this basis, CHIP method was established to analyze the H3 protein histone acetylation modification conditions in I region of human gliomas GDNF gene promoter. Results By real-time quantitative fluorescent PCR method in checking human glioma GDNF gene expression, with the elevated detected levels of RT-PCR, the expression amount increased. There were statistically significant differences in comparing the normal-level transcription group, the low-level transcription group and the high-level transcription group (P<0.05). Conclusion H3 protein histone acetylation modification conditions in I region of human gliomas GDNF gene promoter is likely to affect the related expression of GDNF-related genes.
[Key words] Human glioma; GDNF; Gene promoter; Histone acetylation; Modification conditions
人体胶质瘤是人体颅脑内比较常见的肿瘤,胶质瘤的死亡率较高,仅次于肺癌。根据相关资料显示,患胶质瘤以后在3年的时间内患者的死亡率达95.8%[1-3]。另外,胶质瘤的发生与发展是一个非常复杂的过程,为了找出更理想的治疗路径,本文主要结合表观遗传学来分析其具体的治疗方法。胶质瘤的相关病因在目前尚不清楚,但是随着细胞学、分子生物研究学以及遗传学等学科的发展,目前的相关研究资料表明,胶质瘤的发生是一个繁琐而又复杂的过程,其中主要包括一些进行性的改变,从而导致细胞失控性增长。笔者将结合相关实际情况,分析GDNF基因启动子在人体胶质瘤(Human glioma)Ⅰ区区间的H3组蛋白乙酰化(acetylization)修饰情况以及人体胶质瘤的GDNF基因启动子表达方式,现总结报道如下。
1 材料与方法
1.1 主要仪器
美国PE公司的扩增仪(型号为Optima 8000),德国EKSHGN公司的核酸蛋白检测仪(型号为ClearFirst-5000Process型),北京仪器厂的转移电泳仪(型号为EPS-200)。
1.2 主要试剂
提取染色质,聚合酶链反应试剂(深圳生物科技有限公司),PCR试剂盒,凝胶电泳试剂(上海生物科技有限公司),细胞培养,传代试剂(北京生物科技有限公司)。
1.3 组织来源
采取苏州大学医学伦理委员会审批的40例标本,选取正常脑组织20例(正常对照组,其中低水平10例,高水平10例),20例人体胶质瘤组织,低水平10例,高水平10例,按照相关实验结果进行科学分析。
1.4 试验方法
采用定时定量荧光水平检测方法检测人体胶质瘤GDNF基因启动子,提取反转录以及RNA,按照相关实验的说明书进行如下操作:先将0.5 μg/μL primer加入Real-time PCR试管中混匀,放入60℃孵育箱,保持10 min,10 min之后迅速降温处理,之后再加入20 U/μL的FHVHJKHIHGVIOGHUIHYGU,在上述的一系列工作之后立即使用 PCR检测。
制备标准线,针对GDNF基因启动子,合成PCR引物,以293细胞为主要模板,在此基础上使用GDNF基因启动子以及HGVKSJHO基因引物进行扩增。收回扩增产物,在接连回收之后构建好TA载体,转化DH细胞组织。选取菌落鉴定克隆基因形态,培养质粒次序并送去检测顺序,用计算机拷贝基因数。另外,将质粒数按照10倍稀释的拷贝数来进行稀释,稀释链为1×101 COPIES/μL,1×103 COPIES/μL,1×107 COPIES/μL,1×105 COPIES/μL,1×106 COPIES/μL。将稀释之后的样品作为定时定量荧光水平检测方法,再得到CT数值,制作好标准曲线。
1.5 染色质免疫共沉淀检测方法(CHIP-PCR)
根据染色质免疫共沉淀试剂盒的说明书来进行简单介绍,使用交联方法,采用1%左右的甲醛溶液细胞固定液,在常温下孵育5 min,在最终浓度为125 mM时,停止交联反应。去除含蛋白酶的抑制剂,分解细胞组织。用预冷的洗涤剂洗涤2次或者2次以上,每次均为10 mL左右。
采用超声破碎DNA,将EP管注入到超声破碎池中,保持10 min左右,保留上清。染色质免疫共沉淀检测方法(CHIP-PCR):将样品分为2份,每一份样品取20 μL存放于零下1℃的冷藏室内,做好相关标记后往实验室的管中加入GWPOHGHN HIOISH 500 μL中。另外,转移上清液放入到新的EP管中,每次均为250 μL,将记录好的IP对应细胞组织中,与此同时去掉元磁珠。采用JHGHOLGH SEPARATIONG RACK放置于零下1℃的冷藏室内。除掉上清中的染色质,如果有相关需要保存好持续分析。
PCR验证染色质免疫共沉淀检测方法(CHIP-PCR),按照相关试剂盒说明书来验证PCR,将DNA样品配置到定时定量荧光水平检测方法(Real-time PCR)的相关方法中。简而言之,就是把样品加入之后进行测量PCR的方法。需满足以下3个方面的热循环条件:其一,10 min 95℃预变性;其二,60 s 95℃变性;其三,30 s 72℃延伸性。
1.6 观察指标
观察蛋白乙酰化发生在N一端碱性氨基酸集中区的特定赖氨酸残基,转移到赖氨酸的sNH3+中和掉1个正电荷。
1.7 统计学分析
采用SPSS13.0 统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,多个样本均数的比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 人体胶质瘤组织中GDNF基因启动子转录水平与正常脑组织比较
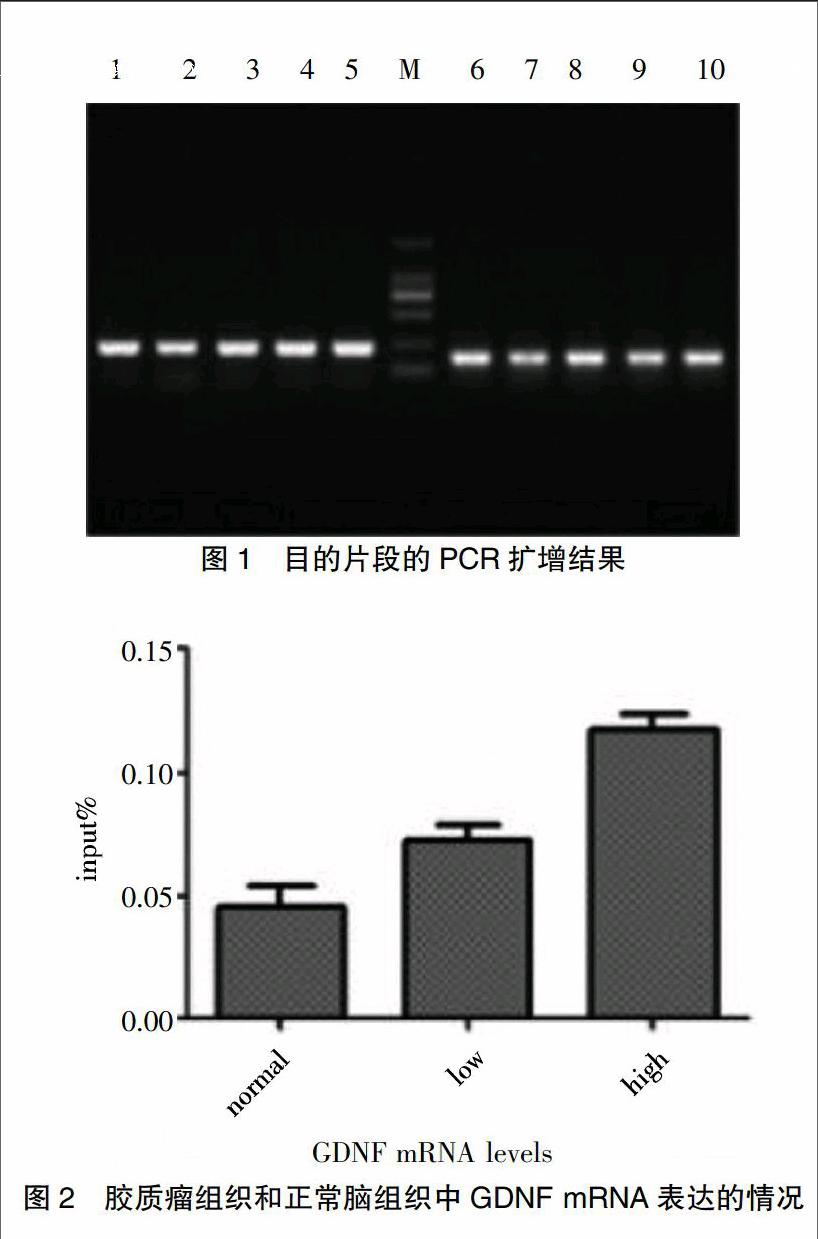
GEHIGH结果显示,正常脑组织以及人体胶质瘤低高级别组中的表达量随着级别的升高而显著提高;实时定量荧光PCR方法在检查人体胶质瘤GDNF基因启动子方式的表达方面,随着RT-PCR的检测水平级别升高而升高,转录水平中的正常对照组以及高低级别组之间差异比较大,差异有统计学意义(P<0.05)。在胶质细胞源性神经营养因子(GDNF mRNA)的表达方面,正常组以及高低级别组之间差异具有统计学意义(P<0.05)。见表1、图1、2。
2.2 GDNF基因启动子H3组蛋白乙酰化情况
CHIP实验不仅能够检测蛋白以及相关的蛋白修饰,还能检测到与DNA相互结合的蛋白。举例来说,蛋白乙酰化以及蛋白磷酸化的上述特质都以特异性抗体来进行相关实验,通过交联方式来使DNA蛋白以及蛋白-蛋白之间的作用固定在活性状态中。在超声治疗的基础上把基因破摔成片段,片段大约在100~1200 BP大小,以此加入到抗体的沉淀中去,在此时,沉淀物的抗体有着特异的作用,将蛋白与蛋白-DNA之间的相互作用进行合理的研究与联系,最终将以DNA的模板进行Real-time PCR分析方法,最终判断为人体胶质瘤GDNF基因启动因子在人体胶质瘤(Human glioma)Ⅰ区区间的H3组蛋白乙酰化(acetylization)修饰情况,具体分析H3组赖氨酸残基(Lysine residues)9位乙酰化的具体情况,见图3。
3讨论
胶质细胞源性神经营养因子(GDNF mRNA)是一种转化生长因子的大家族,在发生人体胶质瘤的过程中有着重要的地位和作用。本文的相关实验结果表明,GDNF基因启动子在人体胶质瘤的组织表达中有着明显升高的趋势,这与张阳等[3]学者在慢病毒介导新型Tet-On系统调控大鼠GDNF和TH双基因表达对帕金森病大鼠的实验研究一文中的相关研究报道结果是保持高度一致的[4-6]。因此,对GDNF基因启动因子的相关研究是能够有效发现人体胶质瘤的重要指标之一。因此,本文的主要研究目的是综合分析并明确确定GDNF基因启动子在人体胶质瘤(human glioma)Ⅰ区区间的H3组蛋白乙酰化(acetylization)修饰情况,具体分析H3组赖氨酸残基(lysine residues)9位乙酰化的具体情况,从中研究出人体胶质瘤(human glioma)的GDNF基因启动子表达方式以及相关影响。
在本次的相关实验中,对CHIP(染色质免疫共沉淀)方法对正常脑组织组以及高、低级别胶质瘤内的GDNF基因启动子Ⅰ区区间的H3组蛋白乙酰化(acetylization)修饰情况进行适度的检测。表观遗传学(epigenetics)的相关研究是在核苷酸没有发生任何改变的基础上进行一系列的研究分析,表观遗传学在发生可遗憾的变化时能够系统地分析出遗传学的相关分支,其主要分支包括以下几个方面的内容:其一,基因甲基化;其二,蛋白质乙酰化;其三,蛋白质磷酸化;其四,蛋白质糖基化;其五,蛋白质泛素化。在真核细胞的相关研究中有82.5%~92.5%的蛋白质存在着乙酰化的情况(这其中包括组蛋白以及非组蛋白)。采用比较高分辨率的研究质谱可以有效检测到蛋白上的对乙酰化点。在检查乙酰化点之外,还可以检测到DNA复制以及损伤的情况(主要以蛋白质为主)。另外,与转录因子相关的调节部分以及转录部分其代谢的酶以及蛋白等都存在乙酰化酶。从上述情况来看,乙酰化在蛋白质以及细胞组织的基本生理过程中有着非常重要的作用,与欧雅莉等[7]学者在静脉移植转染GDNF基因的人脐血CD34+细胞改善局灶性脑缺血大鼠的神经功能一文中的相关研究结果是保持高度一致的。
本文的相关研究结果显示实时定量荧光PCR方法在检查人体胶质瘤GDNF基因启动子方式的表达方面,随着RT-PCR的检测水平级别升高而升高,转录水平中的正常组以及高低水平组之间差异较大,具有统计学意义(P<0.05)。在胶质细胞源性神经营养因子(GDNF mRNA)的表达方面,正常组以及高低水平组之间差异较大,具有统计学意义(P<0.05)。由此我们可以得知GDNF的作用与营养细胞的相关组织细胞有着密切的关系,能够有效提高GDNF的表达方式[8-10]。
人体胶质瘤的发生机制目前尚不完全清楚,然而随着遗传学以及生物学科等相关研究在不断的进步,使人体胶质瘤的发生机制能够更加清晰。目前的相关研究表明,人体胶质瘤中也包括了细胞失控性增殖,胶质细胞源性神经营养因子(GDNF mRNA)被认为是人体正常细胞组织中的重要介质。经过陈睿等学者在IRES序列连接的人GDNF基因和EGFP基因逆转录病毒真核表达载体的构建及鉴定一文中的相关研究结果显示,GDNF具有促使细胞分化的相关作用,以其形式体被有机合成[11-13]。对于人类而言,很多营养神经因子参与了胶质瘤的相关生物学作用。在GDNF的相关形成因子中,GDNF的基因位于第五号染色体Ⅰ区(p12~p13),能够提高1个启动因子和4个外显子。启动子Ⅱ中活性高于Ⅰ区,从而促进转录的作用;另外,在人体胶质瘤的相关细胞组织中,GDNF的表达方式上升得比较明显,GDNF的作用与营养细胞的相关组织细胞有着密切的关系[14-20]。
综上所述,GDNF基因启动子在人体胶质瘤(human glioma)Ⅰ区区间的H3组蛋白乙酰化(acetylization)修饰情况很有可能会影响到GDNF基因的相关表达方式。
[参考文献]
[1] 高小青,周玲,杜杰,等. GDNF基因修饰的BMSCs对大鼠缺氧复氧神经细胞凋亡的实验研究[J]. 重庆医学,2010,39(13):1634-1636,封3.
[2] 李周儒,刘捷,雷宇,等. 组蛋白高乙酰化介导的Egr-1结合促进gdnf基因高转录[J]. 南方医科大学学报,2015, 35(5):697-701.
[3] 张阳,张志坚,俞晓岚,等. 慢病毒介导新型Tet-On系统调控大鼠GDNF和TH双基因表达对帕金森病大鼠的实验研究[J]. 中国药理学通报,2015,12(2):251-255, 256.
[4] 尚修超,顾加祥,张乃臣,等. GDNF 基因诱导大鼠骨髓间充质干细胞促周围神经再生的实验研究[J]. 中国实验诊断学,2014,18(5):722-726.
[5] 倪海波,张宝乐,任庆先,等. 大鼠C6胶质瘤细胞中gdnf基因启动子Ⅰ区组蛋白高乙酰化可能参与了其高转录调控过程[J]. 现代生物医学进展,2014,14(11):2015-2018.
[6] 顾加祥,尚修超,刘宏君,等. GDNF基因诱导骨髓间充质干细胞向神经细胞分化的实验研究[J]. 中国实验诊断学,2014,18(3):3514-3517.
[7] 欧雅莉,余国龙. 静脉移植转染GDNF基因的人脐血CD34+细胞改善局灶性脑缺血大鼠的神经功能[J]. 中华器官移植杂志,2010,31(3):1612-1616.
[8] 杜文彦,王景宏,刘钦毅,等. 胶质细胞源性神经营养因子基因转染雪旺氏细胞的实验研究[J]. 中国实验诊断学,2010,14(1):20-22.
[9] 徐强,许百男,刘柯,等. 外源性SDF-1α和GDNF基因在恒河猴骨髓基质细胞内的稳定表达[J]. 中华神经医学杂志,2010,19(1):43-46.
[10] 马雪红,高成阁,王宝安,等. GDNF基因多态性与精神分裂症临床特征的相关性[J]. 西安交通大学学报(医学版),2011,32(3):307-310.
[11] 王建村,任庆先,高殿帅,等. 胶质瘤中GDNF基因启动子Ⅱ区甲基化修饰发生变化[J]. 中国现代医学杂志,2012,22(30):21-25.
[12] 任振华,王佳茵,王淑艳,等. 慢病毒介导GDNF基因对食蟹猴骨髓间充质干细胞生物学特性的影响[J]. 基础医学与临床,2012,32(5):5313-5318.
[13] 陈睿,孙志军,孟宪国,等. IRES序列连接的人GDNF基因和EGFP基因逆转录病毒真核表达载体的构建及鉴定[J]. 中国现代医学杂志,2010,20(21):3217-3220, 3225.
[14] 冯淑曼,杨红旗,李有明,等. Nestin及Musashi-1蛋白在人脑胶质瘤组织中的表达及其临床意义[J]. 中华实验外科杂志,2011,28(7):1155-1156.
[15] 黄辉,蒋宏玲,刘芬菊,等. 60Co γ射线照射联合三氧化二砷对人脑胶质瘤SHG44细胞DNA损伤的研究[J].现代中西医结合杂志,2012,21(12):1274-1276.
[16] 杨斌,刘献志,李进军,等. ANXA2和EGFR在人脑胶质瘤中的表达及临床意义[J]. 第三军医大学学报,2012, 34(3):274-276.
[17] 王睿君,王育民,刘雁飞,等. Neuropilins-1和Neuropilins-2在人脑胶质瘤中的表达[J]. 中国老年学杂志,2014, 34(7):1790-1791.
[18] 苏星,施炜,黄剑飞,等. PAI-1在人脑胶质瘤中的表达及意义分析[J]. 昆明医学院学报,2011,32(2):57-61.
[19] 崔勇,王洪,方川,等. 人脑胶质瘤组织中EGFR、MMP-9、Ki-67的表达与肿瘤病理分级的关系[J]. 山东医药,2010,50(38):77-78.
[20] 魏德,魏成斌,黄绍松,等. 联合检测诱骗受体-3和白细胞介素-17在人脑胶质瘤的表达及意义[J]. 中华实验外科杂志,2015,32(2):403-405.
(收稿日期:2015-10-10)