视网膜色素上皮细胞吞噬功能与MERTK-Ras-肌球蛋白通路关系的研究
2016-01-22孙昱昭张若霜
孙昱昭,张若霜,谷 峰
·实验论著·
视网膜色素上皮细胞吞噬功能与MERTK-Ras-肌球蛋白通路关系的研究
孙昱昭,张若霜,谷峰
Study on relation between the phagocytic fuction of retinal pigment epithelial cells and MERTK-Ras-myosin signal pathway
Citation:Sun YZ, Zhang RS, Gu F. Study on relation between the phagocytic fuction of retinal pigment epithelial cells and MERTK-Ras-myosin signal pathway.GuojiYankeZazhi(IntEyeSci) 2016;16(1):28-33
摘要
目的:研究视网膜色素上皮(retinal pigment epithelium,RPE)细胞吞噬功能与MERTK受体及其下游信号通路Ras-MEK-MLCK-肌球蛋白的关系。
方法:用视细胞外节膜盘(rod outer segments,ROS)于37℃孵育离体培养的3~5代C57小鼠RPE细胞,在孵育0、30、60、120、180、240min终止吞噬反应。双重荧光标记法检测RPE细胞吞噬动力学;以MERTK及Ras抗体、磷酸化MEK及MLCK抗体应用Western-Blot方法检测不同孵育时间(30、60、120、180min)MERTK、Ras、MEK及MLCK的激活状态;以瞬时转染质粒方法抑制Ras及MERTK基因表达后,再次以Western-Blot方法检测对应时间MERTK-Ras通路激活状态及吞噬功能的变化。
结果:C57小鼠RPE细胞吞入ROS发生在孵育30min,并在3h达到饱和。在吞噬过程中,随着孵育时间的延长,RPE细胞MERTK、Ras、MEK和MLCK的蛋白表达水平不断增多(与对照组相比,P<0.05)。Ras及MERTK干扰后的RPE细胞与ROS共孵育(30、60、120、180min)的全过程中,MERTK、Ras、MEK和MLCK的蛋白表达及ROS的吞入数量始终维持较低水平,仅在孵育180min见到少量ROS吞入;与未转染RPE细胞相比,siRas-RPE细胞及siMERTK-RPE细胞与ROS共孵育120、180min时,MERTK、Ras、MEK及MLCK的蛋白表达量均明显减少(P<0.05)。
结论:Ras-MEK-MLCK-肌球蛋白通路是鼠RPE细胞吞噬过程中MERTK受体激活的下游信号通路。
关键词:视网膜色素上皮;吞噬;MERTK;Ras;肌球蛋白
引用:孙昱昭,张若霜,谷峰.视网膜色素上皮细胞吞噬功能与MERTK-Ras-肌球蛋白通路关系的研究.国际眼科杂志2016;16(1):28-33
0引言
研究表明视网膜色素上皮(retinal pigment epithelium,RPE)细胞吞噬功能障碍是视网膜色素变性的病因,但目前对RPE细胞吞噬功能的确切机制尚不清楚。以往对RPE细胞吞噬功能的研究表明,RPE细胞对视细胞外节膜盘(rod outer segments,ROS)的吞噬是受体介导的特异性吞噬过程,分为结合、摄入及消化三个不同的时相[1];而MERTK被认为是启动RPE细胞吞噬ROS过程的受体分子[2],并可与RPE细胞表面唯一的整合素受体分子αvβ5通过磷酸化黏着斑激酶(focal adhesion kinase,FAK)发生“crosstalk”促进吞噬[3]。但是,RPE细胞吞噬过程中MERTK所启动的确切下游信号目前仍不清楚。已知MERTK介导的巨噬细胞对凋亡细胞的吞噬激活了蛋白激酶C(PKCβⅡ),并通过调节肌动蛋白(actin)的分布形成吞噬杯来吞噬凋亡的细胞[4];然而RPE细胞吞噬ROS的过程中MERTK并不直接作用于actin,而是通过靶向作用于非肌性肌球蛋白myosinⅡ来形成吞噬杯以完成对ROS的吞入过程的[5]。但是MERTK通过哪种信号通路来靶向作用于肌球蛋白myosin,目前尚未见明确报道。
MERTK受体是一种受体酪氨酸激酶[6],具有受体和激酶的双重功能,参与细胞内信号转导。与MERTK相关的信号通路比较复杂,目前已知的Ras-MAPK途径是生长因子、细胞因子及整合素等所共有的信号通路[7]。有研究表明,尿激酶-血纤维蛋白溶酶原激活物(U-PA)可以通过选择性地整合素受体分子αvβ5,经由Ras-MEK(extracellular signal regulated kinase kinase,胞外信号调节激酶的激酶)-ERK(extracellular signal regulated kinase,胞外信号调节激酶)-MLCK(myosin light chain kinase,肌球蛋白轻链激酶)通路激活myosin来刺激细胞的迁移[8]。也有研究表明,抗高血压药物卡托普利也通过Ras-MEK-MLCK通路作用于肠系膜动脉的myosin来降低血压[9],这提示我们,RPE细胞吞噬过程中MERTK受体后通路可能涉及Ras-MEK-MLCK-myosin途径。为此,本研究拟探讨RPE细胞是否通过MERTK受体介导的Ras-MEK-MLCK信号通路来发挥吞噬ROS的功能,为RPE细胞吞噬功能的调控及临床治疗视网膜色素变性提供新的思路。
1材料和方法
1.1材料
1.1.1实验动物C57BL/6小鼠,7~10周龄,体质量20~22g,购自中国医科大学实验动物部。小鼠饲养环境:清洁级小动物实验房(恒温:25℃;湿度:40%~50%;光照:8 h/d)。
1.1.2试剂DMEM(Dulbecco’s Modified Eagle’s Medium)培养液及Hanks液(美国Gibco公司),胰蛋白酶(美国Difco公司),胎牛血清(FCS,天津TBD公司),Fluro-3/AM(美国Sigma公司),fluorescein isothiocyanate(异硫氰酸荧光素,FITC)及sulforhodamine(硫酰罗达明,SR,美国Invitrogen-Molecular Probe公司),蔗糖及Tris(氨丁三醇)(中国联星公司),SYBR Green Real-Time PCR KIT(TaKaRa公司),RIPA裂解液及BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),MERTK抗体(德国Acris antibodies公司),Ras、MEK、MLCK抗体(Cell signal technology),限制性内切酶(加拿大Fermetas公司),高纯质粒制备试剂 (北京百泰克生物技术有限公司),Lipo2000(美国Invitrogen公司)。Olympus-IX71倒置显微镜(日本Olympus公司)及Diagnostic instruments-spot insigh荧光数字图象采集摄像系统(美国DI公司)。Exicycler 96荧光定量PCR仪(韩国BIONEER)。凝胶成像分析仪(北京六一WD-9413B)。双垂直蛋白电泳仪(北京六一DYCZ-24DN)。
1.2方法
1.2.1 RPE细胞培养采用胰蛋白酶消化法[2],每次取4只C57BL/6鼠,麻醉后剜除眼球,剪除角膜、去除晶状体后将眼杯置于0.2%胰酶中消化50min,吹打、离心收集后以含有20%小牛血清、1%青链霉素及1%非必需氨基酸、1% L-谷氨酸的DMEM培养液中培养,融合后传代。第3~5代细胞用于实验。采用Cytokeratin-8进行RPE细胞鉴定,Cytokeratin-8免疫染色阳性细胞为RPE细胞。
1.2.2 ROS提取及染色根据Papermaster等[10]的方法并有所改动提取ROS,简言之:将人视网膜神经层悬于340g/L蔗糖匀浆液中,剧烈摇动1min后,以4 000r/min离心4min,收集上清,并加入二倍于其体积的10mmol/L Tris-HCl缓冲液,然后以4 000r/min离心4min,收集沉淀,加入不连续密度梯度液的顶层,27 000r/min离心30min。将提取的ROS中加入终浓度为10mg/L FITC液,室温下,于暗处孵育1h以标记ROS。
1.2.3吞噬检测采用双重荧光标记法进行吞噬动力学检测及计数[11],吞噬动力学检测的时间点设定为0、30、60、120、180、240min。用于吞噬动力学检测的RPE细胞种植在35mm培养皿上。
1.2.4吞噬过程中MERTK-Ras-MEK-MLCK-myosin通路激活状态测定采用Western-Blot方法:将RPE细胞与ROS孵育不同时间后[0min(即为对照组)、30、60、120、180min],吸出ROS孵育液,并用4℃ Hanks液冲洗细胞2次,终止吞噬反应,然后加入100μL RIPA裂解液裂解细胞、离心获得抽提蛋白。用BCA测定试剂盒测定上清蛋白浓度后,-80℃保存备用。各时间点蛋白样品量为60μg。制备5%浓缩胶及浓度为8%、10%、13%的分离胶。加入上样液20μL及5μL蛋白Marker,电压80V,恒压电泳2.5h。以电压70V转印1.5h将凝胶转印至PVDF膜上。将转好的PVDF膜放入5% TBS+脱脂奶粉的封闭液中室温封闭1h。分别加入稀释的MERTK抗体(1∶250)、Ras抗体及磷酸化MEK、MLCK抗体(1∶500)4℃孵育过夜,洗脱后加入1∶5000稀释的二抗37℃孵育45min,再次洗脱,ECL发光。以β-actin为内参,用Gel-Pro Analyzer图像分析软件对结果进行灰度分析,计算目的蛋白的相对表达量(目的蛋白相对表达量=目的蛋白条带灰度值/β-actin条带灰度值),明确MERTK-Ras-MEK-MLCK-myosin通路激活状态。
1.2.5 Ras及MERTK干扰及干扰后MERTK-Ras-MEK-MLCK-myosin通路激活状态测定构建高纯度质粒后行细胞转染以干扰Ras/MERTK基因表达。

图1RPE细胞形态及鉴定A:原代RPE细胞的融合图像(倒置显微镜,×100);B:3~5代RPE细胞的80%
融合图像(倒置显微镜,×100);C:细胞RPE细胞均表现为Cytokeratin-8免疫染色阳性(倒置荧光显微镜,×400)。
1.2.5.1质粒构建分别设计3个干扰片段,位点分别为Ras-245、Ras-509、Ras-601,对应序列分别为245-GAGCGCCTTGACGATACAG,509-GGACTCTGAAGATGTGCCT,601-GGAGTTACGGGATTCCGTT及Mertk-431,Mertk-1316,Mertk-1528,对应序列分别为431-GATGGAAAGGAATTGCTCG,1316-AGCGCAGGGACTTACAAAG, 1528-CACCGACTCTATGTTCATC。对pRNA-H1.1质粒进行双酶切并与目的基因连接后加入至100μL JM109感受态细胞中培养、提取质粒,鉴定及筛选阳性克隆,标记为Ras-sh1,Ras-sh2,Ras-sh3,MERTK-sh1,MERTK-sh2,MERTK-sh3,测序。
1.2.5.2细胞转染配制转染试剂:溶液1:100μL优化液+8μL脂质体2000;溶液2:100μL优化液+2μg质粒,将溶液1与溶液2混匀,室温下放置20min后缓慢加入RPE细胞培养板中,摇动培养板混匀,37℃、5% CO2培养6h。弃去转染培养基上清,更换为细胞完全培养液,37℃、5% CO2继续培养24h后收集细胞以SYBR Green Real-Time PCR KIT检测Ras/MERTK基因表达情况,Ras基因引物分别为:5’-TTGTGGATGAGTATGACCCTA-3’及5’-CTCCTCTTGACCTGCTGTGT-3’,MERTK基因引物分别为:5’-CCTGGCAACACCGACTCTA-3’及5’-TTTACGACCAGTTGGGAATC-3’,内参β-actin基因引物分别为5’-CTGTGCCCATCTACGAGGGCTAT-3’及5’-TTTGATGTCACGCACGATTTCC-3’。选择干扰效果最佳的片段进行正式实验。
1.2.5.3干扰后MERTK-Ras-MEK-MLCK-myosin通路激活状态测定及吞噬功能检测将siRas-RPE细胞及si-MERTK-RPE细胞与ROS孵育不同时间后[0min(即为对照组)、30、60、120、180min]采用Western-Blot方法检测MERTK、Ras、MEK及MLCK的蛋白表达情况,并比较孵育120min及180min时未转染RPE细胞、siRas-RPE细胞及si-MERTK-RPE细胞中MERTK、Ras、MEK及MLCK的蛋白表达;采用双重荧光标记法测定siRas-RPE细胞及siMERTK-RPE细胞的吞噬功能的变化。
统计学分析:每步实验重复3次,结果以 SPSS 17.0软件进行重复测量方差分析及单因素方差分析进行统计,P<0.05为差异有统计学意义。
2结果
2.1 C57BL/6小鼠RPE细胞的培养及鉴定原代RPE细胞胞浆内可见棕褐色色素颗粒,细胞呈多边形,3~5代RPE细胞透明,无色素,呈梭形。Cytokeratin-8免疫染色后可见全部RPE细胞均呈现阳性绿色荧光,提示培养细胞为RPE细胞(图1)。

图2不同孵育时间RPE细胞结合及吞入ROS数量。
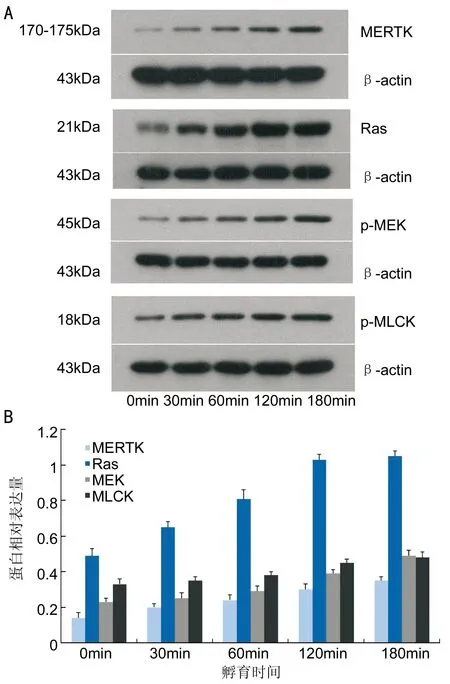
图3Western-Blot检测RPE细胞与ROS孵育不同时间MERTK、Ras、MEK、MLCK表达的变化A:PVDF膜扫描图像显示孵育不同时间MERTK、Ras、MEK、MLCK蛋白的表达;B:孵育不同时间MERTK、Ras、MEK、MLCK蛋白相对表达量的比较。
2.2吞噬检测结果双重荧光标记方法检测RPE吞噬ROS的结果显示,在孵育30min时可见ROS被RPE吞入胞浆内,随着孵育时间的延长结合及吞入的ROS数量不断增加,至孵育3h时,结合及吞入的ROS数量达到饱和(图2)。
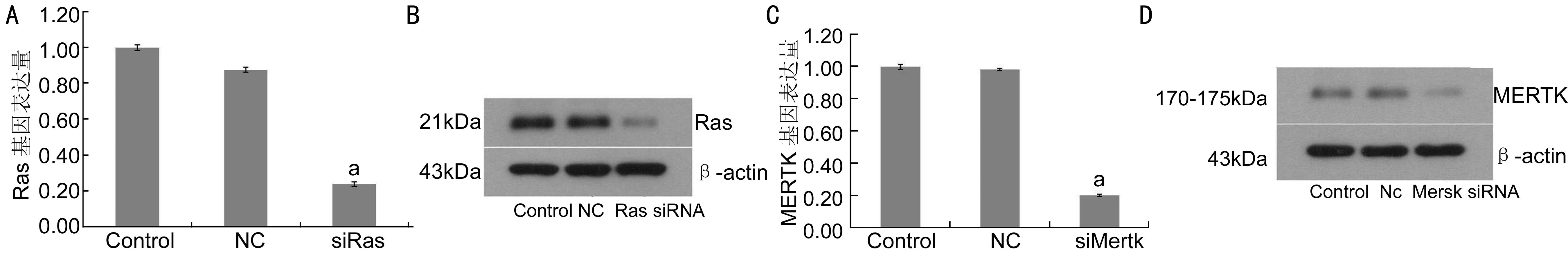
图4Ras基因干扰后RPE细胞Ras基因及蛋白表达的变化A:Real-time PCR检测Ras基因干扰后RPE细胞Ras基因表达的变化(以2-△△Ct均值表示);B:Western-Blot检测Ras基因干扰后RPE细胞Ras蛋白表达的变化;C:Real-time PCR检测MERTK基因干扰后RPE细胞MERTK基因表达的变化(以2-△△Ct均值表示);D:Western-Blot检测MERTK基因干扰后RPE细胞MERTK蛋白表达的变化;Control:正常REP细胞;NC:空载体转染组;siRAS:Ras基因干扰组;siMERTK:MERTK基因干扰组;aP<0.05vsControl组、NC组。
2.3吞噬过程中MERTK-Ras-MEK-MLCK-myosin通路激活状态测定将3~5代RPE细胞与ROS共同孵育不同时间(30、60、120、180min)后,Western-Blot检测相关蛋白的表达变化,结果显示RPE细胞与ROS共同孵育30min时,与对照组(0min)相比,MERTK、MEK和MLCK的磷酸化水平升高,Ras蛋白表达量增加,并且随着孵育时间的延长MERTK、MEK和MLCK的磷酸化水平与Ras表达量均不断增多(P<0.05,图3)。
2.4 Ras/MERTK干扰及干扰后MERTK-Ras-MEK-MLCK-myosin通路激活状态测定三个不同片段构建的质粒进行小鼠RPE细胞瞬时转染Ras/MERTK后,Real-time PCR检测结果显示Ras-sh3(即Ras-601)及MERTK-sh3(即MERTK-1528)干扰效果最佳。以Ras-sh3及MERTK-sh3瞬时转染后测定RPE细胞Ras及MERTK基因及蛋白表达均较未转染组明显降低(P<0.05,图4)。
以Ras-sh3片段构建的质粒重新进行小鼠RPE细胞瞬时转染Ras后,将siRNA-Ras的RPE细胞与ROS孵育不同时间[0min(即为对照组)、30、60、120、180min],再次采用Western-Blot方法检测MERTK、Ras、MEK及MLCK的蛋白表达,结果显示MERTK、Ras、MEK、MLCK蛋白的表达水平均与对照组(0min)无显著差异(P>0.05),即在全部孵育过程中MERTK、Ras、MEK、MLCK的蛋白始终维持在较低的表达水平(图5A第1~5条带);同时,与未转染的RPE细胞相比,siRas-RPE细胞与ROS共孵育120、180min时,MERTK、MEK、MLCK的磷酸化水平及Ras蛋白表达量均明显下调(P<0.05,图5A第6~9条带)。
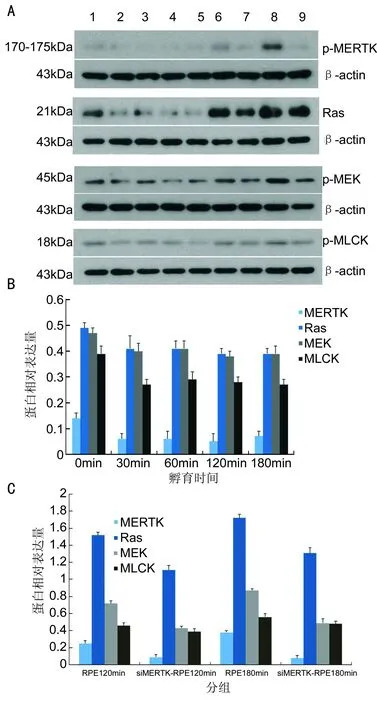
以MERTK-sh3片段构建的质粒重新进行小鼠RPE细胞瞬时转染Ras后,将siMERTK-RPE细胞与ROS孵育不同时间[0min(即对照组)、30、60、120、180min],再次采用Western-Blot方法检测MERTK、Ras、MEK及MLCK的蛋白表达,结果显示在全部孵育过程中MERTK、Ras、MEK、MLCK的蛋白始终维持在较低的表达水平(P>0.01,图6第1~5条带);同时,与未转染的RPE细胞相比,siMERTK-RPE细胞与ROS共孵育120、180min时,MERTK及Ras、MEK、MLCK的蛋白表达量均减少(图6A第6~9条带,P<0.05),但其蛋白表达的下降幅度并没有siRas-RPE细胞大。
siRas-RPE细胞及siMERTK-RPE细胞的吞噬数量的变化:分别将siRas-RPE细胞及siMERTK-RPE细胞与ROS孵育不同时间(30、60、120、180、240min)后,再次进行吞噬数量测定,结果显示siRas-RPE细胞结合ROS的数量随孵育时间延长逐渐增加,而吞入ROS的数量极少,仅在孵育180min时可观察到少量ROS吞入了RPE细胞内。图6Western-blot检测siMERTK-RPE细胞与ROS孵育不同时间MERTK、Ras、MEK、MLCK蛋白表达的变化A:Western-Blot检测扫描图像,从左至右:1~5显示对照组及siMERTK-RPE细胞与ROS孵育30、60、120、180min MERTK、Ras、MEK、MLCK蛋白表达的变化;6、7分别为未转染RPE细胞及siMERTK-RPE细胞与ROS孵育120min MERTK、Ras、MEK、MLCK蛋白表达的变化;8、9分别为未转染RPE细胞及siMERTK-RPE细胞与ROS孵育180min MERTK、Ras、MEK、MLCK蛋白表达的变化;β-actin基因为内参;B:siMERTK-RPE细胞与ROS孵育不同时间MERTK、Ras、MEK、MLCK蛋白相对表达量的变化;C:RPE细胞及siMERTK-RPE细胞与ROS孵育120min及180min MERTK、Ras、MEK、MLCK蛋白相对表达量的比较。
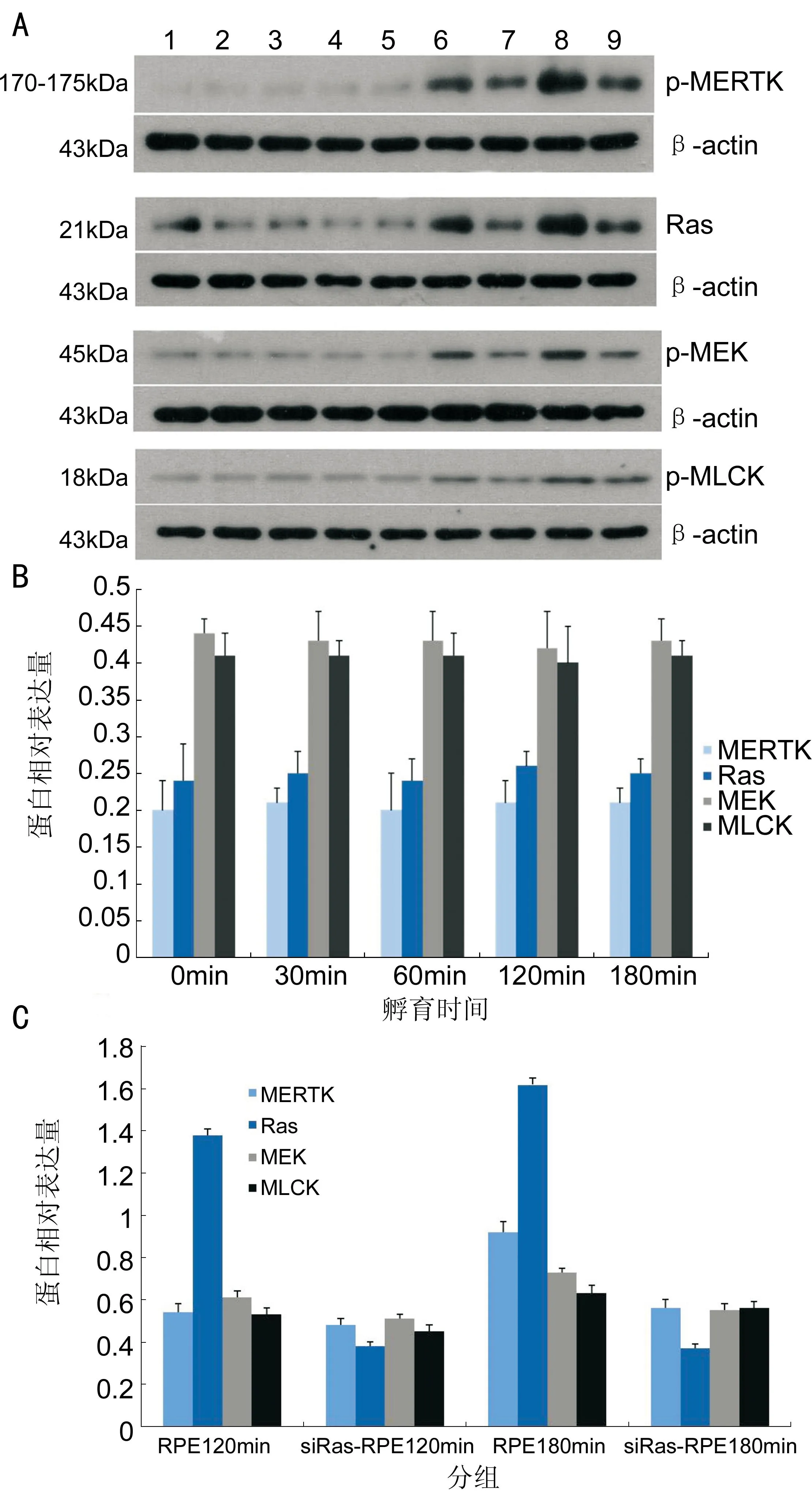
图5Western-Blot检测siRas-RPE细胞与ROS孵育不同时间MERTK、Ras、MEK、MLCK蛋白表达的变化A:Western-Blot检测扫描图像,从左至右:1~5显示对照组及siRas-RPE细胞与ROS孵育30、60、120、180min MERTK、Ras、MEK、MLCK蛋白表达的变化;6、7分别为未转染RPE细胞及siRas-RPE细胞与ROS孵育120min MERTK、Ras、MEK、MLCK蛋白表达的变化;8、9分别为未转染RPE细胞及siRas-RPE细胞与ROS孵育180min MERTK、Ras、MEK、MLCK蛋白表达的变化;β-actin基因为内参;B:siRas-RPE细胞与ROS孵育不同时间MERTK、Ras、MEK、MLCK蛋白相对表达量的变化;C:RPE细胞及siRas-RPE细胞与ROS孵育120min及180min MERTK、Ras、MEK、MLCK蛋白相对表达量的比较。
比较RPE细胞和siRas-RPE细胞与ROS结合与吞入ROS的数量,可见孵育各时间点结合数量无明显变化,而吞入ROS的数量减少了97%(孵育180min时,图7)。siMERTK-RPE细胞结合ROS的数量随孵育时间延长逐渐增加,而未见吞入ROS(图7)。
3讨论
与受体酪氨酸激酶(RTK)相关的信号通路比较复杂,目前已知的下游信号通路分为Ras-MAPK、PI3K-Akt、PLCγ-IP3/DG三种,这三条通路涉及了许多的细胞功能,如增殖、分化、迁移以及凋亡功能[12-13],其中的Ras-MAPK途径是生长因子、细胞因子及整合素等所共有的信号通路。RTK与腺体结合后激活,激活的RTK与生长因子结合蛋白-2(Grb2)结合,Grb2实际上是一种结合蛋白,它含有一个SH2和两个SH3域,SH2可与RTK结合,SH3可与GEF(guanine exchange factor,鸟嘌呤交换因子)结合,这样就形成了RTK-Grb2-GEF复合体,该复合体在GEF的作用下将Ras激活,进而通过逐级反应激活MEK及MLCK,从而活化肌球蛋白myosin,即RTK-Grb2-Ras-MEK-MLCK-myosin通路。近年来的研究证实,人RPE细胞吞噬ROS过程中也是通过受体酪氨酸激酶MERTK与细胞内蛋白的SH2域结合后来启动细胞骨架重排及细胞膜运动的[14]。但是RPE细胞吞噬ROS过程中MERTK磷酸化激活后是否启动了下游的Ras-MEK-MLCK-MLC通路目前尚未见报道。

图7不同孵育时间RPE、siRas-RPE及siMERTK-RPE细胞及结合及吞入ROS数量比较。
本研究在离体条件下模拟RPE细胞吞噬ROS的条件,并检测了吞噬动力学及吞噬过程中MERTK、Ras、MEK、MLCK的变化情况,结果发现在孵育30min时可见ROS被RPE吞入胞浆内,随着孵育时间的延长吞噬数量不断增加,至孵育3h,吞噬数量达到饱和;同时,在孵育过程中,随着孵育时间的延长,MERTK、Ras、MEK及MLCK的蛋白表达水平不断增加,这种吞噬动力学与蛋白表达的变化趋势的一致性提示,吞噬过程中MERTK与ROS结合后激活了下游的Ras信号通路。
为了进一步证实这一假设,本研究组采用RNA干扰技术将RPE细胞的Ras基因沉默后,再次进行孵育实验并测定吞噬变化及吞噬过程中MERTK、Ras、MEK及MLCK的变化情况,结果发现:在孵育过程中,随着孵育时间的延长,siRas-RPE细胞结合ROS的数量明显增加,而吞入ROS的数量极少,仅在孵育180min时可观察到少量ROS吞入了RPE细胞内。与RPE细胞相比,siRas-RPE细胞结合ROS的数量无明显变化,而吞入ROS的数量下降了97%(图7)。同时,随着孵育时间的延长,MERTK、Ras、MEK及MLCK的蛋白表达水平维持低值且不随孵育时间延长而变化(灰度比值均<0.5)。比较孵育120min及180min后正常RPE细胞与siRas-RPE细胞MERTK、Ras、MEK及MLCK蛋白表达水平,更可清晰地看到siRas-RPE细胞MERTK、Ras、MEK及MLCK蛋白表达水平的明显下降。siRas-RPE细胞吞噬动力学与MERTK、Ras、MEK及MLCK蛋白表达水平的一致变化,提示RPE细胞吞噬ROS过程是通过启动MERTK-Ras-MEK-MLCK通路来重排肌球蛋白来完成的。
另一方面,本研究发现,正常RPE细胞孵育过程中随着孵育时间的延长,RPE细胞结合及吞入ROS的数量不断增加,同时MERTK蛋白的表达水平也随着孵育时间的延长而增加;而siRas-RPE细胞孵育过程中随着孵育时间的延长结合ROS的数量逐渐增加,但吞入ROS数量极少,并且MERTK蛋白的表达水平也未随着孵育时间的延长而增加,siRas-RPE细胞的这种变化趋势与MERTK基因突变的RCS鼠相似:RCS鼠由于MERTK基因突变而表达无功能的MERTK蛋白,所以虽然可以结合ROS但是却存在摄入ROS的明显异常[5],从而发生视网膜色素变性。这就从另一角度提示Ras可能为MERTK启动的下游信号这一结论。至于Ras干扰后MERTK蛋白表达水平降低的原因尚待进一步研究,分析可能的原因应与受体酪氨酸蛋白激酶各个复杂的下游通路之间的相互作用有关[15]。
为了明确RCS鼠是否因MERTK异常而无法启动下游的Ras信号通路,从而进一步证实RPE细胞吞噬过程中MERTK-Ras信号通路的存在,本研究用质粒转染技术沉默RPE细胞的MERTK基因来模拟RCS鼠的RPE细胞状态,再次进行孵育实验并测定吞噬变化及吞噬过程中MERTK、Ras、MEK及MLCK的变化情况,结果发现,在全部孵育过程中siMERTK-RPE细胞MERTK、Ras、MEK、MLCK的蛋白始终维持在较低的表达水平(灰度比值均<0.5),比较孵育120min及180min后正常RPE细胞与siMERTK-RPE细胞MERTK、Ras、MEK及MLCK蛋白表达水平,也可看到siMERTK-RPE细胞MERTK、Ras、MEK及MLCK蛋白表达水平的降低。这与siRas-RPE细胞孵育过程中MERTK、Ras、MEK、MLCK的蛋白表达变化保持一致,证实Ras确为MERTK启动的下游信号。
当然,本研究采用的是质粒瞬时转染技术干扰Ras及MERTK基因及蛋白的表达,虽然进行了多个序列筛选、采用效果最佳的序列进行转染,但仍不能完全沉默Ras及MERTK基因及蛋白的表达(图3),加上目前检测蛋白表达的免疫印迹方法也只能通过灰度比值这一相对数值来评估,所以研究结果存在无法避免的误差。
但是,无论如何本研究初步探讨了鼠RPE细胞吞噬功能与MERTK-Ras-MEK-MLCK通路的关系,发现正常鼠RPE细胞在吞噬ROS过程中MERTK、Ras、MEK及MLCK蛋白表达增加(灰度比值>0.5),而干扰了MERTK及Ras基因表达后RPE细胞在吞噬ROS过程中MERTK、Ras、 MEK及MLCK蛋白表达维持在较低水平,且不随孵育时间延长而增加(灰度比值均<0.5),从而证实RPE细胞通过受体酪氨酸激酶MERTK激活下游Ras、MEK及MLCK通路,引起肌球蛋白重排完成吞噬功能,进一步阐明了RPE细胞吞噬机制,为今后视网膜色素变性的治疗提供了新的靶点。
参考文献
1 Mayerson PL, Hall MO.Rat retinal pigment epithelial cells show specificity of phagocytosisinvitro.JCellBiology1986;103(1):299-308
2 Feng W, Yasumura D, Matthes MT,etal. Mertk triggers uptake of photoreceptor outer segments during phagocytosis by cultured retinal pigment epithelial cells.JBiolChem2002;277(19):17016-17022
3 Nandrot EF, Silva KE, Scelfo C,etal. Retinal pigment epithelial cells use a MerTK-dependent mechanism to limit the phagocytic particle binding activity of αvβ5 integrin.BiolCell2012;104(6):326-341
4 Seitz HM, Camenisch TD, Lemke G,etal. Macrophages and dendritic cells use different Axl/Mertk/Tyro3 receptors in clearance of apoptotic cells.JImmunol2007;178(9):5635-5642
5 Strick DJ, Feng W, Vollrath D. Mertk drives myosin Ⅱ redistribution during retinal pigment epithelial phagocytosis.InvestOphthalmolVisSci2009;50(5):2427-2435
6 Graham DK, Dawson TL, Mullaney DL,etal. Cloning and mRNA expression analysis of a novel human protooncogene, c-mer.CellGrowthDiffer1994;5(6):647-657
7 Kopec AM, Carew TJ. Growth factor signaling and memory formation: temporal and spatial integration of a molecular network.LearnMem2013;20(10):531-539
8 Nguyen DH, Catling AD, Webb DJ,etal. Myosin light chain kinase functions downstream of Ras/ERK to promote migration of Urokinase-type plasminogen activator-stimulated cells in an integrin-selective manner.JCellBiol1999;146(1):149-164
9 Hu WY, Han YJ, Gu LZ,etal.Involvement of Ras-regulated myosin light chain phosphorylation in the captopril effects in spontaneously hypertensive rats.AmJHypertens2007;20(1):53-61
10 Papermaster DS, Dreyer WJ. Rhodopsin content in the outer segment membranes of bovine and frog retinal rods.Biochemistry1974;13(11):2438-2439
11孙昱昭,洪晶.双重荧光标记法检测人视网膜色素上皮细胞吞噬的功能.国际眼科杂志2006;6(1):42-46
12 Yue J, Mulder KM.Requirement of Ras/MAPK pathway activation by transforming growth factor beta for transforming growth factor beta 1 production in a Smad-dependent pathway.JBiolChem2000; 275(40):30765-30773
13 McCubrey JA, Steelman LS, Abrams SL,etal. Roles of the RAF/MEK/ERK and PI3K/PTEN/AKT pathways in malignant transformation and drug resistance.AdvEnzymeRegul2006;46:249-279
14 Shelby SJ, Colwill K, Dhe-Paganon S,etal.MERTK interactions with SH2-domain proteins in the retinal pigment epithelium.PLoSOne2013;8(2):e53964
15 Sasaki T, Hiroki K, Yamashita Y. The role of epidermal growth factor receptor in cancer metastasis and microenvironment.BiomedResInt2013;2013:546318
Yu-Zhao Sun, Ruo-Shuang Zhang, Feng Gu
Foundation item:Science and Technology Planning Project of Shenyang (No. F13-316-1-11)
Department of Ophthalmology, the First Hospital of China Medical University, Shenyang 110001, Liaoning Province, China
Correspondence to:Yu-Zhao Sun. Department of Ophthalmology, the First Hospital of China Medical University, Shenyang 110001, Liaoning Province, China. sunyz91667@sina.com
Received:2015-10-16Accepted:2015-12-20
Abstract
•AIM:To investigate relation between the phagocytic fuction of retinal pigment epithelial (RPE) cells and the signal transduction pathway of MERTK-Ras-extracellular signal regulated kinase kinase(MEK)-myosin light chain kinase(MLCK)-myosin.
•METHODS: Cultured 3~5 passage RPE cells of C57BL/6 mouse were incubated with rod outer segments (ROS) suspension (containing ROS 1×107/ml) at 37℃, then cells were rinsed at different times(30,60,120,180,240min) to terminate the phagocytosis. The kinetics of phagocytosis was measured by double-fluorescent labeling. The activity levels of MERTK, Ras, MEK and MLCK at different incubation times were measured by Western Blot with antibodies of MERTK, Ras and phospho-antibodies of MEK and MLCK, respectively. To repeat the measurement of the phagpcytic kinetics and activity levels of MERTK, Ras, MEK and MLCK at different incubation times after interference to Ras and Mertk gene in RPE cells by plasmid transfection.
•RESULTS: The phagocytic kinetics showed that the ingestion occurred at 30min of incubation. Ingested ROS by RPE cells increased until saturated at 180min. The protein levels of MERTK, Ras, MEK and MLCK in RPE cells increased during all the incubation periods compared with control group(P<0.05). After interference to Ras and MERTk gene in RPE cells by plasmid transfection, the protein levels of MERTK, Ras, MEK and MLCK and the quality of ingested ROS sustained at the lower levels during all the incubation periods, only a few ingested ROS were seen at 180 min. Compared with untransfected RPE cells, the protein levels of MERTK, Ras, MEK and MLCK and the quality of ingested ROS in siRas-RPE cells and siMERTK-RPE cells decreased distinctly at 120 min and 180 min during incubation(P<0.05).
•CONCLUSION: Ras-MEK-MLCK-myosin signal pathway is the downstream of MERTK receptor in the phagocytic process of RPE cells from mice.
KEYWORDS:•retinal pigment epithelium;phagocytosis; MERTK; Ras; myosin
DOI:10.3980/j.issn.1672-5123.2016.1.07
收稿日期:2015-10-16 修回日期: 2015-12-20
通讯作者:孙昱昭.sunyz91667@sina.com
作者简介:孙昱昭,毕业于中国医科大学,眼科学博士,副教授,研究方向:视网膜变性基础研究、眼表角膜病的基础和临床研究。
基金项目:沈阳市科技计划项目(No.F13-316-1-11)
作者单位:(110001)中国辽宁省沈阳市,中国医科大学附属一院眼科
