鱼粉蛋白与发酵酶解豆粕蛋白不同配比对日本沼虾生长及免疫性能的影响
2016-01-19丁志丽张易祥叶金云周志金杜震宇浙江省水生生物资源养护与开发技术研究重点实验室中国水产科学研究院水生动物繁育与营养重点实验室湖州师范学院生命科学学院湖州000湖州市水产技术推广站湖州000华东师范大学生命科学学院上海0006
丁志丽张易祥叶金云∗周志金杜震宇(.浙江省水生生物资源养护与开发技术研究重点实验室,中国水产科学研究院水生动物繁育与营养重点实验室,湖州师范学院生命科学学院,湖州000;.湖州市水产技术推广站,湖州000;.华东师范大学生命科学学院,上海0006)
鱼粉蛋白与发酵酶解豆粕蛋白不同配比对日本沼虾生长及免疫性能的影响
丁志丽1张易祥1叶金云1∗周志金2杜震宇3
(1.浙江省水生生物资源养护与开发技术研究重点实验室,中国水产科学研究院水生动物繁育与营养重点实验室,湖州师范学院生命科学学院,湖州313000;2.湖州市水产技术推广站,湖州313000;
3.华东师范大学生命科学学院,上海200062)
摘 要:本试验旨在评价补充微囊氨基酸条件下鱼粉蛋白和发酵酶解豆粕蛋白不同配比对日本沼虾生长和免疫性能的影响。试验配制5组等氮等能饲料,以发酵酶解豆粕分别替代饲料中0(FM组)、25%(R25组)、50%(R50组)、75%(R75组)以及100%的鱼粉(R100组)(鱼粉蛋白与发酵酶解豆粕蛋白配比分别为1∶0、3∶1、1∶1、1∶3和0∶1),对平均体重为(0.103 0±0.000 2)g的日本沼虾进行8周的饲养试验,随后对各组虾进行嗜水气单胞菌感染试验。每组设5个重复,每个重复50尾虾。结果表明:当鱼粉蛋白与发酵酶解豆粕蛋白配比为1∶1时,日本沼虾的增重率达到最大,显著高于FM和R100组(P<0.05),各组日本沼虾的存活率无显著差异(P>0.05);各组日本沼虾的肝胰腺超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH⁃Px)活力及丙二醛(MDA)含量无显著差异(P>0.05);FM组日本沼虾的血细胞总数及血淋巴吞噬活性均显著高于R100组(P<0.05);肝胰腺中热应激同源蛋白70和热应激蛋白90的mRNA相对表达水平分别在FM和R25组达到最高,显著高于其余各组(P<0.05);当发酵酶解豆粕替代鱼粉比例超过50%时,嗜水气单胞菌感染后日本沼虾的累计死亡率显著增加(P<0.05)。由此可见,发酵酶解豆粕可作为日本沼虾饲料中较好的蛋白质源,在氨基酸平衡条件下鱼粉蛋白和发酵酶解豆粕蛋白的最佳配比为1∶1。
关键词:日本沼虾;发酵酶解豆粕;鱼粉;生长性能;免疫力
鱼粉,由于具有较高的营养价值、良好的适口性,一直以来都作为水产饲料中的主要蛋白质源[1]。然而,当前鱼粉的供需矛盾、价格居高不下的现实已大大制约了其在水产饲料中的使用量[2]。因此,寻找质优价廉的蛋白质源是水产养殖业可持续发展的重要课题。植物性蛋白质源由于具有分布广泛、产量稳定、价格低廉等特点,其受到越来越多的关注[3]。其中,豆粕是当前使用最为广泛的植物性蛋白质源,这与其具有蛋白质含量高、来源稳定等优点密不可分[3-4]。
值得注意的是,豆粕中存在的抗营养因子大大限制了其在饲料中的添加比例[5-6]。采用发酵、酶解、热处理等技术可在一定程度上去除豆粕中的抗营养因子,提高豆粕的使用效率[7]。酶解豆粕可得到分子质量较小的小肽,但存在苦腥味,而发酵与酶解相比,使豆粕的风味得到极大改善,并产生了大量生物活性物质[8]。对高等陆生动物的研究表明,饲料中添加发酵豆粕具有较好的促生长效果[9-10]。对水产动物如鱼类的研究发现,发酵豆粕可以一定比例的替代鱼粉,如发酵豆粕替代60%的鱼粉而不影响虹鳟(Oncorhynchus mykiss)的生长性能[11],且Yamamoto等[12]研究得出虹鳟饲料可以不使用鱼粉,在添加3%的氨基酸时,饲料中的蛋白质可以完全由发酵豆粕来供给。在其他鱼类[13-16]和经济甲壳动物[17-18]的研究中同样发现了发酵豆粕替代鱼粉的优良效果。
由此可见,发酵豆粕已经在畜禽及水产动物养殖中得到广泛的应用,但微生物发酵蛋白质的能力有限,只能将蛋白质水解成大分子的多肽[19]。因此,人们开始着手将豆粕发酵技术和酶解技术相结合,开发出具有芳香味、含有小肽的发酵酶解豆粕。已有的研究表明,发酵酶解豆粕能提高小鼠抗氧化能力、胃肠道蛋白酶活力、肠道有益菌群数量和免疫器官指数[20],并能提高仔猪对饲粮营养物质的消化率,降低应激性腹泻,提高生长性能[21]。然而,发酵或酶解技术并不能改变豆粕中的赖氨酸和蛋氨酸水平相对较低[5]的事实,如果在替代鱼粉时辅以补充晶体或微囊氨基酸是否更有利于提高豆粕替代鱼粉的比例,我们不得而知。从已有的研究来看,在鱼类或虾类饲料中补充氨基酸,能提高其他蛋白质源替代鱼粉的比例[12,22-24]。
日本沼虾(Macrobrachium nipponense)又名青虾、河虾,为我国和东南亚一些国家的主要的淡水经济养殖种类之一[25]。目前,对日本沼虾各生长阶段蛋白质的需求量已有较多的研究[26-28],使用廉价蛋白质源替代鱼粉也有零星报道,如玉米蛋白粉[29]、肉骨粉和禽类副产品粉[25]等。基于日本沼虾较高蛋白质需求量的现状及其饲料中蛋白质替代的研究进展,本试验拟使用发酵酶解豆粕部分替代鱼粉,通过测定日本沼虾的生长、抗氧化以及免疫性能等指标,探明鱼粉蛋白和发酵酶解豆粕蛋白的适宜配比。
1 材料与方法
1.1 试验材料
试验用发酵酶解豆粕(小肽含量为9.35%,粗蛋白质含量为47.70%,粗脂肪含量为0.42%)由湖州环农微生物研究所提供,其主要通过菌种(植物乳杆菌、嗜酸乳杆菌及干酪乳杆菌等)发酵和酶解(蛋白酶、纤维素酶、β-葡聚糖酶等)技术制作。试验用鱼粉为进口优质白鱼粉(粗蛋白质含量为66.69%,粗脂肪含量为9.10%),由浙江璟宝饲料股份有限公司提供。
1.2 试验饲料
试验共设计5组等氮(粗蛋白质含量为39%)等能(总能水平为15 MJ/kg)的试验饲料,用发酵酶解豆粕分别替代饲料中0(FM组)、25%(R25组)、50%(R50组)、75%(R75组)和100%的鱼粉(R100组),使得鱼粉蛋白与发酵酶解豆粕蛋白配比分别为1∶0、3∶1、1∶1、1∶3和0∶1。
试验饲料的制作步骤如下:首先将各种原料粉碎过60目筛,按配方准确称量,采用逐级扩大法将维生素、矿物质预混料和氨基酸等微量成分按比例充分混匀,然后加入鱼油与豆油混合油、大豆卵磷脂继续搓匀,最后加入水(400 mL/kg DM)搅拌混匀,用小型饲料造粒机制成粒径为1.5 mm的颗粒饲料,40℃烘干至饲料中水分含量达到约10%后,密封后置于-20℃保存备用。
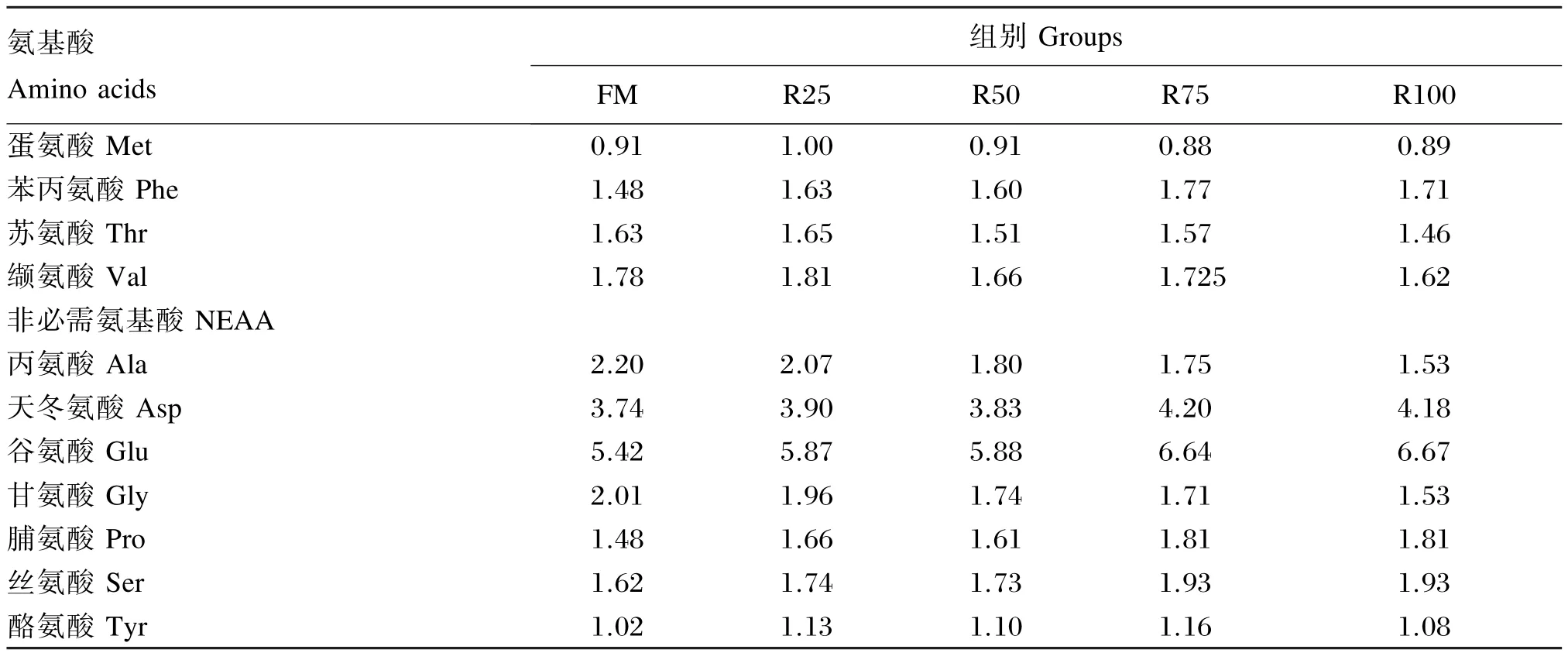
饲料中粗蛋白质含量的测定采用凯氏定氮法(Kjeltec 2200,FOSS,丹麦),粗脂肪含量的测定采用索氏抽提法(SoxtecTM2043,FOSS,丹麦),粗灰分含量的测定采用马福炉550℃灼烧(14 h)法,水分含量的测定采用105℃烘干(24 h)恒重法,总能水平使用氧弹仪(WELL 9000)测定。饲料在酸水解后,采用全自动氨基酸分析仪(L-8900,Hi⁃tachi)测定其氨基酸组成。试验饲料组成及营养水平见表1,氨基酸组成见表2。
1.3 试验动物及饲养管理
试验用虾购于湖州邦达生态农业有限公司,暂养1周后,选择健康、体重均匀[平均体重为(0.103 0±0.000 2)g]的日本沼虾,随机分为5组,每组5个重复,每个重复50尾,以重复为单位随机放入到体积为300 L的水族箱中,每个水族箱内放置一定量的网片作为躲避物,以减少试验虾互残。试验于2013年7月至2013年9月于浙江省水生生物资源养护与开发技术研究重点实验室进行,每天07:00吸污并换水(换水量约为1/3),试验使用的水源为曝气的自来水,水质条件为:水温25~29℃,pH 7.6~8.1,溶氧浓度>6.5 mg/L,总氨氮浓度<0.01 mg/L。每日07:30、17:00各投喂1次饲料,投喂量为虾体重的4%~5%,投喂2 h后将箱中残余的饲料吸出,烘干后称重,用于计算摄食量。养殖试验持续8周。

表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air⁃dry basis) %

表2 试验饲料的氨基酸组成(风干基础)Table 2 Amino acid composition of experimental diets(air⁃dry basis) %
续表2
1.4 样品采集
养殖试验结束饥饿1 d后,各组试验虾称重,并统计存活数。用1 mL无菌注射器采集试验虾(每重复5尾)的血淋巴,加入等体积的抗凝剂(由30 mmol/L柠檬酸三钠、0.34 mol/L氯化钠、10 mmol/L乙二胺四乙酸、0.115 mol/L葡萄糖组成,pH 7.55)用以统计试验虾的血细胞总数(THC)和血淋巴吞噬活性(PA)。使用解剖器从试验虾的头胸部取出肝胰腺,保存于-80℃用于后续酶活力的测定及基因表达的分析。
1.5 指标测定
1.5.1 生长性能指标计算公式
存活率(SR,%)=100×试验结束时存活虾个体数/试验开始时虾的个体数;
增重率(WGR,%)=100×(试验结束时虾的平均体重-试验开始时虾的平均体重)/试验开始时虾的平均体重;
特定生长率(SGR,%/d)=100×(ln终末体重-ln初始体重)/试验天数;
饲料系数(FCR)=饲料摄入量/(终末体重-初始体重)。
1.5.2 抗氧化及免疫性能指标测定
1.5.2.1 血细胞总数及血淋巴吞噬活性
采用血球计数器测定各组试验虾的血细胞总数,具体操作为:将一定体积的血淋巴添加在血球计数器上,在光学显微镜下对25个中方格中血细胞进行计数,每个数值至少读取3次。根据稀释倍数及血淋巴体积计算血细胞总数。
血淋巴吞噬活性的测定主要参考Long等[30]和张琴[31]的方法,并做稍许改动,主要操作步骤如下:取100 μL血细胞加入96孔板中,贴壁1 h后,弃上清,加入100 μL 0.001 mol/L的中性红溶液,吞噬30 min后,用生理盐水洗掉未被吞噬的中性红,加入100 μL细胞裂解液(冰醋酸∶无水乙醇=1∶1,体积比),裂解20 min后,在酶标仪(Thermo,Multiskan FC)中测定溶液在波长540 nm处的吸光度值。
吞噬活性=(吸光度值/106个血细胞)×100。
1.5.2.2 肝胰腺丙二醛含量和抗氧化酶活力测定
准确称取肝胰腺约0.5 g,按质量体积比1∶9加入预冷的0.86%的生理盐水制成10%匀浆液,3 500 r/min离心15 min,吸取上清液。根据各种酶活力的测定方法将上清液稀释成不同浓度,其中上清液中蛋白质含量的测定采用考马斯亮蓝法。所有酶活力的测定均按照试剂盒(南京建成生物工程研究所生产)说明书进行。脂质过氧化程度通过测定组织中丙二醛(MDA)含量变化来反映,用硫代巴比妥酸(TBA)法测定肝胰腺中MDA含量。
脂质过氧化降解产物中的MDA与TBA缩合形成红色产物,根据颜色变化于532 nm处进行比色;超氧化物歧化酶(SOD)活力的测定采用黄嘌呤氧化酶法,已每毫克组织蛋白质在l mL反应液中SOD抑制率达50%时所对应的SOD量为1个活力单位(U);谷胱甘肽过氧化物酶(GSH⁃Px)的测定原理为GSH⁃Px可以促进过氧化氢(H2O2)与还原型谷胱甘肽(GSH)反应生成水(H2O)及氧化型谷胱甘肽(GSSG),通过测定GSH的消耗进而得出GSH⁃Px的活力。
1.6 嗜水气单胞菌感染试验
8周的养殖试验结束后,从每个组中随机挑取3个重复,每个重复20只虾,以重复为单位暂养在18个玻璃缸中,各组中每尾试验虾从第3步足基部关节软膜处分别注射嗜水气单胞菌(Aeromonas hydrophila)菌液50 μL,菌液浓度为3.5× 107CFU/mL。攻毒后12 h恢复投饲,且连续观察试验虾的死亡情况,统计各组试验虾96 h的累计死亡率。试验期间连续充气,每天换水1/2,水的pH为7.6~8.1,温度为25~29℃。
1.7 基因表达的荧光定量PCR(qRT⁃PCR)分析
使用总RNA提取试剂盒(艾德莱,北京)提取肝胰腺总RNA,具体操作按照试剂盒说明书进行,电泳检测RNA的完整性、核酸蛋白测定仪检测其浓度和纯度。用反转录试剂盒(TaKaRa,日本)将RNA反转录为cDNA,cDNA保存在-20℃用于qRT⁃PCR分析。
采用在线Primer 3设计热应激同源蛋白70 (heat shock cognate protein 70,HSC70)和热应激蛋白90(heat shock protein 90,HSP90)qRT⁃PCR所用引物如下:HSC70上游引物5′-GCGTCT⁃TATTGGTGATGC-3′,下游引物5′-TA⁃AAGGGCCAATGTTTCA-3′;HSP90上游引物5′-GAAGGAAAGGGACAAGGA-3′,下游引物5′-GGTCCATAAAGGCTTGGT-3′。反应体积为20 μL,包括:10 μL的2×SYBR Green Premix Ex Taq(TaKaRa,日本),上、下游引物各0.2 μL (10 μmol/L),2 μL模板,7.6 μL ddH2O。qRT⁃PCR反应条件为:95℃预变性30 s;94℃变性15 s,58℃退火20 s,72℃延伸20 s,共40个循环;PCR反应后温度以每5 s上升5℃的速度从60℃上升到95℃,绘制熔解曲线,以判断扩增产物的正确性。以日本沼虾β-肌动蛋白(β⁃actin,上游引物5′-GTGCCCATCTACGAGGGTTA-3′,下游引物5′-CGTCAGGGAGCTCGTAAGAC-3′)为内参,对得到的各样品循环数(Ct)值进行均一化处理,以对照组(FM组)mRNA为基准,使用2-ΔΔCt比较Ct值方法[32]对目的基因mRNA相对表达水平进行分析。
1.8 统计分析
试验结果以平均值±标准误(mean±SE)表示,采用SPSS 11.5对数据进行单因素方差分析(oneway ANOVA)后,若差异达到显著水平,则进行Duncan氏法多重比较,显著水平为P<0.05。
2 结 果
2.1 鱼粉蛋白和发酵酶解豆粕蛋白不同配比对日本沼虾生长性能的影响
由表3可知,当饲料中豆粕替代鱼粉比例为50%(鱼粉蛋白与发酵酶解豆粕蛋白配比为1∶1)时,日本沼虾的增重率和特定生长率达到最大值,显著高于全鱼粉组(FM组)和全豆粕组(R100组)(P<0.05),同时饲料系数呈现相反的趋势。各组日本沼虾的存活率差异不显著(P>0.05)。

表3 各组日本沼虾的生长性能Table 3 Growth performance of oriental river prawn(Macrobrachium nipponense)in different groups
2.2 鱼粉蛋白和发酵酶解豆粕蛋白不同配比对日本沼虾肝胰腺抗氧化酶活力及丙二醛含量的影响
由表4可知,日本沼虾摄食不同的饲料后,肝胰腺中SOD、GSH⁃Px在各组间都未出现显著差异(P>0.05)。肝胰腺中MDA含量随着豆粕替代鱼粉比例的增加有先降低后上升的趋势,但各组间亦未表现出显著差异(P>0.05)。

表4 各组日本沼虾的抗氧化酶活力及丙二醛含量Table 4 Antioxidant enzyme activities and MDA content in hepatopancreas of oriental river prawn(Macrobrachium nipponense)in different groups
2.3 鱼粉蛋白和发酵酶解豆粕蛋白不同配比对日本沼虾血细胞数量及血淋巴吞噬活性的影响
由表5可知,FM组日本沼虾的血细胞总数及血淋巴吞噬活性均显著高于R100组(P<0.05)。
2.4 鱼粉蛋白和发酵酶解豆粕蛋白不同配比对日本沼虾肝胰腺HSC70和HSP90 mRNA相对表达水平的影响
由图1可知,FM组HSC70 mRNA的相对表达水平显著高于其余各组(P<0.05),R25、R75及R100组间HSC70 mRNA的相对表达水平无显著差异(P>0.05);HSP90 mRNA的相对表达水平在R25组达到最高,显著高于其余各组(P<0.05),R50、R75及R100组间HSP90 mRNA的相对表达水平未见显著差异(P>0.05)。
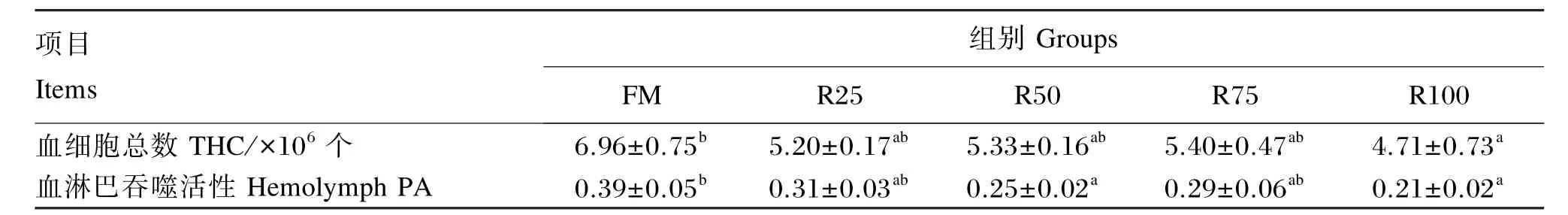
表5 各组日本沼虾的血细胞数量及血淋巴吞噬活性Table 5 THC and hemolymph PA of oriental river prawn(Macrobrachium nipponense)in different groups
2.5 鱼粉蛋白和发酵酶解豆粕蛋白不同配比对日本沼虾抗感染能力的影响
日本沼虾被嗜水气单胞菌感染后,其摄食能力减退,游动速度减慢,并陆续死亡,连续观察96 h后统计其累计死亡率。由图2可知,当豆粕替代鱼粉比例超过50%时,日本沼虾的累计死亡率升高,显著高于FM和R25组(P<0.05)。
3 讨 论
本试验结果显示,在饲料中添加38%的发酵酶解豆粕时,即鱼粉蛋白与酶解发酵豆粕蛋白配比为1∶1时,日本沼虾的生长性能达到最佳,表明豆粕与鱼粉氨基酸的合理搭配能较好的发挥氨基酸的互补作用,促进日本沼虾的生长。Luo等[33]在河蟹饲料中使用豆粕和菜籽粕混合蛋白替代鱼粉时也发现,相对于全鱼粉组,饲料中添加15%的混合蛋白时河蟹的增重率最大。此外,陈立侨等[34]研究也得出动、植物蛋白适宜的配比有利于河蟹生长性能的提高。日本沼虾的食性属于杂食性,单一的蛋白质源饲料可能并不适合其生长发育,Yang等[25]也发现日本沼虾摄食混合蛋白(禽类副产品粉与鱼粉)组相比全鱼粉组增重率显著提高。此外,氨基酸平衡有助于提高必需氨基酸的利用[23],本试验所配饲料中添加了微囊氨基酸来弥补发酵酶解豆粕中赖氨酸和蛋氨酸的不足,这可能对日本沼虾生长性能的促进起到了一定的效果。Floreto等[23]对美国龙虾(Homarus ameri⁃canus)的研究表明,饲料中豆粕补充氨基酸能提高美国龙虾的增重率。Alam等[24]对日本囊对虾(Marsupenaeus japonicas)的研究也发现,在大豆分离蛋白饲料中补充包膜氨基酸能显著提高大豆分离蛋白的营养价值。尽管鱼粉具有良好的适口性,但各替代组日本沼虾的摄食并没有因鱼粉添加量的减少而受到影响,这可能与饲料中添加的赖氨酸和蛋氨酸具有较强的诱食作用[35]有关。

图1 各组日本沼虾肝胰腺HSC70和HSP90 mRNA的相对表达水平Fig.1 HSC70 and HSP90 mRNA relative expression levels in hepatopancreas of oriental river prawn (Macrobrachium nipponense)in different groups

图2 各组日本沼虾感染嗜水气单胞菌后的累计死亡率Fig.2 Cumulative mortality of oriental river prawn(Macrobrachium nipponense)with Aeromonas hydrophila challenge in different groups
对蛋白质源进行替代研究时,虾体的健康状况亦不可忽视,以实现对饲料蛋白质源品质的综合评价。甲壳动物主要依赖非特异性免疫来提高机体对疾病的抵抗力,其中血细胞在甲壳类动物的免疫防御中占主导作用[36]。血细胞总数在一定程度上反映了虾体的健康状态[37],本试验中全鱼粉组日本沼虾的血细胞总数显著高于全豆粕组,说明当发酵酶解豆粕完全替代鱼粉时,虾体的免疫机能发生下降。同时,日本沼虾血细胞吞噬活性的变化与血细胞总数有着相似的变化趋势,表明全植物蛋白质饲料一定程度上降低了虾体的免疫力。
热应激蛋白(HSPs)是高度保守的蛋白质分子家族,在维持细胞蛋白质空间构象、细胞完整性以及调控蛋白质合成、跨膜运输、降解等方面发挥重要的生理功能[38]。其中,HSP70家族由2种不同的基因编码,即结构型HSC70和诱导型HSP70,HSC70主要与细胞的分裂、增殖、发育等生理过程相关[39]。也有研究证明,HSC70具有免疫相关的功能[40],但是否受到营养物质的调控还鲜有报道。本研究结果显示,鱼粉组HSC70 mRNA的相对表达水平最高,添加豆粕后HSC70 mRNA的相对表达水平显著下降,HSC70基因的较高表达增强了对机体组织的保护作用。同时,HSP90 mRNA的相对表达水平在R25组最高,说明该组饲料提高了机体的抗应激能力。以上结果与Olsvik等[41]的研究结果类似,即用混合植物蛋白替代饲料中的鱼粉会引起大西洋鲑(Salmo salar)肝脏中HSP70基因表达的下调。然而,Hansen等[42]用豆粕替代鱼粉、玉米蛋白粉替代鱼粉,或豆粕与玉米蛋白粉混合蛋白物替代鱼粉时发现,大西洋鳕鱼肝脏中HSP70和HSP90基因的相对表达量都未受显著影响。相关研究的结论有如此大的差异性,可能与植物蛋白质源的种类及水生动物对蛋白质源利用的差异有关。从抗氧化酶指标SOD、GSH⁃Px活力及脂质过氧化指标MDA含量来看,各组之间无显著差异,说明日本沼虾摄食发酵酶解豆粕未对机体产生明显的氧化胁迫,且肝胰腺中HSC70和HSP90基因表达水平也未因豆粕添加比例的增加而增加,再次表明发酵酶解豆粕的添加未对机体产生较明显的胁迫作用。综合各组日本沼虾的血细胞总数和血淋巴吞噬活性,以及肝胰腺HSC70 和HSP90 mRNA的相对表达水平,提示饲料中高比例的鱼粉蛋白或适宜的鱼粉蛋白与发酵酶解豆粕蛋白配比提高了虾体的免疫力。
鉴于发酵酶解豆粕替代鱼粉对机体免疫系统影响的复杂性,为了进一步了解各组日本沼虾的免疫力,选用对日本沼虾养殖业危害较大的嗜水气单胞菌[43]对各组进行攻毒试验。当发酵酶解豆粕替代鱼粉比例超过50%时,日本沼虾累计死亡率显著增加,该结果印证了高比例的鱼粉蛋白或适宜的鱼粉蛋白与发酵酶解豆粕蛋白配比有助于提高虾体的免疫力,而过高比例的植物蛋白比例会降低虾体免疫力,这可能与发酵酶解豆粕中仍然存在少量的抗营养因子和抗原蛋白有关。
4 结 论
在平衡氨基酸情况下,综合考虑生长和免疫性能,日本沼虾饲料中鱼粉蛋白和发酵酶解豆粕蛋白最佳配比为1∶1。
致谢:
感谢孙凯、陈俊玲、秦苏艳、杨露娜、周云飞和姜盛华等同学的辛勤劳动与付出。
参考文献:
[1] AMAYA E A,DAVIS D A,ROUSE D B.Replace⁃ment of fish meal in practical diets for the Pacific white shrimp(Litopenaeus vannamei)reared under pond conditions[J].Aquaculture,2007,262(2/3/4):393-401.
[2] HARDY R W.Utilization of plant proteins in fish di⁃ets:effects of global demand and supplies of fishmeal [J].Aquaculture Research,2010,41(5):770-776.
[3] GATLINⅢD M,BARROWS F T,BROWN P,et al.Expanding the utilization of sustainable plant products in aquafeeds:a review[J].Aquaculture Research,2007,38(6):551-579.
[4] TRUSHENSKI J T,KASPER C S,KOHLER C C.Challenges and opportunities in finfish nutrition[J].North American Journal of Aquaculture,2006,68 (2):122-140.
[5] FRANCIS G,MAKKAR H P S,BECKER K.Antinut⁃ritional factors present in plant⁃derived alternate fish feed ingredients and their effects in fish[J].Aquacul⁃ture,2001,199(3/4):197-227.
[6] BLAUFUSS P,TRUSHENSKI J.Exploring soy⁃de⁃rived alternatives to fish meal:using soy protein con⁃centrate and soy protein isolate in hybrid striped bass feeds[J].North American Journal of Aquaculture,2012,74(1):8-19.
[7] EGOUNLETY M,AWORH O C.Effect of soaking,dehulling,cooking and fermentation with Rhizopus oli⁃gosporus on the oligosaccharides,trypsin inhibitor,phytic acid and tannins of soybean(Glycine max Merr.),cowpea(Vigna unguiculata L.Walp)and groundbean(Macrotyloma geocarpa Harms)[J].Journal of Food Engineering,2003,56(2/3):249-254.
[8] 范彦令,张士辉.酶解豆粕和发酵豆粕的研究进展[J].今日畜牧兽医,2007(7):55-57.
[9] KIERS J L,MEIJER J C,NOUT M J R,et al.Effect of fermented soya beans on diarrhoea and feed effi⁃ciency in weaned piglets[J].Journal of Applied Mi⁃crobiology,2003,95(3):545-552.
[10] LIU X,FENG J,XU Z R,et al.The effects of fermen⁃ted soybean meal on growth performance and immune characteristics in weaned piglets[J].Turkish Journal of Veterinary and Animal Sciences,2007,31(5):341-345.
[11] BARNES M E,BROWN M L,ROSENTRATER K A,et al.An initial investigation replacing fish meal with a commercial fermented soybean meal product in the diets of juvenile rainbow trout[J].Open Journal of Animal Sciences,2012,2(4):234-243.
[12] YAMAMOTO T,IWASHITA Y,MATSUNARI H,etal.Influence of fermentation conditions for soybean meal in a non⁃fish meal diet on the growth perform⁃ance and physiological condition of rainbow trout On⁃corhynchus mykiss[J].Aquaculture,2010,309(1/2/3/4):173-180.
[13] 罗智,刘永坚,麦康森,等.石斑鱼配合饲料中发酵豆粕和豆粕部分替代白鱼粉的研究[J].水产学报,2004,28(2):175-181.
[14] 候鑫,梁桂英,阳会军,等.杂交罗非鱼饲料中豆粕、发酵豆粕和晶体氨基酸替代鱼粉的研究[J].南方水产,2009,5(2):28-33.
[15] KARDER M A,KOSHIO S,ISHIKAWA M,et al.Can fermented soybean meal and squid by⁃product blend be used as fishmeal replacements for Japanese flounder(Paralichthys olivaceus)?[J].Aquaculture Research,2011,43(10):1427-1438.
[16] ZHOU F,SONG W X,SHAO Q J,et al.Partial re⁃placement of fish meal by fermented soybean meal in diets for black sea bream,Acanthopagrus schlegelii,juveniles[J].Journal of the World Aquaculture Socie⁃ty,2011,42(2):184-197.
[17] 冷向军,王文龙,李小勤.发酵豆粕部分替代鱼粉对凡纳滨对虾的影响[J].粮食与饲料工业,2007(3):40-41.
[18] MEUNPOL O,RUANGPAN L,VALLISUT S.Re⁃placement of soybean meal protein in fish meal diet in organic marine shrimp feed[J].Asian Journal of Food and Agro⁃Industry,2009(Suppl.):S175-S181.
[19] 叶倩.发酵豆粕深度酶解生产低分子大豆多肽[D].硕士学位论文.武汉:华中农业大学,2009.
[20] 刘海燕,闫晓刚,邱玉朗,等.发酵酶解豆粕对小鼠血液抗氧化指标和胃肠道消化酶活性及肠道菌群的影响[J].中国畜牧杂志,2011,47(21):41-44.
[21] 刘海燕,邱玉朗,魏炳栋,等.发酵酶解豆粕对仔猪生长性能、日粮营养物质消化率和血液指标的影响[J].吉林农业大学学报,2012,34(6):655-650,666.
[22] 胡亮,薛敏,王彬,等.晶体氨基酸提高混合动物蛋白替代花鲈饲料中鱼粉的潜力[J].水产学报,2011,35(2):268-275.
[23] FLORETO E A T,BAYER R C,BROWN P B.The effects of soybean⁃based diets,with and without amino acid supplementation,on growth and biochemical composition of juvenile American lobster,Homarus americanus[J].Aquaculture,2000,189(3/4):211-235.
[24] ALAM M S,TESHIMA S,KOSHIO S,et al.Supple⁃ mental effects of coated methionine and/or lysine to soy protein isolate diet for juvenile kuruma shrimp,Marsupenaeus japonicas[J].Aquaculture,2005,248 (1/2/3/4):13-19.
[25] YANG Y,XIE S Q,LEI W,et al.Effect of replace⁃ment of fish meal by meat and bone meal and poultry by⁃product meal in diets on the growth and immune response of Macrobrachium nipponense[J].Fish&Shellfish Immunology,2004,17(2):105-114.
[26] 虞冰如,沈竑.日本沼虾饲料最适蛋白质、脂肪含量及能量蛋白比的研究[J].水产学报,1990,14(4):321-327.
[27] 张凌燕,叶金云,王友慧,等.配合饲料中不同蛋白质水平对日本沼虾生长的影响[J].上海水产大学学报,2008,17(6):668-673.
[28] 秦钦,蔡永祥,陈校辉,等.不同规格日本沼虾饲料蛋白最适含量研究[J].饲料研究,2010(4):53-55.
[29] 胡盼,黄旭雄,郭腾飞,等.玉米蛋白粉部分替代鱼粉对日本沼虾生长和肌肉组成的影响[J].上海海洋大学学报,2011,2(2):230-237.
[30] LONG F,WANG Y X,LIU L,et al.Rapid nongenom⁃ic inhibitory effects of glucocorticoids on phagocytosis and superoxide anion production by macrophages[J].Steroids,2005,70(1):55-61.
[31] 张琴.刺参(Apostichopus japonicus Selenka)高效免疫增强剂的筛选与应用[D].博士学位论文.青岛:中国海洋大学,2010.
[32] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real⁃time quantitative PCR and the 2-△△CTmethod[J].Methods,2001,25(4):402-408.
[33] LUO Z,LI X D,WANG W M,et al.Partial replace⁃ment of fish meal by a mixture of soybean meal and rapeseed meal in practical diets for juvenile Chinese mitten crab Eriocheir sinensis:effects on growth per⁃formance and in vivo digestibility[J].Aquaculture Re⁃search,2011,42(11):1615-1622.
[34] 陈立侨,堵南山,赖伟.中华绒螯蟹蟹种配饵中豆饼替代部分鱼粉的适宜含量[J].水产学报,1994,18 (1):24-31.
[35] 黄峰,严安生,牟松.水产动物饵料诱食剂及其应用[J].中国饲料,1998(14):13-14.
[36] JOHANSSON M W,KEYSER P,SRITUNYALUCK⁃SANA K,et al.Crustacean haemocytes and haemato⁃poiesis[J].Aquaculture,2000,191(1/2/3):45-52.
[37] CHANG C F,SU M S,CHEN H Y.A rapid method to quantify total haemocyte count of Penaeus monodonusing ATP analysis[J].Fish Pathology,1999,34 (4):211-212.
[38] MARER M P,BREHMER D,G SSLER C S,et al.Hsp70 chaperone machines[J].Advances in Protein Chemistry,2001,59(1):1-44.
[39] BOUTET I,TANGUY A,ROUSSEAU S,et al.Mo⁃lecular identification and expression of heat shock cog⁃nate 70(hsc70)and heat shock protein 70(hsp70)genes in the Pacific oyster Crassostrea gigas[J].Cell Stress Chaperones,2003,8(1):76-85.
[40] LI N Q,FU X Z,HAN J G,et al.Molecular cloning and expression of a heat⁃shock cognate 70(hsc70)gene from swordtail fish(Xiphophorus helleri)[J].Chinese Journal of Oceanology and Limnology,2013, 31(4):821-829.
[41] OLSVIK P A,TORSTENSEN B E,HEMRE G I,et al.Hepatic oxidative stress in Atlantic salmon(Salmo salar L.)transferred from a diet based on marine feed ingredients to a diet based on plant ingredients[J].Aquaculture Nutrition,2011,17(2):e424-e436.
[42] HANSEN A C,ROSENLUND G,KARLSEN Ø,et al.The inclusion of plant protein in cod diets,its effects on macronutrient digestibility,gut and liver his⁃tology and heat shock protein transcription[J].Aqua⁃culture Research,2006,37(8):773-784.
[43] 沈锦玉,钱冬,刘问,等.养殖青虾“红鳃病”病原的研究[J].浙江海洋学院学报:自然科学版,2000,19 (3):222-224.
(编辑 菅景颖)
Effects of Different Protein Ratios of Fish Meal to Fermented and Enzymolysis Soybean Meal on Growth and Immune Performance of Oriental River Prawn (Macrobrachium nipponense)
DING Zhili1ZHANG Yixiang1YE Jinyun1∗ZHOU Zhijin2DU Zhenyu3
(1.Zhejiang Provincial Key Laboratory of Aquatic Resources Conservation and Development,Key Laboratory of Aquatic Animal Genetic Breeding and Nutrition,CAFS,College of Life Sciences,Huzhou University,Huzhou 313000,China;2.Huzhou Municipal Fisheries Extension Center,Huzhou 313000,China;3.School of Life Science,East China Normal University,Shanghai 200062,China)
∗Corresponding author,professor,E⁃mail:yjy@hutc.zj.cn
Abstract:This experiment was conducted to evalute the effects of different protein ratios of fish meal to fer⁃mented and enzymolysis soybean meal with microencapsulated amino acid supplementation in diets on growth and immune performance of oriental river prawn(Macrobrachium nipponense).Fermented enzymolysis soy⁃bean meal replaced 0(FM group),25%(R25 group),50%(R50 group),75%(R75 group)and 100%of fish meal(R100 group)(the protein ratios of fish meal to fermented and enzymolysis soybean meal were 1∶0,3∶1,1∶1,1∶3 and 0∶1,respectively)in five isocaloric and isonitrogenous diets,respectively.The oriental river prawn with the average body weight of(0.103 0±0.000 2)g were randomly divided into 5 groups with 5 rep⁃licates in each group and 50 prawns in each replicate.The experiment lasted for 8 weeks.After the feeding ex⁃periment,the prawns were challenged with Aeromonas hydrophila.The results showed that weight gain rate and specific growth rate were the highest when the protein ratio of fish meal to fermented and enzymolysis soy⁃bean meal was 1∶1,and were significantly higher than those in the FM and R100 groups(P<0.05),while no significant difference was observed in survival ratio among all groups(P>0.05).There were no significant differences in the activities of superoxide dismutase(SOD)and glutathione peroxidase(GSH⁃Px)and the con⁃tent of malondialdehyde(MDA)in hepatopancreas among all groups(P>0.05).The total haemocyte count (THC)and haemolymph phagocytic activity in the FM group were significantly higher than those in the R100 group(P<0.05).The hepatopancreas heat shock cognate protein(HSC70)mRNA relative expression level in the FM group was the highest,and significantly higher than that in the other groups(P<0.05),the same of heat shock protein 90(HSP90)in R25 group(P<0.05).Additionally,the cumulative mortality was signifi⁃cantly increased when the ratio of fish meal replacement with fermented and enzymolysis soybean meal was more than 50%after challenged with Aeromonas hydrophila.Therefore,fermented and enzymolysis soybean meal can be an appropriate protein source in the diet of oriental river prawn,and the optimal dietary protein ra⁃tio of fish meal to fermented and enzymolysis soybean meal for oriental river prawn is 1∶1 under the condition of amino acid balance.[Chinese Journal of Animal Nutrition,2015,27(1):154⁃164]
Key words:oriental river prawn(Macrobrachium nipponense);fermented and enzymolysis soybean meal;fish meal;growth performance;immunity
通信作者:∗叶金云,研究员,博士生导师,E⁃mail:yjy@hutc.zj.cn
作者简介:丁志丽(1979—),女,江苏如皋人,讲师,博士,主要从事水产动物营养与饲料研究。E⁃mail:dingzhili@hutc.zj.cn
基金项目:浙江省重大科技专项计划项目(2014C12SA560016);浙江省科技计划项目(2012C12008⁃2);浙江省自然科学基金(LQ14C190004);国家自然科学基金(31402308);上海市农业委员会虾类产业技术体系建设项目
收稿日期:2014-08-13
doi:10.3969/j.issn.1006⁃267x.2015.01.019
文章编号:1006⁃267X(2015)01⁃0154⁃11
文献标识码:A
中图分类号:S963
