水温对水产经济动物棘胸蛙(Paa spinosa)蝌蚪耗氧率、窒息点和排氨率的影响*
2016-01-15刘哲宇朱卫东邹李昶王志铮
杨 程 刘哲宇 朱卫东, 邹李昶 王志铮①
(1. 浙江海洋大学 舟山 316022; 2. 余姚市水产技术推广中心 余姚 315400; 3. 宁波市江北区农林水利局 宁波 315020)
水温作为参与调控水产养殖动物体内酶促反应的重要环境因子, 直接或间接影响着水产养殖动物的新陈代谢。呼吸和排泄作为表征水产养殖动物生存状况和机体能量代谢的重要生理基础, 往往与其所处水温有着极为密切的关系。因此, 探明水温对水产养殖动物呼吸和排泄的影响特征, 无疑对于揭示水产养殖动物的温度耐受与响应机制, 进而指导其科学养殖具重要现实意义。故, 有关水温对水产养殖动物呼吸和排泄的影响研究一直是水产养殖生态学领域的常规命题, 并受到广大水产养殖学家的关注和重视。
棘胸蛙(Paa spinosa)系分布于我国南方丘陵地区的特有大型食用蛙, 素有“山珍”和“百蛙之王”之美誉。蝌蚪期是棘胸蛙生长发育的关键阶段。已有研究表明, 水温对棘胸蛙蝌蚪的孵化、表型生长和变态发育均具重要影响(肖调义等, 2004; 陈雯等, 2010; 赵蒙蒙等, 2014; 陶志英等, 2015)。鉴于此, 为进一步探明棘胸蛙蝌蚪对所处水温的生理应答机制, 明了最适生存水温对其机体代谢活动的生理重要性, 本文作者在探析水温对其行为及尾部皮肤和肝脏相关功能酶活力影响特征(朱卫东等, 2016)的同时, 较系统开展了水温对其呼吸和排泄的影响研究, 旨为该蛙蝌蚪的科学养殖和生理生态研究提供基础资料。
1 材料与方法
1.1 材料
1.1.1 实验动物 本研究所用棘胸蛙蝌蚪的来源、实验前驯养处理以及实验个体的选择要求与规格同朱卫东等(2016)。
1.1.2 实验条件 实验用水为经 48h自然曝气的自 来 水 , 水 温 (24±0.2)°C, pH 7.61±0.04, DO(7.24±0.14)mg/L, 水质符合《NY 5051-2001无公害食品 淡水养殖用水水质》(中华人民共和国农业部,2001)要求。
1.2 实验方法
本研究所涉各项实验均在SPX-250B-2型生化培养箱内进行, 实验水温均依次设 19°C、21.5°C、23°C、24.5°C和26°C等5个梯度, 实验起始时刻均为22:00,实验时均以厚度1cm的液体石蜡(AR级, 购自国药集团化学试剂有限公司)层作为呼吸室绝氧层。分别采用 JPS-605型台式溶解氧测定仪和次溴酸钠氧化法(GB/T12763.4-2007 海洋调查规范第 4部分 海水化学要素调查) 测定水样中的溶解氧和氨氮质量浓度。
耗氧率和排氨率测定实验, 以直径为32cm的白色圆形塑料盆(实验实际容积为3L)为呼吸室, 将实验蝌蚪置于对应实验水温的呼吸室内适应2h后开始实验, 每一实验水温梯度均设3个重复, 每个重复各放入实验蝌蚪10ind。实验周期为24h, 每隔4h用移液管自呼吸室底部吸取15mL水样, 并即刻测定其溶解氧和氨氮质量浓度。实验结束时刻, 用定性滤纸吸尽蝌蚪表面水分后, 用 BAS224S型电子天平(精度为0.1mg)逐一称量各呼吸室内实验蝌蚪的总质量, 并据此计算各呼吸室的耗氧率(OR)和排氨率(NR)。
窒息点测定实验, 以容量为 500mL的容量瓶(实验实际容积为50mL)为呼吸室, 将实验蝌蚪置于对应实验水温的呼吸室后即刻开始实验, 每一实验水温梯度均设6个重复, 每个重复均放入实验蝌蚪4ind。实验期间, 持续观察呼吸室内的蝌蚪存活情况, 并以玻璃棒轻触无反应作为其死亡判别标准, 测定某呼吸室内蝌蚪死亡率为50%时的水体DO值, 即该室蝌蚪的窒息点。
1.3 数据处理
整理实验所得OR、NR测定结果, 分别计算与之相对应的热能效系数式中, OR1、OR2分别为水温T1、T2条件下实验蝌蚪的同时段耗氧率]和氧氮比(O∶N, 呼吸氧原子数与排出氨态氮原子数之比), 并采用 LSD多重比较法分别检验 OR、NR、Q10、O∶N 和窒息点含氧量的组内、组间差异显著性(а<0.05为显著水平), 上述统计分析均借助SPSS 17.0软件来完成。昼、夜区间的统计时段同王志铮等(2013), 分别为6:00—18:00和18:00—翌日6:00。
2 结果
2.1 耗氧率(OR)
由图1可见, 水温对棘胸蛙蝌蚪耗氧率的影响特征主要表现为: (1) 实验蝌蚪各时段耗氧率随水温升高呈单调上升趋势(P<0.05)的水温范围仅为19—23°C, 峰、谷时段均分别为 22:00—2:00和6:00—10:00的水温范围仅为19—24.5°C; (2) 耗氧节律呈夜均>日均>昼均(P<0.05)的水温范围仅为19—23°C, 24.5°C 实验组耗氧率虽呈夜均>昼均(P<0.05), 但日均耗氧率均与其夜均、昼均耗氧率无显著差异(P>0.05), 26°C实验组耗氧率呈夜均≈日均≈昼均(P>0.05)。综上可知, 棘胸蛙蝌蚪表露正常耗氧特征的最适高温为 23°C, 而致其昼夜耗氧节律尚未发生根本性改变的高温临界则为24.5°C。
2.2 热能效系数(Q10)
根据图1所示结果, 计算各温度区Q10值得表1。由表 1可见, 水温对 Q10值的影响特征主要表现为:(1) 各温度区的Q10值昼夜变动特征已发生明显改变,即A区Q10值呈昼均≈夜均(P>0.05), B区呈夜均>昼均(P<0.05), 而 C、D 区则均呈昼均>夜均(P<0.05); (2)日均Q10值对响应水温变动具指示作用, 即各温度区日均 Q10值均与其昼均和夜均 Q10值无显著差异(P>0.05); (3) Q10值随水温升高呈单峰型变动趋势,即昼均 Q10值呈 B≈C>A≈D, 夜均和日均 Q10值均呈B>A≈C≈D。
2.3 排氨率(NR)
由图2可见, 水温对棘胸蛙蝌蚪排氨率的影响特征主要表现为: (1)时段排氨率变化特征与所处水温关系密切, 即水温19—23°C范围内, 各时段(含昼均、夜均和日均)排氨率均随水温升高呈单调上升趋势(P<0.05), 24.5°C实验组排氨率除 0:00—2:00时段显著大于23°C实验组(P<0.05)外, 其余各时段(含昼均、夜均和日均)则均显著小于 23°C 实验组(P<0.05), 而26°C实验组各时段(含昼均、夜均和日均) 排氨率则均显著大于 23°C和 24.5°C 实验组(P<0.05); (2)排氨昼夜节律尚未发生根本性改变, 即各实验组排氨率均呈夜均>昼均(P<0.05), 且日均排氨率均与其夜均、昼均排氨率无显著差异(P>0.05)。综上可知, 在本研究所涉水温范围内, 致棘胸蛙蝌蚪时段排氨率表露异常的实验水温仅为24.5°C。
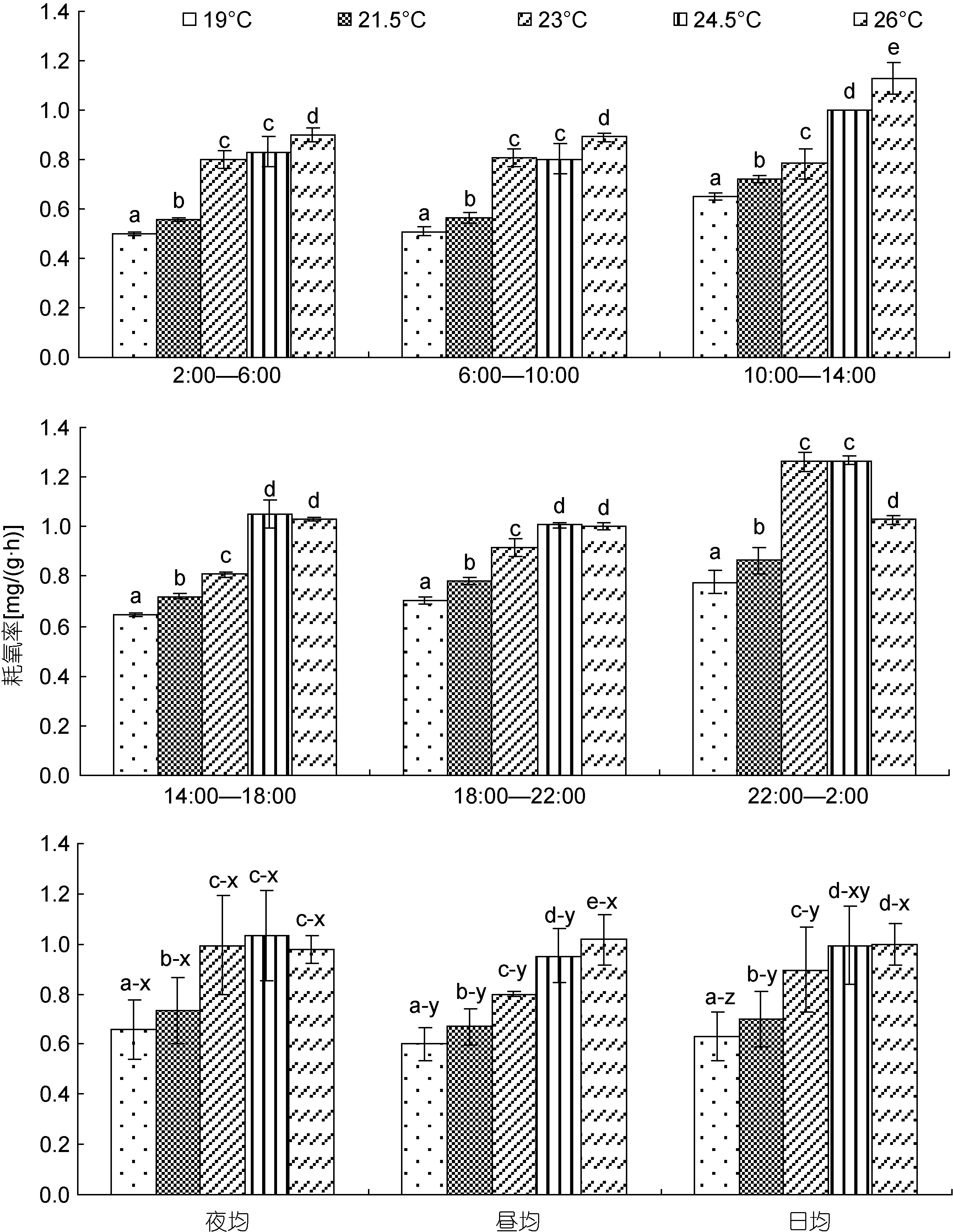
图1 不同水温条件下棘胸蛙蝌蚪耗氧率的变化特征Fig.1 The variation character of oxygen consumption rate of P. spinosa tadpoles in different water temperature

表1 不同水温范围内棘胸蛙蝌蚪Q10值的变动特征Tab.1 The variation character of the Q10 value of P. spinosa tadpoles in different water temperature
2.4 氧氮比(O∶N)
由图3可见, 水温对棘胸蛙蝌蚪O∶N值的影响特征主要表现为: (1) 除23°C、26°C实验组O∶N值分别呈夜均>日均>昼均(P<0.05)和昼均>日均>夜均(P<0.05)外, 其余实验组则均呈昼均≈夜均≈日均(P>0.05); (2) 昼均、夜均及日均O∶N值分别呈24.5°C实验组>19°C 实验组≈21.5°C 实验组>23°C 实验组≈26°C实验组, 24.5°C 实验组>19°C 实验组≈21.5°C 实验组≈23°C 实验组>26°C 实验组, 和 24.5°C 实验组>19°C实验组≈21.5°C 实验组>23°C 实验组>26°C 实验组。
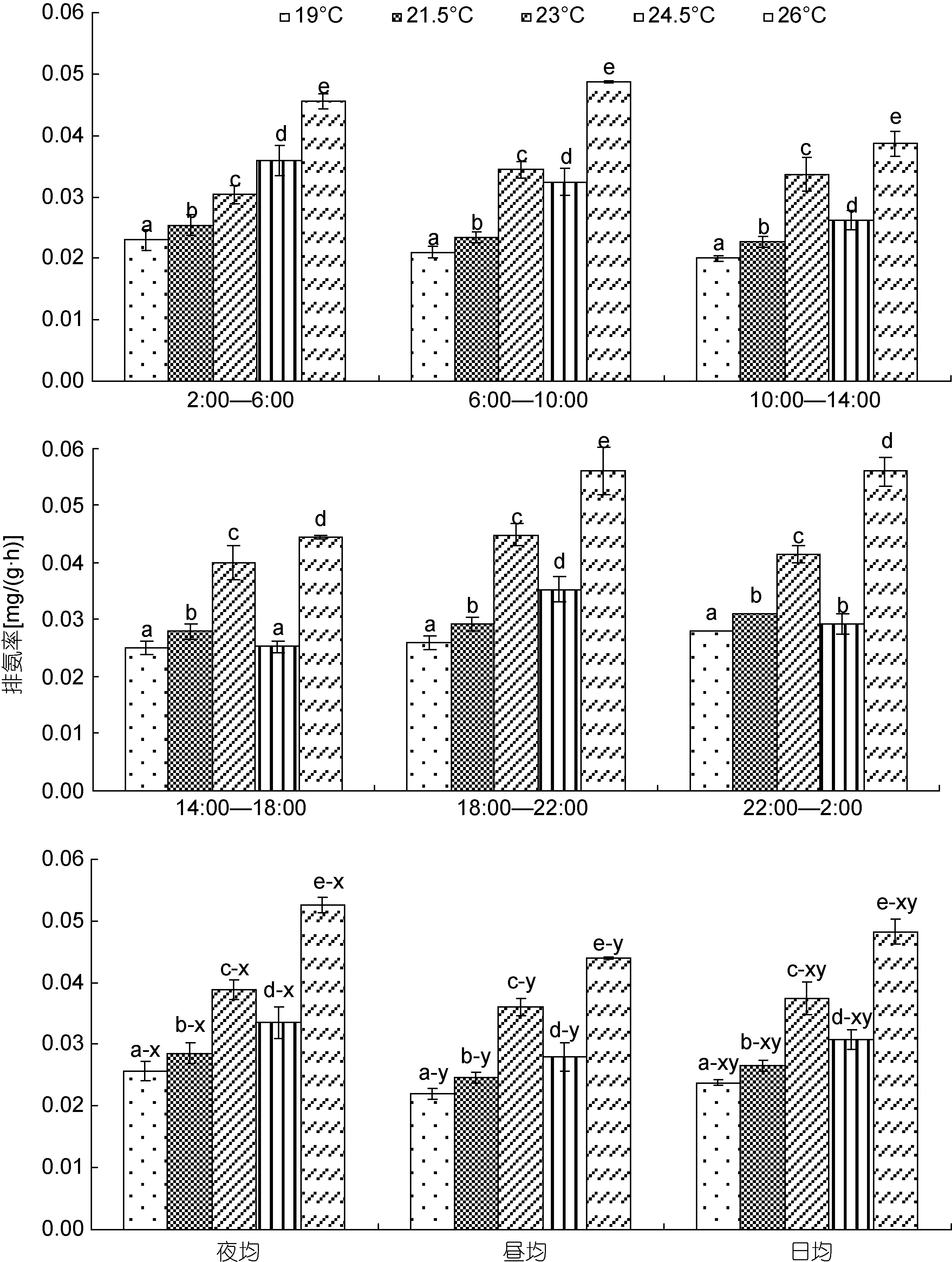
图2 不同水温条件下棘胸蛙蝌蚪排氨率的变化特征Fig.2 The variation character of the ammonia excretion rate of P. spinosa tadpoles in different water temperature
2.5 窒息点
由图 4可见, 棘胸蛙蝌蚪的窒息点含氧量呈19°C 实验组<21.5°C 实验组≈23°C 实验组< 24.5°C 实验组<26°C实验组, 即其窒息点含氧量大体上有随所处水温升高而呈显著增大的趋势, 其中 21.5—23°C为其窒息点含氧量保持相对稳定的温度范围。
3 讨论
3.1 水温对棘胸蛙蝌蚪耗氧率、排氨率和 O∶N的影响
耗氧和排氨系反映水生动物新陈代谢活动的主要标志(王俊等, 2002), 水生动物耗氧率和排氨率所表露的夜间高、白昼低的昼夜变化特征与其昼伏夜出生活习性密切相关(王建钢等, 2010; 孙陆宇等, 2012; 郑侠飞等, 2013; 马学艳等, 2015)。已有研究表明, 温度对水生动物耗氧率和排氨率的影响趋于一致(Aldridge et al, 1995), 在适温范围内其耗氧率和排氨率均表露为随水温升高而增大的趋势(Chen et al, 1996; Schmitt et al, 1996; 张继红等, 2000; 刘凯等, 2010; 刘建忠等, 2013), 当环境温度偏离其适温范围时, 则往往导致其耗氧率和排氨率因机体能量代谢出现一定程度的紊乱而表露异常(张继红等, 2000; 王俊等, 2002; 孙陆宇等,2012; 郑侠飞等, 2013)。因此, 对于正常状态下夜间运动频率明显大于白昼的棘胸蛙蝌蚪而言, 本研究中棘胸蛙蝌蚪耗氧率仅在水温 19—23°C范围内呈夜均>日均>昼均(P<0.05), 且各时段耗氧率和排氨率也仅在该水温范围随水温升高而呈单调上升(P<0.05)的结果(图 1, 2 图), 与 24.5°C 实验组昼夜耗氧节律转为仅呈夜均>昼均(P<0.05) (图1), 且其各时段(含昼均、夜均和日均)排氨率均显著小于23°C实验组的情形(图2), 既进一步印证了23°C为棘胸蛙蝌蚪最适生存水温(朱卫东等, 2016)和最有利于其快速生长水温(陶志英等, 2015)的观点, 也进一步核实了上述关于超过最适高温将导致水生动物耗氧与排氨特征表露异常的可靠性。
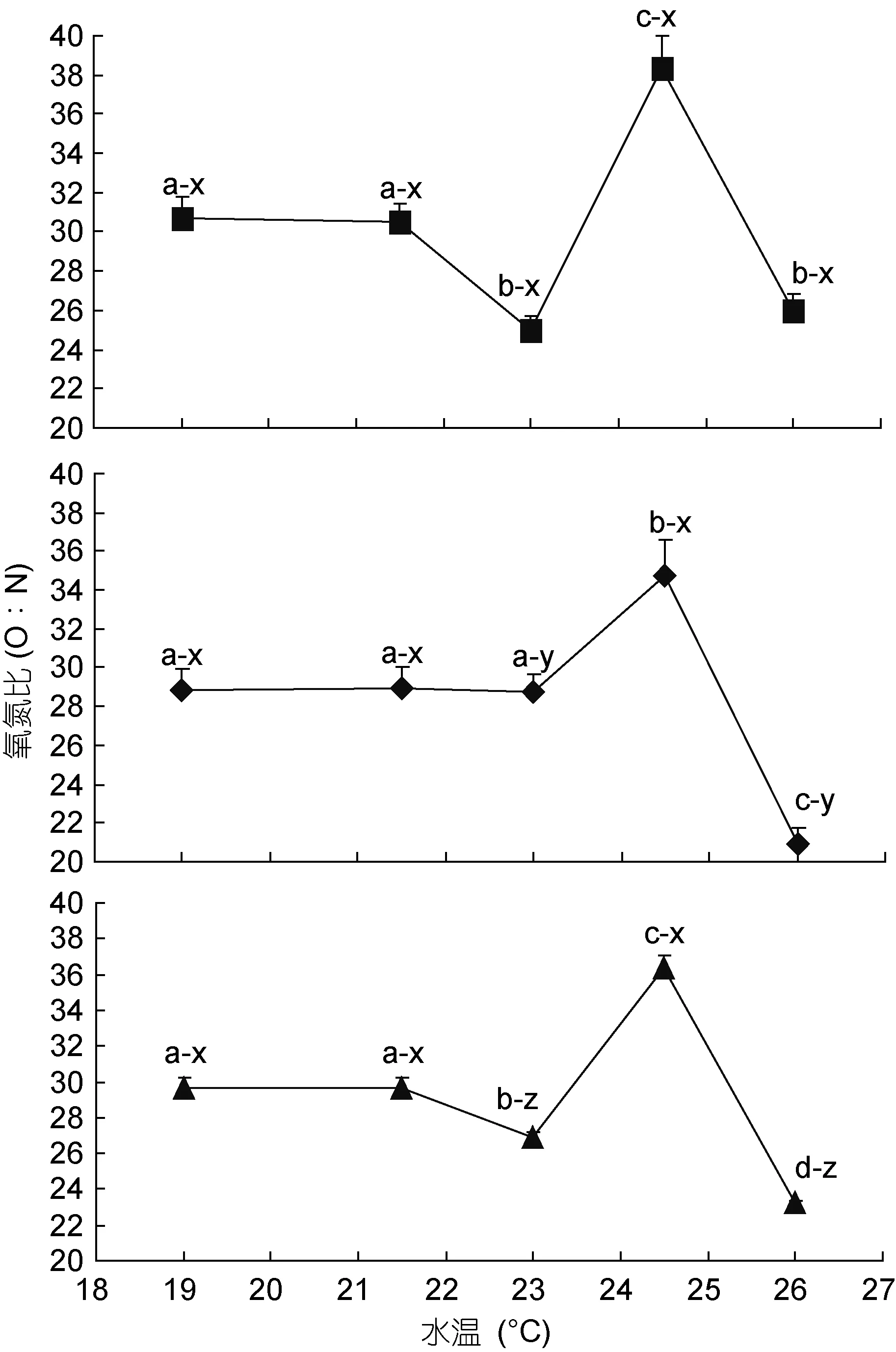
图3 不同水温条件下棘胸蛙蝌蚪氧氮比的变化特征Fig.3 The variation character of the oxygen-nitrogen ratio of P.spinosa tadpoles in different water temperature

图4 不同温度条件下棘胸蛙蝌蚪的窒息点氧含量Fig.4 The oxygen content of the suffocation point of P. spinosa tadpoles in different water temperature
O∶N系反映机体代谢底物利用状况的重要生理指标(Ikeda, 1974; Mayzaud, 1976; Buttle et al,1996)。据报道, 动物完全以蛋白质为代谢底物时的O∶N 取值范围为 3—16, 以等量脂肪和蛋白质为代谢底物时的取值范围为 50—60, 而完全以脂肪和糖类为代谢底物时则为无穷大(Mayzaud et al,1988)。由此, 按图 3所示的 O∶N 取值范围20.92—38.36, 和日均 O∶N 值呈 24.5°C 实验组>23°C 实验组>26°C 实验组(P<0.05)的结果, 并结合棘胸蛙蝌蚪肌肉营养成分中蛋白质含量分别为脂肪、灰分和无氮浸出物的 21.63倍、9.15倍和13.84倍 (舒妙安,2000)的报道, 既可推定蛋白质为棘胸蛙蝌蚪在本研究所涉实验温度范围内的主要代谢底物, 也为阐释其体内脂肪在高温条件下易于被氧化消耗殆尽而造成图 2中 24.5°C实验组日均排氨率显著低于 23°C和 26°C实验组(P<0.05)的原因提供重要的证据支持。Widdows(1978)指出,很多迹象表明O∶N与机体所受的环境压力密切相关, 可作为评估生物对外界环境压力适应程度的一项生理指标。动物的新陈代谢水平往往会随昼夜交替而发生的规律性变化(Childress, 1976;Natarajan, 1989; Rosas et al, 1991)。与棘胸蛙蝌蚪昼夜运动的光周期节律相对应, 其在水温19—24.5°C范围内耗氧率和排氨率均呈夜均>昼均(P<0.05), O∶N 除 23°C 实验组呈夜均>昼均(P<0.05)外, 其它实验组均呈昼均≈夜均(P>0.05),以及26°C实验组耗氧率、排氨率和O∶N分别呈昼均≈夜均(P>0.05)、夜均>昼均(P<0.05)和昼均>夜均(P<0.05)的结果(图 1, 图 2, 图 3), 揭示了 O∶N昼夜变化节律在评判棘胸蛙蝌蚪最适生存温度及其机体能量代谢正常与否上较耗氧率和排氨率更具灵敏性的事实, 故可将其列为评估水生动物新陈代谢活动正常与否的一项重要生理指标。
3.2 水温对Q10值和窒息点的影响
体温决定有机体的代谢强度, Q10虽在所有温度下不是恒值, 但显示了有机体趋向于高温限和低温限的变化(孙儒泳等, 2002), 是表征水生动物对温变敏感程度的一项重要生理指标(Spanopoulos-Hernándeza et al, 2005), 即当环境水温偏离水生动物适温范围时, 将预示着水生动物Q10值的显著改变。与棘胸蛙蝌蚪昼夜运动的光周期节律相对应, 表1中A、B温度区Q10值分别呈昼均≈夜均(P>0.05)和夜均>昼均(P<0.05), 和 C、D温度区均呈昼均>夜均(P<0.05)的结果, 表明棘胸蛙蝌蚪对温变具较强的敏感性, 其中 21.5—23°C为其生存适温范围。据报道, 在耐受温度范围内,Q10最低值往往出现在其适温范围, 而在其适温范围两侧, Q10值则会出现一定程度的升高(Zheng et al, 2008; 刘建忠等, 2013); 但也有研究发现, 超过适宜高温临界会导致其 Q10值的显著下降(王资生等, 2003; 孙陆宇等, 2012), 表明温度对水生动物代谢强度的影响特征, 以及水生动物机体能量代谢对温变的响应机制均具明显的种间差异。鉴于棘胸蛙蝌蚪具借助冬眠来抵御低温以扩增其温度耐受范围的生活习性, 故本研究中B温度区日均Q10值远大于其它温度区(P<0.05)的情形(表 1), 无疑揭示了偏离适温范围是导致棘胸蛙蝌蚪机体能量代谢在低温区明显受抑和高温区易于表露紊乱的主因。
窒息点作为直接反映水生动物耐低氧能力的重要生理指标, 与其所处水温有着极为密切的关系。图4所示窒息点氧含量呈26°C实验组>24.5°C实验组>23°C 实验组≈21.5°C 实验组>19°C 实验组的结果, 表明当环境水温偏离棘胸蛙蝌蚪适温范围时, 其窒息点势必会因机体需氧压力的显著改变而做出相应的调整, 即当水温低于21.5°C时, 因机体能量代谢水平的显著下降(图1, 图2), 致使其耐低氧能力获得显著提升(P<0.05), 而当水温大于23°C时, 则因其机体能量代谢出现一定程度的紊乱(图1, 图2), 而使其耐低氧能力随温度升高呈显著下降的趋势。其实, 图3所示24.5°C实验组脂肪氧化水平显著高企的情形, 也侧面印证了该实验组棘胸蛙蝌蚪耐低氧能力出现显著下滑的原因。Tian等(2004)研究发现, 水生动物具借助调整代谢机制来适应温度变化的代谢补偿现象。由此, 本文作者认为造成21.5°C与23°C实验组窒息点氧含量间无显著差异(图4)的原因, 系23°C实验组棘胸蛙蝌蚪的机体能量代谢水平显著大于 21.5°C实验组(图1, 图2), 与21.5°C实验组因日均O∶N值显著大于23°C实验组(图3)而致使其机体脂肪氧化水平显著高企间相互博弈的结果, 即棘胸蛙蝌蚪在其生存适温范围内具较强的耐低氧保持机制。
据报道, 无尾类蝌蚪约60%的氧源自皮肤吸收(Burggren et al, 1982), 生活于低氧水域中的蝌蚪往往表露出皮肤变薄、毛细血管增多并产生水—血屏障的变化特征(Burggren et al, 1983; Jia et al,1997)。朱卫东等(2016)观察发现, 升温胁迫也会导致棘胸蛙蝌蚪尾部肤色因皮肤变薄和毛细血管的增多而表露显著变亮的趋势。由此, 结合图4中棘胸蛙蝌蚪在水温 21.5—23°C范围内的窒息点氧含量 1.09—1.44mg/L, 均明显大于李加儿等(2014)文中所罗列的鲫(Carassius auratus)、鲻(Mugil cephalus)、鳙(Aristichthys nobilis)等13种常见淡水养殖鱼类在其适温条件下的窒息点氧含量, 以及甲壳动物和鱼类的 Q10值一般为 2—3(Watetrman,1960; 施永海等, 2011), 软体动物中双壳类和腹足类 Q10的取值范围分别为 1.0—2.5和 1.2—4.3, 且大多低于或接近于2.0(Carfoot, 1987), 均明显小于表 1所示棘胸蛙蝌蚪在水温 21.5—23°C范围内的日均 Q10值 5.177的情形, 表明以皮肤呼吸为主的棘胸蛙蝌蚪在适温条件下较上述以鳃为主要呼吸器官的水生动物更具温变敏感性的同时, 还需面临更大的呼吸供氧压力, 即鳃呼吸较皮肤呼吸更具水生适应优势, 这可能也是逼迫和推进两栖类蝌蚪生活史型演变的重要原因之一。
马学艳, 闻海波, 杜兴伟等, 2015. 温度对紫黑翼蚌耗氧率和排氨率及其昼夜变化的影响. 上海海洋大学学报, 24(2):242—248
王 俊, 姜祖辉, 唐启升, 2002. 栉孔扇贝耗氧率和排氨率的研究. 应用生态学报, 13(9): 1157—1160
王志铮, 任夙艺, 赵 晶等, 2013. Zn2+对日本沼虾(Macrobrachium nipponensis)的急性致毒效应. 海洋与湖沼, 44(1):240—246
王建钢, 唐保军, 乔振国等, 2010. 拟穴青蟹幼蟹耗氧率和窒息点的研究. 海洋渔业, 32(3): 345—350
王资生, 彭 斌, 2003. 温度和规格对扁玉螺耗氧率和排氨率的影响. 盐城工学院学报(自然科学版), 16(4): 50—54.
中华人民共和国农业部, 2001. NY 5051-2001无公害食品 淡水养殖用水水质. 北京: 中国标准出版社, 1—5
朱卫东, 任夙艺, 申屠琰等, 2016. 水温对棘胸蛙(Paa spinosa)蝌蚪行为及尾部皮肤和肝脏相关功能酶活力的影响. 海洋与湖沼, 47(1): 245—252
刘 凯, 徐东坡, 段金荣等, 2010. 体质量和水温对太湖秀丽白虾人工驯养子代耗氧率和排氨率的影响. 生态学杂志,29(5): 957—962
刘建忠, 施永海, 邓平平等, 2013. 温度对河川沙塘鳢幼鱼耗氧率和排氨率的影响. 大连海洋大学学报, 28(3):273—276
孙陆宇, 温晓蔓, 禹 娜等, 2012. 温度和盐度对中华圆田螺和铜锈环棱螺标准代谢的影响. 中国水产科学, 19(2):275—282
孙儒泳, 李庆芬, 牛翠娟等, 2002. 基础生态学. 北京: 高等教育出版社, 35
李加儿, 曹守花, 区又君等, 2014. 温度、盐度和pH对鲻幼鱼耗氧率、排氨率以及窒息点的影响. 中国水产科学, 21(5):954—962
肖调义, 赵玉蓉, 章怀云等, 2004. 人工饲养棘胸蛙蝌蚪变态发育的研究. 水利渔业, 24(1): 19—20
张继红, 方建光, 董双林等, 2000. 4种海鞘排泄的初步研究.海洋水产研究, 21(1): 31—36
陈 雯, 俞宝根, 郑荣泉等, 2010. 温度对棘胸蛙胚胎发育及蝌蚪表型特征的影响. 贵州农业科学, 38(1): 108—110
郑侠飞, 王 岩, 2013. 池塘养殖三角帆蚌的耗氧率. 浙江大学学报(农业与生命科学版), 39(4): 460—466
赵蒙蒙, 郑荣泉, 宋婷婷等, 2014. 饲料营养水平和温度对棘胸蛙蝌蚪变态发育的影响. 广东农业科学, 41(20):119—122
施永海, 张根玉, 刘建忠等, 2011. 温 度对暗纹东方 鲀 和菊黄东方 鲀 幼鱼瞬时耗氧速率的影响. 上海海洋大学学报,20(1): 50—55
陶志英, 马保新, 余智杰等, 2015. 环境因子对棘胸蛙蝌蚪生长发育的影响. 湖南农业科学, (2): 55—56, 59
舒妙安, 2000. 棘胸蛙肌肉营养成分的分析(Ⅰ): 一般营养成分的含量及脂肪酸的组成. 浙江大学学报(理学版),27(4):432—437
Aldridge D W, Payne B S, Miller A C et al, 1995. Oxygen consumption, nitrogenous excretion, and filtration rates of Dreissena polymorpha at acclimation temperatures between 20 and 32°C. Canadian Journal of Fisheries and Aquatic Sciences, 52(8): 1761—1767
Burggren W, Mwalukoma A, 1983. Respiration during chronic hypoxia and hyperoxia in larval and adult bullfrogs (Rana catesbeiana). I. Morphological responses of lungs, skin and gills. Journal of Experimental Biology, 105(1): 191—203
Burggren W W, West N H, 1982. Changing respiratory importance of gills, lungs and skin during metamorphosis in the bullfrog rana catesbeiana. Respiratory Physiology, 47(2):151—164
Buttle L G, Uglow R F, Cowx I G, 1996. The effect of emersion and handling on the nitrogen excretion rates of Clarias gariepinus. Journal of Fish Biology, 49(4): 693—701
Carfoot T H, 1987. Animal Energetics. New York: Academic Press, 89—172
Chen J C, Kou T T, 1996. Effects of temperature on oxygen consumption and nitrogenous excretion of juvenile Macrobrachium rosenbergii. Aquaculture, 145(1—4): 295—303
Childress J J, 1976. Effects of pressure, temperature and oxygen on the oxygen consumption rate of the Midwater copepod Gaussia princeps. Marine Biology, 39(1): 19—24
Ikeda T, 1974. Nutritional ecology of marine zooplankton.Memoirs of the Faculty of Fisheries Hokkaido University,22(1): 1—97
Jia X X, Burggren W W, 1997. Developmental changes in chemoreceptive control of gill ventilation in larval bullfrogs(Rana catesbeiana) I. Reflex ventilatory responses to ambient hyperoxia, hypoxia and NaCN. The Journal of Experimental Biology, 200(16): 2229—2236
Mayzaud P, 1976. Respiration and nitrogen excretion of zooplankton. IV. The influence of starvation on the metabolism and biochemical composition of some species.Marine Biology, 37(1): 47—58
Mayzaud P, Conover R J, 1988. O:N atomic ratio as a tool to describe zooplankton metabolism. Marine Ecology Progress Series, 45(3): 289—302
Natarajan P, 1989. Persistent locomotor rhythmicity in the prawns Penaeus indicus and P. monodon. Marine Biology,101(3): 339—346
Rosas C, Vanegas C, Alcaraz G et al, 1991. Effect of eyestalk ablation on oxygen consumption of Callinectes similis exposed to salinity changes. Comparative Biochemistry and Physiology Part A: Physiology, 100(1): 75—80
Schmitt A S C, Uglow R F, 1996. Effects of temperature change rate on nitrogen effluxes of Macrobrachium rosenbergii(DeMan). Aquaculture, 140(4): 373—381
Spanopoulos-Hernández M, Martínez-Palacios C A,Vanegas-Pérez R C et al, 2005. The combined effects of salinity and temperature on the oxygen consumption of juvenile shrimps Litopenaeus stylirostris (Stimpson, 1874).Aquaculture, 244(1—4): 341—348
Tian X L, Dong S L, Wang F et al, 2004. The effects of temperature changes on the oxygen consumption of juvenile Chinese shrimp Fenneropenaeus chinensis Osbeck. Journal of Experimental Marine Biology and Ecology, 310(1):59—72
Watetrman T H, 1960. Respiration in the Physiology of Crustacea. New York: Academic Press, 35—100
Widdows J, 1978. Physiological indices of stress in Mytilus edulis. Journal of the Marine Biological Association of the UK, 58(1): 125—142
Zheng Z M, Jin C H, Li M Y et al, 2008. Effects of temperature and salinity on oxygen consumption and ammonia excretion of juvenile miiuy croaker, Miichthys miiuy (Basilewsky).Aquaculture International, 16(6): 581—589
