Ⅱ型糖尿病猕猴部分靶器官中Th1/Th2型细胞因子表达分析
2016-01-15陈姗姗,罗启慧,曾文等
Ⅱ型糖尿病猕猴部分靶器官中Th1/Th2型细胞因子表达分析
陈姗姗1†, 罗启慧1†, 曾文2, 程安春1,3, 刘文涛1, 史良琴1, 陈正礼1,2*
( 1.四川农业大学动物医学院,动物疾病与人类健康中心四川省重点实验室,四川 雅安625014;2.四川普莱美生物科技有限公司/
国家实验猕猴种源基地,四川 雅安625014;3.四川农业大学预防兽医研究所,成都611130)
摘要检测Ⅱ型糖尿病猕猴部分靶器官中Ⅰ型辅助T细胞(Th1)因子IL-2和IFN-γ以及Ⅱ型辅助T细胞(Th2)因子IL-4、IL-10的表达及分布变化情况,研究Th1/Th2型细胞因子在Ⅱ型糖尿病发病中的变化。取Ⅱ型糖尿病及健康猕猴胰腺、肝、肾和心脏,通过石蜡切片、常规染色观察病理变化,同时采用免疫组织化学SABC法检测各靶器官IL-2、IFN-γ、IL-4和IL-10的表达及分布情况。病理结果显示:糖尿病猕猴肝血窦增宽伴中性粒细胞浸润,肾、心脏和胰腺细胞呈不同程度肿胀、萎缩及坏死。免疫组织化学结果显示:在肾中Th1型细胞因子IFN-γ表达水平高于健康组(P<0.01)并分布于近曲小管、远曲小管及集合管。胰腺中IFN-γ表达水平与健康组相比差异无统计学意义(P>0.05),阳性产物分布于胰岛部及外分泌部。胰腺及肾中Th1型细胞因子IL-2表达水平与健康组相比差异无统计学意义(P>0.05)。胰腺及肾中Th2型细胞因子IL-4表达水平显著低于健康组(P<0.01),阳性产物分布于远曲小管、胰腺胰岛及外分泌部。在胰腺、肾、肝及心脏中,Th2型细胞因子IL-10表达水平显著高于健康组(P<0.01),阳性产物分布于近曲小管、远曲小管、胰腺胰岛、胰腺外分泌部、心肌细胞及肝细胞的胞质中。Th1/Th2型细胞因子在Ⅱ型糖尿病(type 2 diabetes mellitus, T2DM)的发病过程中发生了显著变化。
关键词Th1/Th2; 细胞因子; Ⅱ型糖尿病; 猕猴
中图分类号R 363.21; S 852.35文献标志码A

Expression of Th1/Th2 cytokines in partial target organs of type 2 diabetes mellitus rhesus monkey. Journal of ZhejiangUniversity(Agric. & LifeSci.), 2015,41(3):302-308
Chen Shanshan1†, Luo Qihui1†, Zeng Wen2, Cheng Anchun1,3, Liu Wentao1, Shi Liangqin1, Chen Zhengli1,2*(1.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Ya’an625014,Sichuan,China; 2.SichuanPrimedBiologicalTechnologyCo.,Ltd/NationalExperimentalMacaqueReproduceLaboratory,Ya’an625014,Sichuan,China; 3.InstituteofPreventiveVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China)
SummaryType 2 diabetes mellitus (T2DM) is a disease caused by carbohydrate metabolism disturbance, insulin resistance and reduction of insulin. Many studies confirmed that the disequilibrium of Th1/Th2 cells concerned with T2DM. IL-2 and IFN-γ mediate the growth of Th1 cells which induce cellular immunity. IL-4 and IL-10 are key mediators of Th2 cells which play an important role in humoral immunity. The principal goal of the present research is to detect the changes of Th1/Th2 cytokines in the pathogenesis of T2DM.
Five male healthy rhesus monkeys and five male T2DM rhesus monkeys induced by high-fat diets were used in the study. All rhesus monkeys had been checked without any infections such as bacteria and parasite before trials. After induced for 24 months, the fasting plasma glucose (FPG) mean value of all T2DM rhesus monkeys was higher than 7.0 mmol/L, and that of the control rhesus monkeys was below 6.11 mmol/L. Typical symptoms of type 2 diabetes mellitus were also observed in T2DM rhesus monkeys. The FPG met the WHO and ADA standards for type 2 diabetes mellitus.
Animals were scarified after ketamine anesthesia. Target organs (liver, kidney, heart and pancreas) were fixed in paraformaldehyde, embedded in paraffin and sliced. The pathological changes were studied by hematoxylin-eosin staining, and the expressions of IL-2, IFN-γ, IL-4 and IL-10 were observed by immunohistochemistry. Mean density was measured by IPP 6.0 (Image-pro plus 6.0) to evaluate their variation.
Neutrophil cell infiltration which means chronic inflammation was observed in hepatic sinusoid of T2DM rhesus monkeys, and hepatic sinusoid of T2DM was wider than healthy rhesus monkeys. Different degrees of cellular swell and atrophy as well as necrosis were found in kidney, heart and pancreas. All the tested organs in the study were damaged in the process of T2DM.
IL-2, IL-4 and IFN-γ were only expressed in kidney and pancreas, and IL-10 was expressed in all the four organs. IL-2 was only expressed in langerhans islet and kidney tubules, but IFN-γ, IL-4 and IL-10 were expressed in endocrine and exocrine pancreas, kidney tubules. IL-10 was also expressed in hepatic and myocardial cell. The expression of IFN-γ and IL-10 were significantly increased (P<0.01), but IL-4 was decreased oppositely (P<0.01). The expression of IL-2 in pancreas and kidney had no difference between T2DM and health rhesus monkeys (P>0.05).
In conclusion, IL-2, Th1 cytokines, has no significant change, but IFN-γ of Th1 cell is expressed higher in T2DM. Simultaneously, IL-4 and IL-10, Th2 cytokines, change oppositely. Inflammation exists in the process of T2DM. Difference distribution and level of Th1/Th2 cytokines between T2DM and health rhesus monkeys show that Th1/Th2 cell disequilibrium is key mediators in T2DM. According to the complex changes of cytokines of Th1/Th2 cells, it needs further researches to define the relationship of Th1/Th2 balance with T2DM.
Key wordsTh1/Th2; cytokines; type 2 diabetes mellitus; rhesus monkey
Ⅱ型糖尿病(type 2 diabetes mellitus, T2DM)是一种由环境、遗传等多因素引起的,以胰岛素分泌缺陷和胰岛素抵抗为特征的代谢性综合征。免疫功能紊乱是Ⅱ型糖尿病发病的重要原因,Marques-Vidal等[1]研究发现,T2DM病人外周血液中部分细胞因子水平较高。大量研究[2-4]证实,T2DM动物及人外周血液中细胞因子水平发生了不同的变化。其中大部分细胞因子由Th1或Th2细胞分泌,而Th1/Th2平衡失调与许多疾病的发生密切相关.Ⅰ型糖尿病和糖尿病视网膜病均存在Th1/Th2向Th1亚群转化的现象[5-7],提示Th1/Th2平衡失调可能是导致T2DM发生的重要因素。不少关于糖尿病及相关并发症治疗的报道,均观察到Th1/Th2平衡失调有所缓解[6,8-11]。Th1细胞以分泌IL-2、IFN-γ为主,介导细胞免疫反应;Th2细胞以分泌IL-4、IL-10为主,介导体液免疫反应。未见细胞免疫及体液免疫在T2DM发病进程中的关系及T2DM发病过程中是否存在Th1/Th2平衡漂移的报道,因此T2DM是否存在Th1/Th2平衡漂移具有非常重要的研究价值。
目前,缺乏以猕猴T2DM模型为研究对象的相关报道。因此本实验通过饲喂高脂饲料,建立川西亚种猕猴T2DM模型。该模型具有血糖规律、病理特征与在人类糖尿病患者中观察到的临床特征较为相似的优势,避免了药物造模过程中毒副作用强、稳定性差的问题,能真正很好地模拟人类糖尿病发展的长期缓慢进程及由此引起的全身机体变化的问题,科学性较强。在模型建立成功的基础上,对T2DM动物部分靶器官组织病变,以及Th1细胞分泌的IL-2、IFN-γ,Th2细胞分泌的IL-4、IL-10表达及分布进行观察,探讨T2DM是否存在Th1/Th2平衡漂移,以期为该疾病的治疗提供新思路。
1材料与方法
1.1材料
1.1.1实验动物5只通过高脂饮食诱导建立的川西亚种猕猴T2DM模型,5只健康川西亚种猕猴(猕猴在实验前检疫合格,内容包括:体检,2次结核杆菌试验,寄生虫、沙门菌、致贺氏菌和B病毒检查;猕猴单只饲喂,解剖前无外伤)均由四川农业大学实验动物工程技术中心/国家实验猕猴种源基地提供[动物使用许可证为SCXK(川):2013-105]。
T2DM川西亚种猕猴模型符合美国糖尿病学会(ADA)和世界卫生组织(WHO)2006年糖尿病诊断标准:典型糖尿病症状(多尿、多饮和体质量下降),空腹血糖(fasting plasma glucose,FPG)≥7.0 mmol/L或餐后2 h血糖(2hPG)≥11.1 mmol/L,为糖尿病;7.77 mmol/L <2hPG<11.1 mmol/L时为糖耐量损伤(impaired glucose tolerance,IGT),6.11 mmol/L≤FPG<6.99 mmol/L时为空腹血糖损伤(impaired fasting glucose,IFG),FPG<6.11 mmol/L且2hPG<7.77 mmol/L,为正常,具体指标及空腹血糖变化情况(表1)参见本课题组已有文献[12-13]报道。实验中对动物的处置符合中华人民共和国科学技术部《关于善待实验动物的指导性意见》的规定。
1.1.2仪器设备石蜡切片机(日本Leica公司),CH20BIMF200光学显微镜(日本Olympus公司),Nikon50i-BF生物数码显微镜(日本Nikon光学株式会社),冰箱,恒温培养箱等。
1.1.3主要试剂IL-2、IL-10兔抗人多克隆抗体,即用型SABC试剂盒(组成:5% BSA、生物素标志的山羊抗兔IgG和SABC),DAB显色试剂盒,多聚赖氨酸均购自武汉博士德生物工程有限公司;IL-4、IFN-γ兔抗人多克隆抗体购自北京博奥森生物技术有限公司;0.01 mol/L pH 6.0柠檬酸缓冲液;0.02 mol/L pH 7.2磷酸盐缓冲液(phosphate buffered saline,PBS)。
1.2方法
1.2.1实验动物处理于高脂饲料诱导前和诱导后第2、3、5、7、10、11、12、15、16、18、19、20、22和24月,禁食16 h,从后肢股静脉采血,分析空腹血糖(FPG)浓度。
高脂饮食诱导24个月后,用氯胺酮麻醉动物,经颈动脉放血将动物处死并解剖。取出肝、胰腺、肾、心脏固定于4%多聚甲醛中24~48 h。
1.2.2石蜡切片制作及常规染色取材冲水24 h后用于常规石蜡组织包埋,玻片经多聚赖氨酸处理后,连续切片,厚为5 μm,每个样品切21张备用,并进行常规苏木精-伊红法(hematoxylin-eosin,HE)染色。
1.2.3免疫组织化学SABC法切片脱蜡至水后,用柠檬酸缓冲液微波抗原修复,4次,间隔6 min,PBS洗3次;3% H2O2室温孵育50 min,蒸馏水洗3次,PBS洗1次;5% BSA,37 ℃孵育50 min;IL-2、IL-4、IL-10和IFN-γ兔多克隆抗体稀释液(1∶200),4 ℃孵育过夜,室温复温30 min后,PBS洗4次;生物素化山羊抗兔IgG,37 ℃孵育40 min,PBS洗3次;SABC,37 ℃孵育20 min,PBS洗3次,蒸馏水洗1次;DAB蓝色显色液显色,脱水、透明、封片。

2结果与分析
2.1空腹血糖浓度变化及主要病理变化
10只猕猴空腹血糖浓度变化详见表1,可见经过24个月高脂饮食诱导后,T2DM组猕猴空腹血糖平均水平已超过7.0 mmol/L,符合WHO和ADA公布的糖尿病判断标准。

表1 高脂膳食诱导对川西亚种猕猴空腹血糖的影响
T2DM组肝、肾、胰腺及心脏发生了不同程度的炎性反应。肝:肝血窦增宽伴大量中性粒细胞浸润,肝细胞肿胀,部分细胞核浓缩坏死。肾:肾小球萎缩,肾小管上皮细胞核浓缩,重度肿胀伴坏死脱落,部分区域可见大量上皮细胞管型。心脏:心肌细胞萎缩,间质增宽且成分增多。胰腺:胰岛细胞中度到重度肿胀、空泡变性,局部细胞溶解坏死,外分泌部细胞核浓缩,细胞萎缩,腺管结构不清晰(图1).
2.2免疫组织化学染色结果
从图2~5可以看出,免疫组织化学染色阳性反应呈蓝黑色。IL-10在心肌、肾、肝、胰腺中有表达,IL-2、IL-4、IFN-γ只在肾和胰腺中有表达。与健康猕猴相比,T2DM模型猕猴胰腺中IL-4表达水平显著降低(P<0.01),IL-10显著升高(P<0.01),而IFN-γ表达差异无统计学意义(P>0.05),三者于胰岛部及外分泌部均有表达。肾中,IL-4分布于远曲小管且表达水平显著降低(P<0.01),IL-10分布于近曲小管且表达水平显著升高(P<0.01),而IFN-γ分布于近曲小管、远曲小管及集合管且表达水平显著增强(P<0.01)。与胰腺和肾表达水平相似,心脏及肝中IL-10的表达也显著升高(P<0.01)。同时,IL-2在健康组和糖尿病组间差异无统计学意义(P>0.05),仅表达于胰腺胰岛外周、肾近曲小管、远曲小管及集合管。

图1 糖尿病猕猴肝、肾、心和胰腺病理变化 Fig.1 Pathological changes of liver, kidney, heart and pancreas in T2DM rhesus monkey

**表示在0.01水平差异有高度统计学意义。 Double asterisk (**) indicate statistically highly significant difference at the 0.01 probability level。 图2 IFN-γ、IL-2、IL-4和IL-10在Ⅱ型糖尿病猕猴靶器官阳性产物中的平均吸光度 Fig.2 Mean density of IFN-γ, IL-2, IL-4 and IL-10 positive staining in target organ of T2DM rhesus monkey

图3 IFN-γ、IL-2、IL-4和IL-10在胰腺的表达分布 Fig.3 Expression and distribution of IFN-γ, IL-2, IL-4 and IL-10 in pancreas of T2DM rhesus monkey
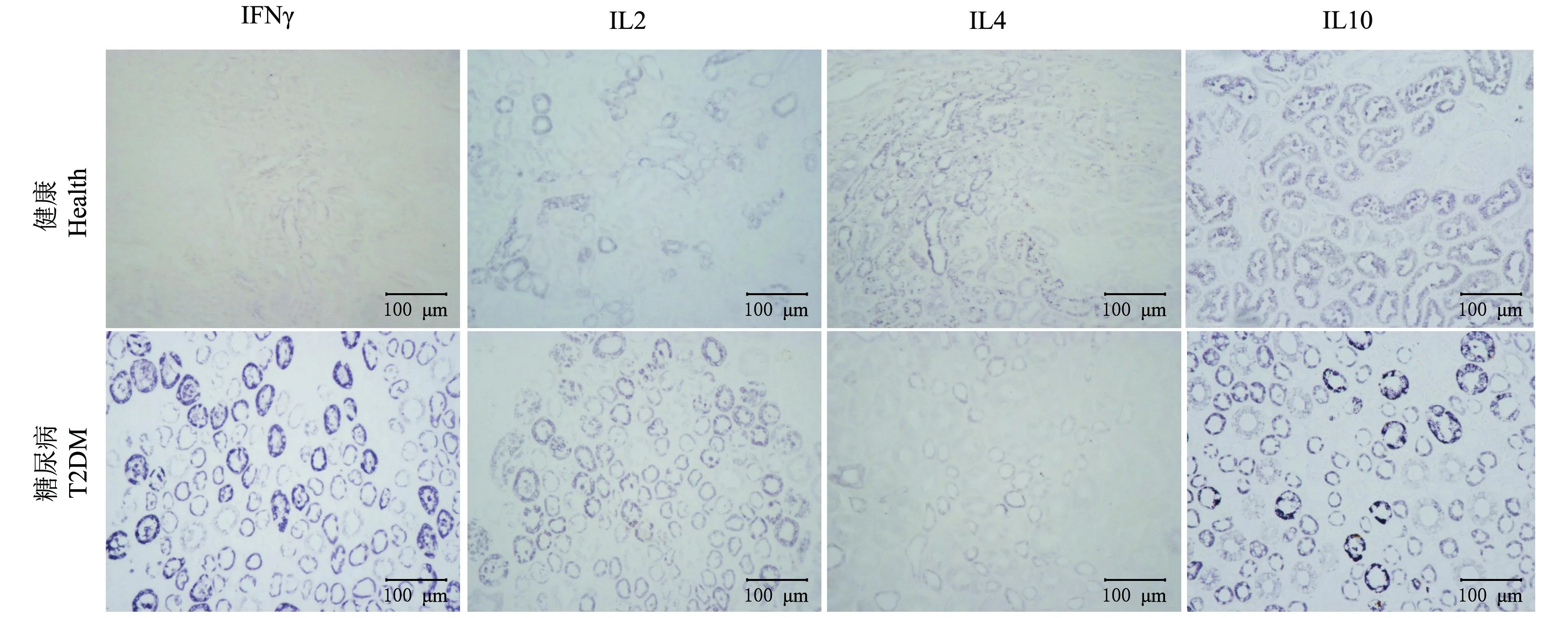
图4 IFN-γ、IL-2、IL-4和IL-10在肾的表达分布 Fig.4 Expression and distribution of IFN-γ, IL-2, IL-4 and IL-10 in kidney of T2DM rhesus monkey

图5 IL-10在肝和心的表达分布 Fig.5 Expression and distribution of IL-10 in liver and heart of T2DM rhesus monkey
3讨论
大量研究表明,Th1/Th2平衡失调与肥胖诱导的糖尿病及其并发症发生关系密切,是许多疾病的重要致病因素[14]。T2DM的主要致病机制是胰岛素抵抗与胰岛素分泌受损,免疫功能低下是胰岛素抵抗发生的关键因素。病理结果显示T2DM靶器官发生了不同程度炎性反应,这与体内细胞因子表达分布变化密切相关。同时,肝、心脏、肾及胰腺细胞肿胀坏死的现象证实它们是T2DM发病过程中受损的靶器官。
干细胞移植治疗T2DM后,发现炎性细胞因子水平降低,且T2DM免疫功能缺陷得到了恢复[15]。用混合营养物质治疗STZ小鼠糖尿病模型后,检测到Th1细胞因子水平下降,而Th2细胞因子IL-10水平升高[16]。这些研究证明,Th1/Th2型细胞因子在糖尿病发病或治疗过程中发生了显著变化,与糖尿病关系密切。Cheng等[17]在使用富胍免疫抑制性寡核苷酸治疗膳食诱导肥胖小鼠后,降低了胰岛素抵抗反应,这是通过调节Th1/Th2平衡来达到的。因此,在T2DM发病过程中Th1/Th2型细胞因子的变化值得关注。本实验结果发现肝、肾、心肌及胰腺细胞的胞质IFN-γ、IL-4、IL-10水平发生了变化。其中,IFN-γ表达升高与Mahmoud等[3]在对T2DM患者外周血液中T淋巴细胞因子的研究结果一致;同时,IL-10表达水平升高与Zhang等[18]对Ⅱ型糖尿病肾病患者血浆IL-10研究所得结果一致,Al-Shukaili等[19]对T2DM患者的血液学研究也得到了同样的结果,但是该研究未发现T细胞亚群发生变化。
IFN-γ可促进M1巨噬细胞分化,导致促炎性细胞因子产生,加重炎性反应。IL-4可诱导M2巨噬细胞分化,产生抗感染性细胞因子[20]。本研究结果发现,在T2DM的发病过程中IL-4表达减弱,说明机体抗感染效应减弱,即炎性反应加强。同时,从各细胞因子在不同靶器官的分布差异可推断出,细胞因子是通过血液运输到各靶器官参与炎性反应的。
众所周知,Th1细胞以分泌IL-2、IFN-γ为主,Th2细胞以分泌IL-4、IL-10为主。从分泌变化的角度来看,Th1细胞分泌的IFN-γ增多,而IL-2不变,可表现为Th1细胞增多或功能增强。同样,Th2细胞分泌的IL-10增多,而IL-4减少,与Th1 2个细胞因子变化相比较,可知Th1细胞亚群增殖强于Th2细胞。另外,IFN-γ与IL-4存在相互拮抗的关系,两者平衡可影响Th1/Th2细胞亚群分化[21]。已知IFN-γ可促进Th1细胞增殖,也可抑制IL-4对B细胞分化的促进作用。同时,IL-4可抑制Th1细胞增殖来拮抗IFN-γ。本研究结果中T2DM组Th1细胞因子IFN-γ表达较健康组高,说明Th1细胞增殖作用加强;同时Th2细胞因子IL-4表达减弱,说明其促B细胞分化抑制Th1细胞增殖的作用减弱,从而可推断出Th1细胞亚群的增殖强于Th2细胞。
通过本实验可确定的是T2DM猕猴体内Th1细胞亚群增殖加强,而IL-4的降低可能会抵消IL-10升高所代表的Th2细胞增殖现象,因此无法确定Th2细胞亚群的变化。可见,Th1/Th2亚群变化与T2DM的发生关系密切,但两者因果关系需要进一步实验证明。由于细胞因子间的作用太过复杂,仅通过细胞因子的变化来研究Th1/Th2平衡变化在T2DM发病过程中的作用还远远不够,后续工作可考虑检测CD4、CD8及CD3的比值来探讨在T2DM发病过程中Th1/Th2平衡的变化方向。
总之,本实验通过对T2DM猕猴部分靶器官中IFN-γ、IL-2、IL-10、IL-4的表达研究发现,Th1/Th2型细胞因子表达水平发生了不同变化。Th1细胞因子IL-2表达水平无显著变化,而IFN-γ表达水平升高;Th2细胞因子IL-4水平降低,而IL-10水平升高。Th1/Th2的显著变化表明其相关因子与T2DM的发病进程密切相关。
参考文献(References):
[1]Marques-Vidal P, Schmid R, Bochud M,etal. Adipocytokines, hepatic and inflammatory biomarkers and incidence of type 2 diabetes. the CoLaus study.PloSONE, 2012,7(12):e51768.
[2]Costantini S, Capone F, Guerriero E,etal. Cytokinome profile of patients with type 2 diabetes and/or chronic hepatitis C infection.PloSONE, 2012,7(6):e39486.
[4]Badawi A, Klip A, Haddad P,etal. Type 2 diabetes mellitus and inflammation: Prospects for biomarkers of risk and nutritional intervention.Diabetes,MetabolicSyndromeandObesity:TargetsandTherapy, 2010,3:173-186.
[5]顾国浩,彭群新.Th1/Th2细胞的免疫功能变化及其意义.国外医学:临床生物化学与检验学分册,2003,24(6):333-334.
Gu G H, Peng Q X. Immune function changes and significance of Th1/Th2 cells.ForeignMedicalSciences:SectionofClinicalBiochemistryandLaboratoryMedicine, 2003,24(6):333-334. (in Chinese)
[6]Hassan G A, Sliem H A, Ellethy A T,etal. Role of immune system modulation in prevention of type 1 diabetes mellitus.IndianJournalofEndocrinologyandMetabolism, 2012,16(6):904-909.
[7]Liu J, Shi B, He S,etal. Changes to tear cytokines of type 2 diabetic patients with or without retinopathy.MolecularVision, 2010,16:2931-2938.
[8]Groen B, Links T P, Lefrandt J D,etal. Aberrant pregnancy adaptations in the peripheral immune response in type 1 diabetes: A rat model.PloSONE, 2013,8(6):e65490.
[5]李启成.清末比附援引与罪刑法定存废之争——以《刑律草案签注》为中心[J].中国社会科学,2013,(11):104-120.
[9]Zhang C L, Gui L, Xu Y J,etal. Preventive effects of andrographolide on the development of diabetes in autoimmune diabetic NOD mice by inducing immune tolerance.InternationalImmunopharmacology, 2013,16(4):451-456.
[10]Ezquer F, Ezquer M, Contador D,etal. The antidiabetic effect of mesenchymal stem cells is unrelated to their transdifferentiation potential but to their capability to restore Th1/Th2 balance and to modify the pancreatic microenvironment.StemCells, 2012,30(8):1664-1674.
[11]Chatzigeorgiou A, Harokopos V, Mylona-Karagianni C,etal. The pattern of inflammatory/anti-inflammatory cytokines and chemokines in type 1 diabetic patients over time.AnnalsofMedicine:Helsinki, 2010,42(6):426-438.
[12]曾文.恒河猴川西亚种生物学特性背景数据建立及在新药评估中的应用研究.雅安,四川:四川农业大学,2010.
Zeng W. Establishment of a biological background database of a subspecies of rhesus monkey (Macacamulattalasiotis) and its application in new drug evaluation. Ya’an, Sichuan: Sichuan Agriculture University, 2010. (in Chinese with English abstract)
[13]Gong L, Zeng W, Yang Z,etal. Comparison of the clinical manifestations of type 2 diabetes mellitus between rhesus monkey (Macacamulattalasiotis) and human being.Pancreas, 2013,42(3):537-542.
[14]姚金晶,陈宜涛.Th1/Th2平衡调节与疾病发生的研究进展.现代生物医学进展,2009,9(13):2597-2600.
Yao J J, Chen Y T. Advances of regulation Th1/Th2 type cytokines balance in human disease。ProgressinModernBiomedicine, 2009,9(13):2597-2600. (in Chinese with English abstract)
[15]Zhao Y, Jiang Z, Zhao T,etal. Targeting insulin resistance in type 2 diabetes via immune modulation of cord blood-derived multipotent stem cells (CB-SCs) in stem cell educator therapy: Phase Ⅰ/Ⅱ clinical trial.BMCMedicine, 2013,11:160.
[16]Chang Y, Zhang G Z, Piao S L,etal. Protective effects of combined micronutrients on islet beta-cells of streptozotocin-induced diabetic mice.InternationalJournalforVitaminandNutritionResearch, 2009,79(2):104-116.
[17]Cheng X, Wang J, Xia N,etal. A guanidine-rich regulatory oligodeoxynucleotide improves type-2 diabetes in obese mice by blocking T-cell differentiation.EMBOMolecularMedicine, 2012,4(10):1112-1125.
[18]Zhang C, Xiao C, Wang P,etal. The alteration of Th1/Th2/Th17/Treg paradigm in patients with type 2 diabetes mellitus: Relationship with diabetic nephropathy.HumanImmunology, 2014,75(4):289-296.
[19]Al-Shukaili A, Al-Ghafri S, Al-Marhoobi S,etal. Analysis of inflammatory mediators in type 2 diabetes patients.InternationalJournalofEndocrinology, 2013,2013:976810.
[20]Winer S, Winer D A. The adaptive immune system as a fundamental regulator of adipose tissue inflammation and insulin resistance.ImmunologyandCellBiology, 2012,90(8):755-762.
[21]Pernis A, Gupta S, Gollob K J,etal. Lack of interferon gamma receptor beta chain and the prevention of interferon gamma signaling in TH1 cells.Science, 1995,269(5221):245-247.
