新疆维吾尔族HPV16感染的中晚期宫颈癌妇女HLA-DRB1及HLA-DQB1基因多态性和细胞因子相关性研究
2016-01-14李亚伟,古丽娜·库尔班,谭遥等
新疆维吾尔族HPV16感染的中晚期宫颈癌妇女HLA-DRB1及HLA-DQB1基因多态性和细胞因子相关性研究
李亚伟1, 古丽娜·库尔班1, 谭遥1, 王若峥1,2
(新疆医科大学1附属肿瘤医院放疗中心,2新疆肿瘤学重点实验室, 乌鲁木齐830011)
摘要:目的探讨新疆维吾尔族妇女HPV16感染的中晚期宫颈癌HLA-DRB1和HLA-DQB1的等位基因分布及其与IFN-γ、IL-2、IL-6、IL-10的关联性。方法采集经新疆医科大学附属肿瘤医院病理科明确诊断为宫颈癌Ⅱb~Ⅳb期39例患者治疗前的血标本(宫颈癌组),同时采集居住在新疆地区健康女性50例血标本(健康对照组)。测定HLA-DRB1和HLA-DQB1基因亚组分型,并检测细胞因子IFN-γ、IL-2、IL-6、IL-10的水平。对比不同临床分期患者与健康对照组细胞因子的差异;根据患者HLA-DRB1和HLA-DQB1基因亚组分组,比较不同基因亚组间细胞因子水平的差异。结果检出HLA-DRB1等位基因8个,检出HLA-DQB1等位基因4个,其中HLA-DRB1*07、HLA-DQB1*02、HLA-DQB1*03在新疆维吾尔族HPV16感染的中晚期宫颈癌组的构成比分别为44.74%、56.41%、35.90%;健康对照组与维吾尔族HPV16感染Ⅱb和Ⅲb期宫颈癌组IFN-γ、IL-2、IL-6、IL-10水平差异均有统计学意义(P<0.05);单因素方差分析显示各HLA-DRB1、HLA-DQB1等位基因之间IFN-γ、IL-2、IL-6、IL-10水平差异均无统计学意义。结论HLA-DRB1*07、HLA-DQB1*02、HLA-DQB1*03为新疆维吾尔族HPV16感染的中晚期宫颈癌优势表达基因; IFN-γ、IL-2、IL-6、IL-10与宫颈癌的发生、发展可能存在关联性。
关键词:宫颈癌; 人类白细胞抗原; 细胞因子
中图分类号:R737.33文献标识码:A
doi:10.3969/j.issn.1009-5551.2015.01.007
[收稿日期:2014-10-21]
基金项目:国家自然科学基金(81273873)
作者简介:朱明(1960-),女,硕士,高级实验师,研究方向:感染免疫。
The correlation between Human leukocyte antigen and cytokines in HPV16
infected Xinjiang Uyghur women in advanced cervical cancer
LI Yawei1, Gulina Kuerban1,TAN Yao1, WANG Ruozheng1,2
(1DepartmentofRadiationOncology,AffiliatedTumorHospital,2KeyLaboratoryofOncology,
XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo analyze the distribution of HLA-DRB1 and -DQB1alleles in HPV16 infected Xinjiang Uygur women in advanced cervical carcinoma, and to investigate the correlation between HLA-DRB1, -DQB1 and IFN-γ, interleukin-2 (IL-2), interleukin-6 (IL-6), interleukin-10 (IL-10) in patients with cervical cancer. MethodsWe collected 39 blood samples of cervical carcinoma patients diagnosed by pathology as cervical cancer in stage Ⅱb-Ⅳb before the treatment in our hospital, and we gathered 50 blood samples of healthy women living in Xingjiang. We determined the genetic subtypes of HLA-DRB1 and HLA-DQB1, and we measured the concentration of IFN-γ, interleukin-2 (IL-2), interleukin-6 (IL-6), interleukin-10 (IL-10). We had a comparison of the difference of cytokines between patients with different clinical stages and healthy control group. According to genetic subtypes of HLA-DRB1 and HLA-DQB1, we also had a comparison of the concentration of cytokine (CK) in different genetic subtypes. ResultsEight HLA-DRB1 alleles and four HLA-DQB1 alleles were found, the rates of HLA-DRB1*07, HLA-DQB1*02 and HLA-DQB1*03 were 44.74%, 56.41% and 35.90% respectively. We had a comparison of concentration of IFN-γ, interleukin-2 (IL-2), interleukin-6 (IL-6), interleukin-10 (IL-10) between healthy control group and HPV16 infected Xinjiang Uygur patients in advanced cervical cancer with stage Ⅱb-Ⅲb group, there were statistical significances (P>0.05). Single factor analysis of variance indicated that the difference of concentration of IFN-γ, IL-2, IL-6, IL-10 showed no statistical significance. ConclusionHLA-DRB1*07, HLA-DQB1*02 and HLA-DQB1*03 were the gene of dominant expression in HPV16 infected Xinjiang Uygur patients in advanced cervical cancer. There may be a correlation between the occurrence, development of cervical cancer and IFN-γ, IL-2, IL-6, IL-10.
Key words: cervical cancer; human leukocyte antigen; cytokine; interleukin; interferon
宫颈癌(cervical cancer)是女性生殖系统最常见的恶性肿瘤,仅次于乳腺癌,成为全球导致妇女死亡的第二大恶性疾病[1]。在我国,宫颈癌的患病率和病死率约占全世界的1/3[2]。新疆是我国宫颈癌高发区之一,其中新疆维吾尔族宫颈癌患病率及死亡率分别为459~526/10 万和15.78/50万,远高于新疆地区汉族、哈萨克族、蒙古族等其他民族[2-4]。人类白细胞抗原(human leukocyte antigen,HLA)与宫颈癌发生有关,尤其是HLA II类基因的DRB1、DQB1与宫颈鳞癌的发生密切相关[5-6]。已有研究报道,细胞因子(cytokines,CK)在宫颈癌发生、发展中起着重要作用[7-9]。本研究分析新疆维吾尔族妇女HPV16感染的中晚期宫颈癌HLA-DRB1和HLA-DQB1的等位基因分布,对比不同临床分期患者和健康人群细胞因子的水平,探讨宫颈癌患者HLA-DRB1和HLA-DQB1各等位基因分布及其与IFN-γ、IL-2、IL-6、IL-10的关联性。
1资料与方法
1.1一般资料选择2012年1月-2014年6月新疆医科大学附属肿瘤医院收治的HPV16感染的维吾尔族中晚期宫颈癌患者39例(宫颈癌组)。年龄40~68 岁,中位年龄55 岁。宫颈癌分期(根据FIGO分期标准):Ⅱb期18例,Ⅲb期17例,Ⅲa期1例,Ⅳa期2例,Ⅳb期1例。选择新疆地区维吾尔族健康女性50例作为健康对照组。
1.2方法
1.2.1全血基因组DNA提取接受治疗前宫颈癌组和健康对照组分别采集肘静脉全血5mL(EDTA抗凝),试剂盒采用北京百泰克生物技术有限公司的全血基因组DNA提取试剂盒,严格按照说明书操作进行DNA提取。采用紫外分光光度计对浓度和纯度进行测定,其A260/280比值均为1.8~1.9,调整终浓度为0.3~0.5 μg/μL,取10 μg分装后置于-20℃冰箱保存用于检验。
1.2.2HLA-DRB1和HLA-DQB1基因亚组分型采用聚合酶连反应/序列特异性引物(polymerase chain reaction-sequence specific primer,PCR-SSP)方法。
1.2.3细胞因子的检测血标本经离心机分离获得的血浆在-80℃冷冻冰箱保存,根据human cytokine multi-plex (bio-rad, USA)分析和luminex multi-analytic profiling (bio-rad, USA)技术说明书测定γ-干扰素(interferon-γ, IFN-γ)、白细胞介素-2(interleukin-2, IL-2)、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-10(interleukin-10, IL-10)水平。
1.3统计学处理利用SPSS 17.0统计软件分析数据,分析HLA-DRB1,HLA-DQB1等位基因分布频率;对两组细胞因子(cytokines, CK)浓度采用t检验,对HLA-DRB1和HLA-DQB1各等位基因间细胞因子浓度采用单因素方差分析,以P<0.05为差异有统计学意义。
2结果
2.1宫颈癌患者HLA-DRB1表达全组患者39例中1例患者未检出HLA-DRB1,共检出HLA-DRB1等位基因8个,各HLA-DRB1等位基因的检出数和构成比情况见表1。
表1新疆维吾尔族HPV16感染中晚期宫颈癌患者
HLA-DRB1等位基因分布(2n=76)

HLA-DRB1基因检出构成比/%DRB1*01810.53DRB1*03810.53DRB1*04810.53DRB1*073444.74DRB1*0967.89DRB1*1167.89DRB1*1222.63DRB1*1345.26合计76100.00
2.2宫颈癌患者HLA-DQB1表达全组患者39例,检出HLA-DRB1等位基因4个,各HLA-DQB1等位基因的检出数和构成比见表2。
表2新疆维吾尔族HPV16感染中晚期宫颈癌患者
HLA-DQB1等位基因分布 (2n=78)

HLA-DQB1-1基因检出构成比/%DQB1*024456.41DQB1*032835.90DQB1*0545.13DQB1*0622.56合计78100.00
2.3健康对照组与维吾尔族HPV16感染Ⅱb、Ⅲb期宫颈癌组相关细胞因子比较健康对照组与维吾尔族HPV16感染Ⅱb、Ⅲb期宫颈癌组IFN-γ(t=4.333,P=0.000)、IL-2(t=2.974,P=0.004)、IL-6(t=2.337,P=0.025)、IL-10(t=2.236,P=0.031)差异均有统计学意义。健康对照组与Ⅲb期宫颈癌患者CK浓度比较:IFN-γ(t=3.674,P=0.017)、IL-2(t=2.974,P=0.002)、IL-6(t=4.523,P=0.000)、IL-10(t=2.219,P=0.029)差异均有统计学意义。维吾尔族HPV16感染Ⅱb期和Ⅲb期宫颈癌患者CK浓度比较:IFN-γ(t=0.772,P=0.446)、IL-2(t=0.516,P=0.576)、IL-6(t=0.720,P=0.476)、IL-10(t=0.015,P=0.988),差异无统计学意义,见表3。
表3 两组相关细胞因子浓度比较(pg/mL, ±s)
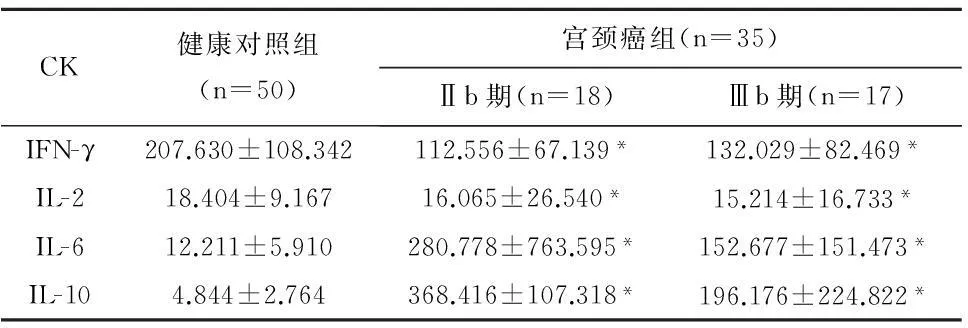
表3 两组相关细胞因子浓度比较(pg/mL, ±s)
CK健康对照组(n=50)宫颈癌组(n=35)Ⅱb期(n=18)Ⅲb期(n=17)IFN-γ207.630±108.342112.556±67.139*132.029±82.469*IL-218.404±9.16716.065±26.540*15.214±16.733*IL-612.211±5.910280.778±763.595*152.677±151.473*IL-104.844±2.764368.416±107.318*196.176±224.822*
注: Ⅱb宫颈癌患者组与健康对照组比较,*P<0.05。
2.4HLA-DRB1各等位基因细胞因子浓度比较剔除样本量少的HLA-DRB1*12和HLA-DRB1*13等位基因组,比较HLA-DRB1*01、HLA-DRB1*03、HLA-DRB1*04、HLA-DRB1*07、HLA-DRB1*09、HLA-DRB1*11等位基因的CK水平,单因素方差分析显示:IFN-γ(F=0.212,P=0.995)、IL-2(F=0.226,P=0.926)、IL-6(F=0.447,P=0.812)、IL-10(F=0.298,P=0.910)水平在各等位基因之间差异无统计学意义,见表4。
表4 HLA-DRB1各等位基因细胞因子浓度比较(pg/mL, ±s)

表4 HLA-DRB1各等位基因细胞因子浓度比较(pg/mL, ±s)
CKHLA-DRB1*01HLA-DRB1*03HLA-DRB1*04HLA-DRB1*07HLA-DRB1*09HLA-DRB1*11IFN-γ90.125±71.071144.375±124.027137.000±39.741126.706±75.871132.333±122.680123.833±59.406IL-2-20.465±31.94611.572±3.67014.242±5.20815.160±16.6599.297±5.554IL-671.250±71.88191.750±40.136125.750±42.437157.559±153.301146.000±128.035115.000±54.836IL-1081.500±68.918177.750±168.074146.750±43.053188.677±218.866130.000±102.430160.229±166.649
2.5HLA-DQB1各等位基因细胞因子浓度的比较剔除样本量少的HLA-DQB1*05和HLA-DQB1*06等位基因组,比较HLA-DQB1*02、HLA-DQB1*03等位基因的CK水平,经单因素方差分析显示:IFN-γ(F=0.174,P=0.679)、IL-2(F=0.443,P=0.512)、IL-6(F=0.521,P=0.475)、IL-10(F=0.589,P=0.448)浓度在各等位基因之间差异无统计学意义,见表5。
表5HLA-DQB1各等位基因细胞因子浓度的比较
(pg/mL,±s)

CKHLA-DQB1*02HLA-DQB1*03IFN-γ126.682±84.197115.714±63.045IL-215.331±15.40411.706±6.823IL-6115.955±83.979145.036±157.945IL-10138.477±97.663182.071±238.373
3讨论
不同种族、不同地区宫颈癌患者HLA II类基因分布存在差异。大量文献报道,HLA II类基因的DRB1、DQB1与HPV16感染的宫颈癌密切相关[5-6, 10-12]。Beskow等[10]对440例确诊HPV16感染的宫颈癌患者和476例健康人的HLA-DRB1和HLA-DQB1等位基因位点检测后发现,HLA-DRB1*0801、HLA-DRB1*1501、HLA-DQB1*0402、HLA-DQB1*0602等位基因的频率增加,而HLA-DRB1*0101、HLA-DRB1*1301、HLA-DQB1*0501、HLA-DQB1*0603等位基因的频率降低,校正后发现DQB1*0602和DRB1*1501与宫颈癌患者密切相关。Cuzick等[13]对英国 116例HPV16感染的宫颈癌妇女HLA分型分析,发现HLA-DQB1*0301(2P= 0.02)和HLA-DRB1*0401(2P= 0.02)是宫颈癌的易感单倍体。Madeleine等[14]研究发现,HLA-DRB1*1501和HLA-DQB1 *0302为优势表达基因。李华[15]报道,HLA-DRB1*15可能是新疆喀什地区维吾尔族妇女宫颈癌的易感基因;而HLA-DRB1*04可能是喀什地区维吾尔族妇女宫颈癌的保护基因。古扎丽努尔等[16]研究结果提示,HLA-DRQB*06可能是维吾尔族妇女宫颈癌的易感基因,其可增加HPV16阳性妇女患宫颈癌的风险。本研究结果显示,HLA-DRB1*07为优势表达基因,表达比例接近一半。这与文献[13-14,17]报道有一定的差别,可能与病例数偏少,以及研究人群不同有关。检出HLA-DQB1等位基因4个,其中HLA-DQB1*02(56.41%)、 HLA-DQB1*03(35.90%),提示,HLA-DQB1*02与HLA-DQB1*03为优势表达基因,这与Madeleine等[14]研究发现,HLA-DQB1*0301,HLA-DRB1*0301,HLA-DQB1*0201与HPV16阳性的鳞状细胞癌相关(比值比为0.5;95%置信区间0.3~0.9)研究相符 ,而与Ferrera等[6]报道的洪都拉斯女性HLA-DRQB*0602为易感表达基因不相符。本研究结果提示,新疆维吾尔族宫颈癌患者HLA-DRB1与HLA-DQB1等位基因分布大致相似,但也具有自身特点,可能与不同民族、不同地区有关。可扩大样本量继续研究,以期待得到一个更为准确的新疆维吾尔族妇女HPV16感染的中晚期宫颈癌HLA-DRB1及HLA-DQB1的等位基因分布情况。
CK是细胞间交流的工具, 是宿主免疫系统对外来病原应答的一种成分。 干扰素γ(IFN-γ)是II型干扰素家族的唯一成员,主要是由T淋巴细胞、NK细胞参与而产生,具有抗病毒、抗肿瘤和免疫调节等作用。有研究显示,在恶性黑色素瘤、胃癌、肺癌、胶质母细胞瘤、鼻咽癌、结肠直肠癌、宫颈癌和头颈部肿瘤中IFN-γ水平下降[9,18]。Soong等[19]研究发现利用IFN-γ受体激动剂可提高免疫应答并且可增强抗肿瘤的效应。Wang等[20]报道晚期宫颈癌患者由于淋巴结转移,免疫微环境被破坏,发生免疫逃逸,经研究观察到IL-6,IL-10高于正常水平,而IFN-γ低于正常水平。本研究结果表明不同临床分期宫颈癌患者IFN-γ分别为(112.556±67.139) pg/mL和(132.029±82.469) pg/mL,较对照组均明显降低,这与Lippitz等[9]与Wang等[20]的研究结果相一致。细胞因子IL-2主要由T淋巴细胞产生,在机体免疫应答中发挥调节作用,对免疫活性有增强作用。可诱导激活的杀伤细胞(LAK)、自然杀伤细胞( N K ) 细胞毒性T细胞(CTL)分化,从而发挥抵抗肿瘤细胞的作用[21]。Paradkar等[22]研究报道,HPV感染的女性外周血淋巴细胞中IL-2水平较正常组有所降低。Valle-Mendiola等[23]报道高剂量的IL-2,可抑制宫颈癌细胞的增殖。本研究结果显示宫颈癌组IL-2低于健康对照组(P<0.05),这与文献[22-23]报道相一致。IL-6是一种典型的具有多种生物学功能的细胞因子,机体内B细胞、T细胞、单核细胞、成纤维细胞、内皮细胞、星形胶质细胞和小胶质细胞均可产生IL-6,其在细胞免疫、炎性反应、造血调控中均发挥重要作用。Guo等[24]通过临床研究表明,多发性骨髓瘤、非小细胞肺癌、结肠直肠癌、肾细胞癌、前列腺癌、乳腺癌和卵巢癌的晚期肿瘤患者血清IL-6增高,而阻断IL-6的信号传导成为一个潜在的治疗肿瘤策略。Wang等[20]研究发现IL-6在正常宫颈组织不表达或低表达,而在宫颈鳞状细胞癌中多为中高表达,宫颈鳞癌患者的IL-6的阳性表达率明显高于正常宫颈组(P<0.01)。本研究显示在Ⅱb和Ⅲb宫颈癌组中,患者血清均明显高于健康对照组(P<0.05和P<0.05),这与Wang等[20]的研究相似。白细胞介素- 10(InterIeukin-10,IL-10)是一种具有免疫抑制作用的细胞因子,它可抑制IL-2、INF-γ等因子生成,文献[25-26]报道IL-10通过抑制机体免疫功能与HPV相互作用从而导致宫颈癌的形成和发展。有关研究表明在人类很多肿瘤如肾癌、消化道肿瘤、黑色素瘤等中IL-10均过量表达[27-28]。因此抑制IL-10过表达可起到抗肿瘤的效果[29]。本研究结果表明Ⅱb期和Ⅲb期患者组IL-10分别为(368.416±107.318)pg/mL和(196.176±224.822) pg/mL,较对照组均明显增高,差异均有统计学意义。这与文献[27-29]报道相符。综合分析结果,新疆维吾尔族HPV16感染的Ⅱb和Ⅲb期宫颈癌妇女与健康对照组相比,IFN-γ和IL-2低于正常水平,IL-6和IL-10高于正常水平,差异均有统计学意义,这意味着这些细胞因子可能在宫颈癌的发生和发展中扮演着重要的角色。
本研究假设HLA-DRB1与-DQB1各等位基因间细胞因子有差异,对HLA-DRB1*01、HLA-DRB1*03、HLA-DRB1*04、HLA-DRB1*07、HLA-DRB1*09、HLA-DRB1*11等位基因的CK浓度进行比较,经单因素方差分析显示浓度在各等位基因之间均无明显差异。对HLA-DQB1*02和HLA-DQB1*03等位基因的CK浓度进行比较,经单因素方差分析显示浓度在各等位基因之间均无明显差异。综合分析认为可能与样本数太少有关,也可能HLA-DRB1与HLA-DQB1各等位基因间细胞因子本身并无不同。
综上所述,HLA-DRB1*07、HLA-DQB1*02和HLA-DQB1*03可能为新疆维吾尔族HPV16感染的中晚期宫颈癌妇女的优势表达基因;宫颈癌患者IFN-γ、IL-2、IL-6、IL-10细胞因子水平与健康人对比差异有统计学意义,但新疆维吾尔族妇女HPV16感染的中晚期宫颈癌HLA-DRB1和HLA-DQB1各等位基因与细胞因子IFN-γ、IL-2、IL-6、IL-10水平的关联性,尚需要扩大样本深入研究。
参考文献:
[1]Poggio JL.Premalignant lesions of the anal canal and squamous cell carcinoma of the anal canal[J]. Clin in colon and rectal surg,2011, 24(3):177-192.
[2]Li S, Hu T, Lv W,et al.Changes in prevalence and clinical characteristics of cervical cancer in the People's Republic of China: a study of 10,012 cases from a nationwide working group[J]. Oncologist,2013,18(10):1101-1107.
[3]姜淑清, 土送爱, 周俊兰,等.新疆策勒县妇女病现状调查与分析[J]. 中国妇幼保健,2006, 21(4):524-526.
[4]马琦,阿仙姑·哈斯木,阿比达·阿不都卡德尔等.维吾尔族妇女宫颈癌人乳头状瘤病毒感染与人类白细胞抗原Ⅰ类基因表达缺失的关系及其意义[J].中华病理学杂志,2010, 39(4):255-258.
[5]祖菲娅·艾力, 再努力·阿布都热衣木, 拉莱·苏祖克,等.喀什维吾尔族宫颈鳞癌患者 HPV16 型感染及其人类白细胞抗原-DQB1 基因多态性的关系[J]. 临床与实验病理学杂志,2011, 27(3):274-277.
[6]Ferrera A, Olivo A, Alaez C, et al.HLA DQA1 and DQB1 loci in honduran women with cervical dysplasia and Invasive cervical carcinoma and their relationship to human papillomavirus infection[J]. Human Biology, 1999,71(3):367-379.
[7]刘艳波, 蔡莲莲, 王宗敏, 等. 白细胞介素 6 在子宫颈癌组织中的表达及其与血管生成的关系[J]. 中华妇产科杂志, 2005, 40(3): 197-199.
[8]Valle-Mendiola A, Weiss-Steider B, Rocha-Zavaleta L, et al. IL-2 Enhances Cervical Cancer Cells Proliferation and JAK3/STAT5 Phosphorylation at Low Doses, While at High Doses IL-2 Has Opposite Effects[J]. Cancer invest, 2014, 32(4):115-125.
[9]Lippitz BE.Cytokine patterns in patients with cancer: a systematic review[J]. The lancet oncol,2013,14(6):218-228.
[10]Beskow AH, Josefsson AM,Gyllensten UB ,et al. HLA class II alleles associated with infection by HPV16 in cervical cancer in situ[J]. Int J cancer,2001,93(6):817-822.
[11]Hu J, Li L, Pang L,et al.HLA-DRB1* 1501 and HLA-DQB1* 0301 alleles are positively associated with HPV16 infection-related Kazakh esophageal squamous cell carcinoma in Xinjiang China[J]. Cancer Immunol,2012, 61(11):2135-2141.
[12]Alaez-Verson C, Berumen-Campos J, Munguía-Saldaa A,et al.HPV-16 and HLA-DRB1 alleles are associated with cervical carcinoma in Mexican Mestizo women[J].Arch Med Res,2011, 42(5):421-425.
[13]Cuzick J, Terry G, Ho L,et al.Association between high-risk HPV types, HLA DRB1* and DQB1* alleles and cervical cancer in British women[J].Br J Cancer,2000,82(7):1348-1352.
[14]Madeleine MM, Johnson LG, Smith AG, et al. Comprehensive analysis of HLA-A, HLA-B, HLA-C, HLA-DRB1, and HLA-DQB1 loci and squamous cell cervical cancer risk[J]. Cancer Res,2008,68(9):3532-3539.
[15]李华. 喀什维吾尔族妇女宫颈癌与 HLA-DRB1* 15 和 HLA-DRB1* 04 的关系[J].复旦学报:医学版,2010,37(5): 555-559.
[16]古扎丽努尔·阿不力孜 ,米仁沙·阿布都 ,张苏琴,等. 人乳头状瘤病毒感染及人白细胞抗原-DQB1 等位基因多态性与南疆维吾尔族女性宫颈癌的关系[J]. 中华肿瘤杂志,2010,32(7):492-496.
[17]Xiao X, Liu L, Li WJ,et al.HLA-A, HLA-B, HLA-DRB1 polymorphisms and risk of cervical squamous epithelial cell carcinoma: a population study in China[J].Asian Pac J Cancer Prev,2013,14(7):4427-4433.
[18]Young M R I, Wright M A, Lozano Y, et al. Mechanisms of immune suppression in patients with head and neck cancer: influence on the immune infiltrate of the cancer[J]. Int J Cancer, 1996, 67(3):333-338.
[19]Soong R-S, Song L, Trieu J,et al.Toll like receptor agonist imiquimod facilitate antigen -specific CD8+ T cell accumulation in the genital tract leading to tumor control through interferon-γ[J].Clin Cancer Res,2014,20(21):5456-5467.
[20]Wang H L, Xu H, Lu W H, et al. In vitro and in vivo evaluations of human papillomavirus type 16 (HPV16)-derived peptide-loaded dendritic cells (DCs) with a CpG oligodeoxynucleotide (CpG-ODN) adjuvant as tumor vaccines for immunotherapy of cervical cancer[J]. Arch Gyn Obstet, 2014, 289(1):155-162.
[21]Koreth J, Matsuoka KI, Kim HT,et al.Interleukin-2 and regulatory T cells in graft-versus-host disease[J]. New Eng J Med,2011,365(22):2055-2206.
[22]Paradkar PH, Joshi JV, Mertia PN,et al. Role of cytokines in genesis,progression and prognosis of cervical cancer[J]. Asian Pac J Cancer Prev,2014,15(9):3851-3864.
[23]Valle-Mendiola A, Weiss-Steider B, Rocha-Zavaleta L, et al. IL-2 Enhances Cervical Cancer Cells Proliferation and JAK3/STAT5 Phosphorylation at Low Doses, While at High Doses IL-2 Has Opposite Effects[J]. Cancer Invest, 2014,32(4):115-125.
[24]Guo Y, Xu F, Lu T J, et al. Interleukin-6 signaling pathway in targeted therapy for cancer[J]. Cancer Treat Rev, 2012,38(7):904-910.
[25]胡嫚, 石琨. IL-10 在宫颈癌发生发展中作用的研究进展[J]. 肿瘤学杂志, 2013(11):893-896.
[26]Saraiva M, O′Garra A. The regulation of IL-10 production by immune cells[J]. Nat Rev Immunol, 2010, 10(3):170-181.
[27]王瑶, 吕海燕, 郭佳, 等. 放射治疗荷肾癌小鼠肿瘤生长抑制与脾细胞及肿瘤组织 IL-2, IFN-γ 和 IL-10 的关系[J]. 第四军医大学学报, 2009 (20): 2122-2124.
[28]姚琪远, 张群华. 血清 IL-6, IL-10, IL-12 在消化道肿瘤中的表达及其意义[J]. 中国胃肠外科杂志, 2000, 3(1):34-35.
[29]Song S, Wang Y, Wang J,et al.Tumour-derived IL-10 within tumour microenvironment represses the antitumour immunity of Socs1-silenced and sustained antigen expressing DCs[J]. Eur J Cancer,2012, 48(14):2252-2259.
(本文编辑周芳)
通信作者:田树革,博士,教授,博士生导师,研究方向:中药资源化学与质量标准,E-mail:tsgyz@sina.com。
·基础医学研究·
