小立碗藓PpAGO7基因启动子分离及其启动活性分析
2016-01-12高运通,潘沈元,王爱民
*通信作者:王爱民,理学硕士,副教授,主要从事植物生理与分子生物学教学与研究。E-mail:aiminwang@jsnu.edu.cn
小立碗藓PpAGO7基因启动子分离及其启动活性分析
高运通,潘沈元,王爱民*
(江苏师范大学 生命科学学院,江苏徐州 221116)
摘要:AGO7蛋白在多种植物中被发现并预测在叶片生长发育过程中起作用,但是在高等植物中最古老且唯一没有维管束的苔藓植物中却未有报道。该文通过BLAST比对水稻OsAGO7基因编码的氨基酸序列得到小立碗藓AGO7蛋白编码基因PpAGO7,扩增PpAGO7基因起始密码子上游的启动子序列,利用在线软件PlantCARE和PLACE分析该启动子的结构特征;并构建启动子分析载体pPpAGO7-GUS,转化拟南芥,通过转基因拟南芥GUS染色结果分析推测PpAGO7启动子的启动特性。结果显示:(1)PpAGO7基因启动子序列中含有大量的光反应有关的顺式作用元件以及数个分生组织相关和防御与胁迫相关作用元件。(2)T2代转基因拟南芥的GUS染色结果表明,PpAGO7基因启动子会启动GUS在拟南芥的不同部位和不同生长时期表达,而且在根尖、叶片顶端、雄蕊的花药、雌蕊的柱头和种子等部位的染色较其他部位更深。(3)生长在光照强度1 000 lx和4 000 lx下转基因拟南芥的GUS酶活性比光照强度7 000 lx和10 000 lx下的低。研究表明所克隆的PpAGO7基因启动子具有组成性启动活性,且在生长旺盛的部位启动活性较强,此外其启动活性还受到光照因素的影响,为进一步研究小立碗藓的PpAGO7基因功能提供了重要依据。
关键词:小立碗藓;PpAGO7;启动子
收稿日期:2014-09-17;修改稿收到日期:2014-12-17
基金项目:科技部转基因生物新品种培育科技重大专项子课题(2014ZX08012-002)
作者简介:高运通(1989-),男,在读硕士研究生,主要从事植物分子遗传学研究。E-mail:545080590@qq.com
中图分类号:Q785;Q789 文献标志码:A
基金项目《西北植物学报》2014年刊载论文统计
基金项目1.国家级基金:318项,占总数的41.7%。其中:国家自然科学基金167项,国家重点基础研究发展计划即国家“973”基金16项,国家“863”计划基金14项,国家“948”基金5项,国家博士点基金(含博士后基金6项)22项,国家其它项目基金93项。
基金项目2.中国科学院基金:19项,占总数的2.5%。其中:知识创新工程基金2项,西部之光基金7项,其它基金10项。
基金项目3.各部委基金:82项,占总数的10.7%。其中:科技部基金7项,教育部基金12项,农业部基金28项,国家林业局基金14项,其它部委基金21项。
基金项目4.中外合作基金:3项,占总数的0.4%
基金项目5.大学基金:62项,占总数的8.1%
基金项目6.省(市)各类研究基金:273项,占总数的35.8%
Separation and Functional Analysis of the Promoter of
PpAGO7 Gene fromPhyscomitrellapatens
GAO Yuntong,PAN Shenyuan,WANG Aimin*
(School of Life Science,Jiangsu Normal University,Xuzhou,Jiangsu 221116,China)
Abstract:The AGO7 was found in many plants and was predicted to play a role in the processduring growth anddevelopment of leaves in higher plants.However,it was not reported in bryophytes which was one of the oldest and the only one which had no vascular bundle in higher plants.By comparison to the amino acid sequence of OsAGO7 in rice with BLAST tool,we obtained the AGO7 protein code gene in Physcomitrella patens named PpAGO7.We also cloned the promoter sequence of PpAGO7 and analyzed its sequence characters by using online software Plant CARE and PLACE.Then the promoter analysis vector pPpAGO7-GUS was built and transferred into Arabidopsis todetect the initiation activity.The result indicated that:(1)The promoter sequence contained large amount of cis-acting elements related to the photo reaction and a plurality of elements related to the meristem anddefense and oppression related elements.(2)According to the staining result of the T2 transgenic plants,GUS staining was found indifferent tissues andduringdifferent growth periods.Moreover,the staining color was muchdeeper in the root,leaf tip,anther of stamen,stigma of pistil and seeds than in other tissues.(3)The GUS enzymatic activity of the transgenic Arabidopsis under the light intensity condition 1 000 lx or 4 000 lx was lower than that under the light intensity condition 7 000 lx or 10 000 lx.All results indicted that the cloned PpAGO7 promoter had constitutively promoting activity and was influenced by light intensity.
Key words:Physcomitrellapatens;PpAGO7;promoter
AGO蛋白(argonaute proteins)是RNA诱导的沉默复合物(RISC)的核心成分,它在几乎所有已知的RNA沉默通路中发挥关键作用,包括维持基因组的稳定、调控组织发育[1]、对逆境的适应性应答以及在RNA层面对入侵核酸(转基因和植物病毒)的免疫等[2]。
前人对植物AGO蛋白功能的研究在拟南芥中最为全面和透彻,在拟南芥的10个AGO蛋白中全部具有切割活性所必需的催化三联体DDH或DDD,但目前被证实有切割活性的只有AtAGO1、AtAGO4和AtAGO7[3-4]。AGO7最早是在早熟的拟南芥突变体中与ta-siRNA一同被鉴定出来的,Adenot等[5]发现TAS3 ta-siRNA的产生依赖于AGO7蛋白的作用,并且生成的ta-siRNA能继续与AtAGO7结合形成沉默复合体调节下游的靶mRNA[5-6]。这是目前为止第一个也是唯一一个被证实的AtAGO7参与的siRNA通路。迄今为止,AGO7蛋白的功能在水稻、拟南芥等高等开花植物中的研究已经较为全面,但是在高等植物中最古老且是唯一一类没有维管束的陆生植物苔藓中尚未有报道。
苔藓植物是最古老的陆生植物之一,广泛分布于世界各地,虽然属于高等植物,有茎叶的分化但是茎中无导管,叶中无叶脉,没有输导组织,根的结构也非常简单称为“假根”[7]。进化学上认为苔藓植物和维管植物是起源系统上的一个姐妹进化支。从苔藓植物在进化树上的相对位置说明它是研究陆生植物进化的理想材料[8]。小立碗藓(Physcomitrellapatens)属于葫芦藓科小立碗藓属,是目前为止发现的同源重组率最高的植物,是研究功能基因特性的理想材料[9]。而且在前人对小立碗藓的研究中没有任何有关AGO7蛋白的生物学功能的报道。本研究通过比对拟南芥、水稻和玉米中AGO7基因的保守序列,获得小立碗藓的AGO7蛋白编码基因PpAGO7,进而克隆PpAGO7基因起始密码子上游碱基序列,分析其序列结构并构建以PpAGO7基因启动子驱动GUS基因表达的启动子分析质粒pPpAGO7-GUS。农杆菌介导浸花法转化拟南芥,通过GUS染色和GUS活性测定以了解PpAGO7基因启动子在拟南芥中的表达特性,为研究小立碗藓中PpAGO7基因的生物学功能提供依据。
1材料和方法
1.1 实验材料
小立碗藓(Physcomitrellapatens)及拟南芥(Arabidopsisthaliana)哥伦比亚型由本实验培养。大肠杆菌(Escherichiacoli)菌种DH5α、根癌农杆菌(Agrobacteriumtumefaciens)菌种EHA105、启动子分析载体p1300GN均由江苏师范大学生命科学学院保存。T4dNA ligase及Taq酶购自TaKaRa公司;限制性内切酶购自Thermo Scientific公司;DNA片段快速胶回收试剂盒购自北京博大泰克生物基因技术有限公司。引物合成和测序工作均由上海捷瑞生物工程有限公司完成。
1.2 PpAGO7启动子的克隆及启动子分析质粒的构建
以小立碗藓成熟茎叶体为材料,用SDS法提取基因组总DNA[10]。以水稻的OsAGO7蛋白的氨基酸序列(http://www.ncbi.nlm.nih.gov/protein/ABO93307.1)为模板对小立碗藓的蛋白质数据库进行Blastp(http://www.cosmoss.org/bm/BLAST?type=1)比对,得到与OsAGO7同源性较高的蛋白序列,并获得其对应的DNA碱基序列。利用Primer5软件设计正向引物APGF(5′-cttAAGCTTGCTTTTTAACTTCTACATC-3′,下划线为HindⅢ酶切位点)和反向引物APGR(5′-aaaG-GATCCGCGGCATGATGACAAAACA-3′,下划线为BamHⅠ酶切位点),扩增PpAGO7基因起始密码子上游长1 773 bp的序列。扩增条件为94 ℃预变性5 min;94 ℃变性45 s,54 ℃退火45 s,72 ℃延伸2 min,30个循环;72 ℃延伸10 min;4 ℃保存。电泳回收目的基因片段测序。
将扩增获得的启动子片段用BamHⅠ/HindⅢ双酶切后插入到无启动子的含有卡那霉素抗性基因的载体p1300GN中BamHⅠ和HindⅢ之间,后接GUS基因的编码区序列、潮霉素抗性基因HYG和NOS终止子,构建成启动子分析质粒pPpAGO7-GUS(图1)。酶切鉴定和测序表明构建正确。
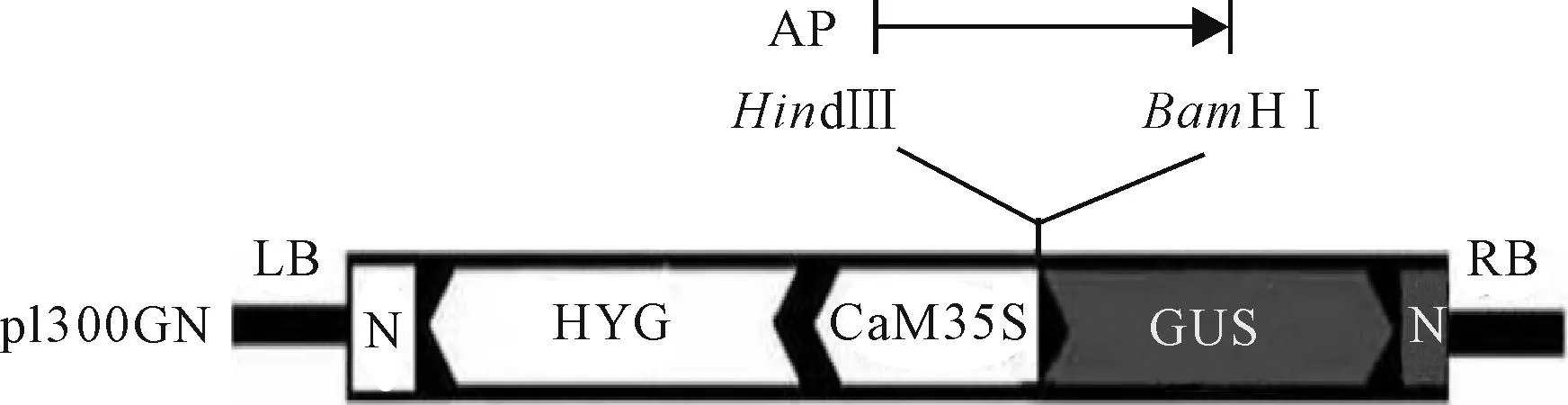
图1 质粒载体pPpAGO7-GUS示意图
1.3 PpAGO7基因启动子序列分析
利用在线启动子分析软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)和PLACE(http://www.dna.affrc.go.jp/PLACE/signalscan.html)对克隆的PpAGO7基因启动子潜在的功能进行预测。
1.4 拟南芥转化
将启动子分析质粒pPpAGO7-GUS通过冻融法导入到农杆菌EHA105中[11],之后取适量农杆菌转化子接种至含有50 mg/L卡那霉素的YEB液体培养基中,28 ℃、180 r/min振荡培养过夜,OD600在1.2~1.6之间时室温离心,将农杆菌沉淀重新悬浮于适当体积的渗透培养基中使OD600在0.8左右,浸花法转化拟南芥[12]。
1.5 转基因拟南芥筛选和GUS组织化学染色分析
收集拟南芥种子,消毒后置于含有35 mg/L潮霉素的1/2 MS固体培养基上培养10d,将生长正常的幼苗(转化株)移至土壤中培养。待拟南芥成熟后,分别提取总DNA并以PAGF和PAGR为引物PCR扩增检验其是否已插入质粒载体。分单株收取转基因拟南芥种子并用上述相同的方法培养得到T1代转化株。分别选取不同时期及不同组织的T1代拟南芥转化株按Jefferson的方法进行GUS组织化学染色[13]。
1.6 转基因拟南芥不同光照强度处理及GUS活性测定
将培养箱(光照强度7 000 lx、12 h光照8 h黑暗、21 ℃)中培养15d的T2代拟南芥转化株转到光照强度分别为1 000、4 000、7 000和10 000 lx,其他环境条件不变的培养箱中培养3d,非转基因拟南芥置于4 000 lx光强的培养箱中作为参照。3d后测定GUS活力,随机选取4个处理组转基因拟南芥及非转基因植株在液氮中研磨,用磷酸缓冲液法提取总蛋白并测定样品蛋白质含量[14]。然后参照Richard等[15]的方法检测各样品中GUS的活力。酶活力单位定义为每分钟PNPG生成1 nmol对硝基苯酚的酶量为一个单位,GUS活力(U)以每分钟每毫克蛋白的酶活力表示(nmol·mg-1·min-1)[16]。每个处理组设置3次重复实验。
2结果与分析
2.1 PpAGO7序列的确定及启动子片段的克隆
通过Blastp比对得到的小立碗藓氨基酸序列含有2个高度保守的PAZ和PIWI结构域,具有典型的AGO类蛋白的结构特征。为研究PpAGO7基因启动子活性,采用PCR扩增从预测的PpAGO7基因启始密码子起上游1 773 bp的DNA片段(图2,A)。之后将扩增的片段与T载体连接然后转化大肠杆菌DH5α,挑取单菌落进行菌落PCR和BamHⅠ/HindⅢ双酶切鉴定(图2,B)并将阳性克隆测序,测序结果与数据库(http://www.cosmoss.org)序列一致。
2.2 PpAGO7基因启动子的结构特征
用PlantCARE数据库分析我们所得到的PpAGO7启动子序列,结果(图3)表明,PpAGO7基因起始密码子ATG上游1 773 bp启动子序列中含有启动子区域特征元件TATA-box 11个,CAAT-box 9个。进一步结构分析发现,PpAGO7启动子序列中含有高水平转录调控因子5′-UTR嘧啶密集区(5′-UTR Py-rich stretch);与光反应有关的BOX-Ⅰ、CG-motif、CGT-motif、G-box、G-Box、GT1-motif、GTGGC-motif及与病原体、真菌诱导子侵入有关的Box-W1、MBS、W box等顺式作用元件;同时还发现了数个响应低氧环境的作用元件ARE、响应低温脱水的作用元件C-repeat/DRE、与分生组织有关的作用元件CAT-box、与防御和物理胁迫有关的元件TC-rich repeats以及响应低温环境的元件LTR等多个顺式作用元件。
2.3 启动子分析质粒pPpAGO7-GUS的构建与转基因植株的获得
按照上述方法将构建的启动子分析质粒pPpAGO7-GUS通过浸花法转化拟南芥。分单株收获种子并萌发于含有潮霉素的选择培养基上,筛选出长势良好的幼苗移至土壤中继续生长。随机选取5株转基因拟南芥植物提取总DNA,以APGF和APGR为引物进行PCR扩增,均获得约2 kb条带(图4)。表明获得的植株即为插入了质粒载体pPpAGO7-GUS的转化株。

图2 小立碗藓 PpAGO7启动子的扩增(A)与启动子分析质粒pPpAGO7-GUS的酶切鉴定(B)

图3 小立碗藓 PpAGO7基因启动子序列特征分析
2.4 PpAGO7启动子的启动活性分析
为了检测所扩增的序列是否具有启动活性,分别选取生长10、20、45和55d等4个时期的转基因拟南芥的根、茎、叶、花和果实,进行GUS组织化学染色(图5)。由图可见,拟南芥转化株在这4个时期都有显色,而且在各自时期的根、叶、茎、花和种子部位也都有不同程度的着色(图5,A~I)。并且在根尖、叶片顶端、雄蕊的花药、雌蕊的柱头和种子这些部位的染色相对于其他部位更深(图5,D、J、K和L)。由此可以推测该启动子可能在个体生长发育的整个时期都有启动活性。
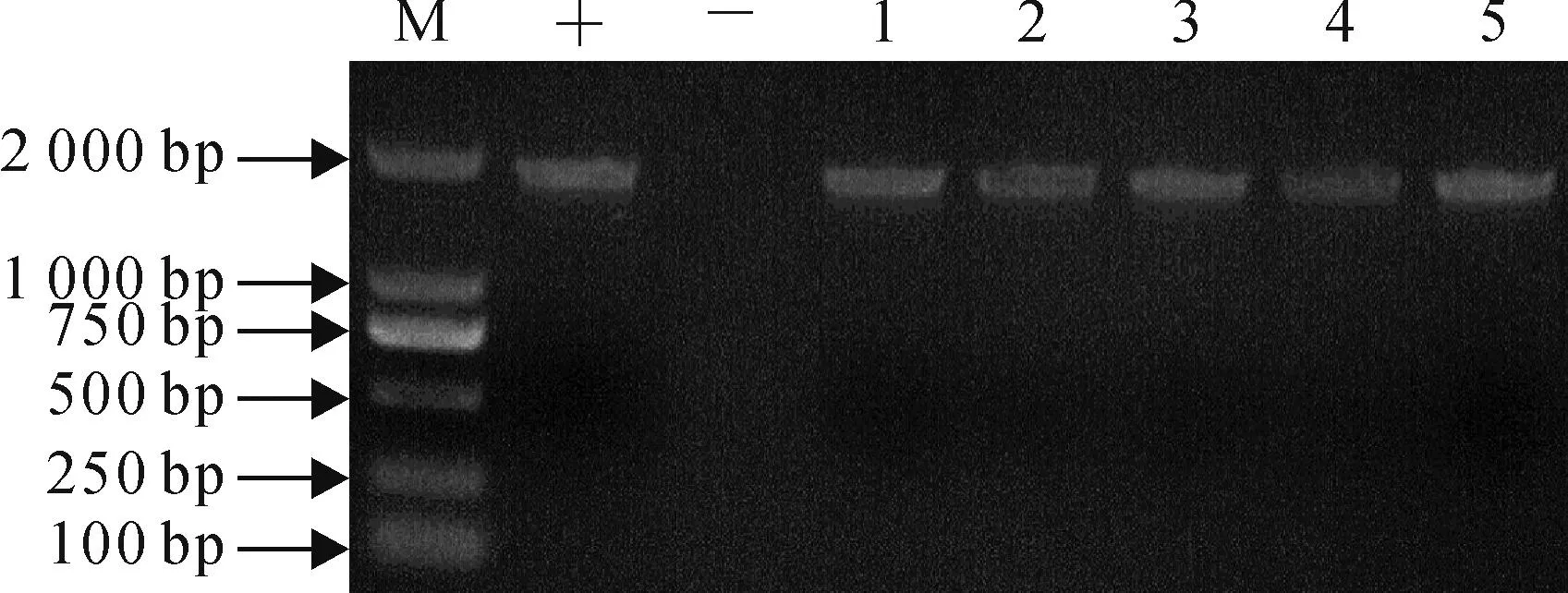
图4 转基因拟南芥的PCR检测结果
2.5 PpAGO7启动子的启动活性与光照强度关系
由于PpAGO7启动子的序列分析中发现有很多光敏感的作用元件,为此分析了不同光照强度下该启动子活性。结果(图6)显示,在光照强度7 000 lx和10 000 lx条件下,转基因拟南芥中GUS活性无显著差异,都在30 nmol·mg-1·min-1左右。而在光照强度1 000 lx和4 000 lx条件下,转基因拟南芥中的GUS活性则要显著低于10 000 lx条件(P<0.01)。与光照强度1 000 lx相比,光照强度4 000、7 000和10 000 lx下生长的转基因拟南芥中的GUS活性分别是其2.35倍、3.72倍和3.76倍。在非转基因拟南芥中,GUS活性几乎为零。

图5 T 2代转基因拟南芥各个时期不同部位GUS组织化学染色
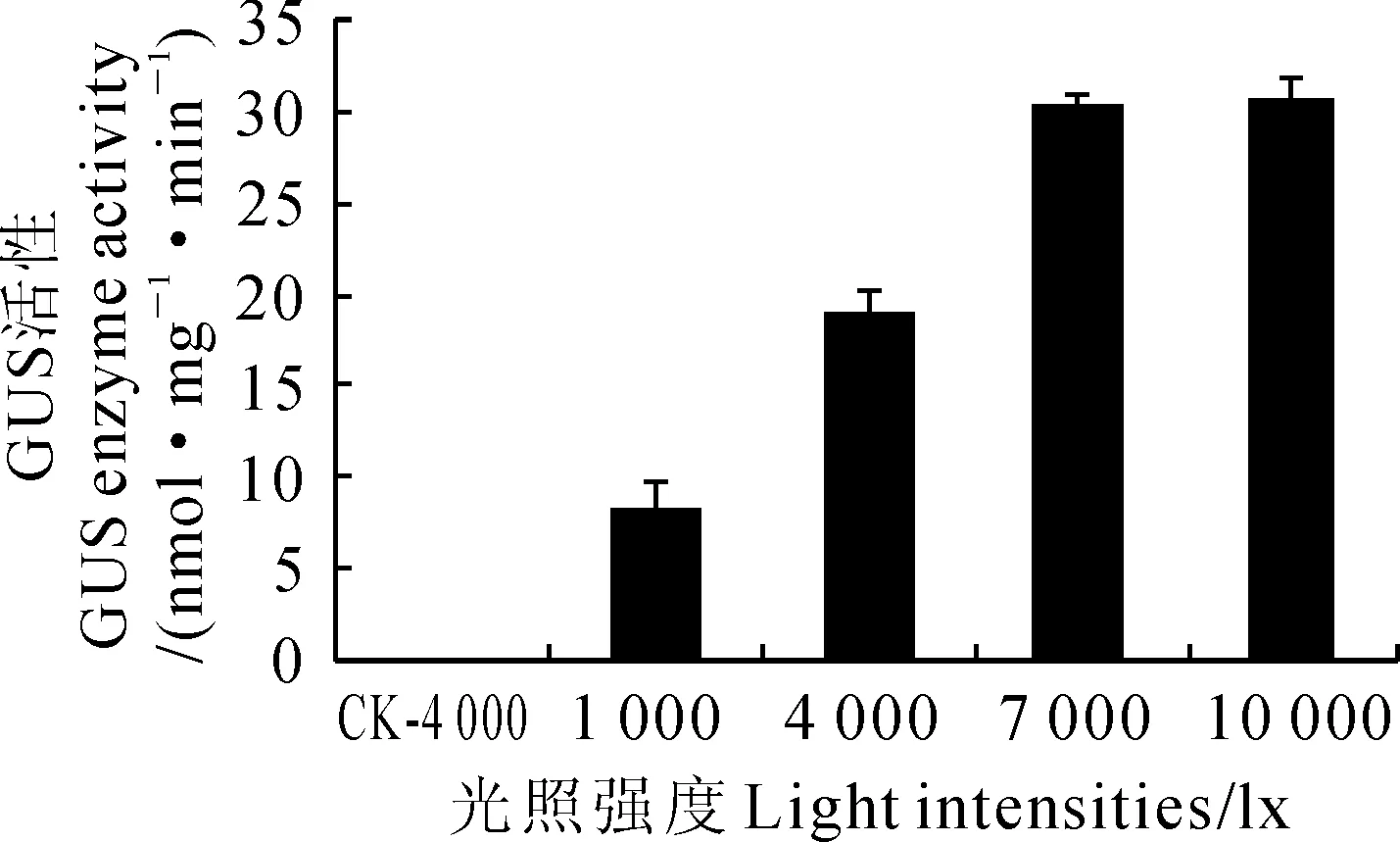
图6 转基因拟南芥GUS活性与光照强度关系柱状图
3讨论
AGO蛋白是一个高度保守且庞大的家族,作为沉默复合体的核心成分,在RNA沉默中发挥着关键作用[17]。AGO7蛋白是植物体内特有的一种小RNA即反式作用小RNA(ta-siRNA)生物合成途径中必需的。拟南芥AtAGO7基因敲除突变体表现为早熟,继而导致叶片形态结构的缺陷[18]。水稻中OsAGO7基因的超表达会引起叶片内卷[19]。在玉米中ZmAGO7基因下调突变株中,叶片维管束生成异常,从而影响了叶片的形态[20]。番茄中SLAGO7在营养组织叶中微弱表达,而在生殖器官花中强烈表达,表达量从花蕾到盛开的花呈递增趋势,但在果实不同发育时期中表达都非常微弱甚至不表
达[21]。由此推测AGO7蛋白介导的ta-siRNA途径可能在植物叶片和花器官的形态结构和发育过程起到一定作用。本实验从小立碗藓中分离出PpAGO7基因起始密码子上游1 773 bp的启动子片段,并以此构建启动子分析载体,在转基因拟南芥的GUS染色结果中,根尖、叶顶端和花的花药与柱头都有较深的着色,而这些一般都是生长分化较快的部位,说明此段启动子区域的启动活性具有组织特异性,并且也预示着PpAGO7基因可能在小立碗藓的组织生长发育、叶片极性生长和花的发育的过程中起到一定的的调控作用。
Qu等[22]发现,拟南芥AtAGO7和AtAGO1共同参与由siRNA介导的对芜菁皱缩病毒(TCV)的免疫反应,其中AtAGO1占主导作用而AtAGO7起辅助作用。在PpAGO7基因启动子序列中也发现了与病原体、真菌诱导子侵入有关的顺式作用元件Box-W1、W box和MBS,其中MBS是MYB转录因子的结合位点,MYB转录因子家族参与植物苯丙烷类次生代谢途径的调节,而苯丙烷类次生代谢途径在植物抗病害作用中发挥着重要作用[23]。这似乎预示着PpAGO7基因可能在对抗入侵病原体和真菌诱导子的过程中发挥作用,但还有待于进一步的实验验证。另外,由于在PpAGO7启动子序列中有大量的光响应有关作用元件,为了探究此片段启动活性是否与光照因素有关,本实验又设置了4组不同的光照强度培养T2代转基因拟南芥,并分别测定GUS酶活性。结果也证明了光照强度的高低确实会影响PpAGO7基因启动子的启动活性。这些结果都为进一步探究小立碗藓中AGO7蛋白的生物学功能提供了重要的基础。
参考文献:
[1]HUTVAGNER G,SIMARD M J.Argonaute proteins:key players in RNA silencing[J].Nat.Rev.Mol.CellBiol.,2008,9(1):22-32.
[2]VAUCHERET H.Post transcriptional small RNA pathways in plants:mechanisms and regulations[J].GenesDev.,2006,20(7):759-771.
[3]TOLIA N H,JOSHUA-TOR L.Slicer and the argonautes[J].Nat.Chem.Biol.,2007,3(1):36-43.
[4]VAUCHERET H.Plant ARGONAUTES[J].TrendsPlantSci.,2008,13(7):350-358.
[5]ADENOT X,ELMAYAN T,LAURESSERGUESd,etal.DRB4-dependent TAS3 trans-acting siRNAs control leaf morphology through AGO7[ J].Curr.Biol.,2006,16(9):927-932.
[6]HUNTER C,WILLMANN M R,WU G.Trans-acting siRNAmediatedrepression of ETTIN and ARF4 regulates heteroblasty inArabidopsis[J].Development,2006,133(15):2 973-2 981.
[7]周云龙.植物生物学(第2版)[M].北京:高等教育出版社,2004:331-345.
[8]KENRICK P,CRANE P.The origin and early evolution of plant on land[J].Nature,1997,389(6 646):33-39.
[9]SCHAEFERd G,ZRYD J P.Efficient gene targeting in the mossPhyscomitrellapatens[J].PlantJ.,1997,11(6):1 195-1 206.
[10]WANG Xd(王晓丹),LÜ H Y(吕慧颖),ZHANG J(张敬).Comparative study on methods of extractingdNA from soybean leaf for PCR[J].MolecularPlantBreeding(分子植物育种),2004,2(6):81-894(in Chinese).
[11]YU Y ZH(余云舟),DU J(杜娟),WANG G(王罡).Studies on the freeze-thaw method of transforming recombinant plasmiddNA intoAgrobacteriumtumefaciens[J].JournalofJilinAgriculturalUniversity(吉林农业大学学报),2003,25(3):257-259,262(in Chinese).
[12]CLOUGH S J,BENT A F.Floraldip:a simplified method forAgrobacterium-mediated transformation ofArabidopsisthaliana[J].PlantJ.,1998,16(6):735-743.
[13]JEFFERSON R A.Assaying chimeric genes in plants:theGUSgene fusion system[J].PlantMol.Biol.Rep.,1987,5(4):387-405.
[14]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].AnalyticalBiochemistry,1976,72(1):248-254.
[15]RICHARD A J.Assaying ghimeric genes in plants:theGUSgene fusion system[J].PlantMolecularBiology,1987,37(6):387-405.
[16]XU L ZH(许兰珍),PENG A H(彭爱红),HE Y R(何永睿).Expression analysis of three phloem-specific promoters in transgenicPoncirustrifoliata[J].ActaHorticulturaeSinica(园艺学报),2014,41(1):1-8(in Chinese).
[17]BAULCOMBEd.RNA silencing in plants[J].Nature,2004,431(7 006):356-363.
[18]ADENOT X,ELMAYAN T,LAURESSERGUESd.DRB4-dependent TAS3 trans-acting siRNAs control leaf morphology through AGO7[J].Curr.Biol.,2006,16(9):927-932.
[19]SHI Z Y,WANG J,WAN X S.Over-expression of riceOsAGO7 gene induces upward curling of the leaf blade that enhanced erect-leaf habit[J].Planta,2007,226(1):99-108.
[20]ZHANG X L,DOUGLAS R N,STRABLE J.PUNCTATE VASCULAR EXPRESSION1 (PVE1) is a novel maize gene required for leaf pattern formation that functionsdownstream of the ta-siARF pathway[J].PlantPhysiol.,2012,159(4):1 453-1 462.
[21]XIANG Y(向娅),XIAN ZH Q(先志强),LINd B(林冬波).Cloning and expression analysis of SlAGO7 in tomato[J].ChineseJournalofTropicalCrops(热带作物学报),2013,34(4):641-647(in Chinese).
[22]QU F,YE X,MORRIS T J.ArabidopsisdRB4,AGO1,AGO7,and RDR6 part icipat e in adCL4- initiated antiviral RNA silencing pathway negatively regulated bydCL1[J].Proc.Natl.Acad.Sci.USA,2008,105(38):14 732-14 737.
[23]ABE H,YAMAGUCHI-S K,URAO T.Role ofArabidopsisMYC and MYB homologs indrought- and abscisic acid-regulated gene expression[J].PlantCell,1997,9(10):1 859-1 868.
(编辑:宋亚珍)

《西北植物学报》2014年第1~12期共发表论文365篇(含英文论文7篇),论文共获得763个各类研究基金项目的支持,平均每篇论文获基金项目达2.09个。有357篇论文均获得各类研究基金的支持,占刊载论文总数的97.8%。其中,106篇论文有1项基金支持,占论文总数的29.0%;132篇论文有2项基金支持,占论文总数的36.2%;119篇论文获3项以上基金支持,占论文总数的32.6%。《西北植物学报》2014年刊载论文的基金论文比为0.978。论文基金的具体来源统计结果如下:
(南红梅供稿)
