拟南芥GH3.9基因的过表达及其表型分析
2016-01-12周苹,唐冬英,郭明等
*通信作者:刘选明,博士,教授,主要从植物分子生物学方向研究。E-mail:xml05@hnu.edu.cn
拟南芥GH3.9基因的过表达及其表型分析
周苹,唐冬英,郭明,谭振华,赵小英,刘选明*
(湖南大学 生物学院,植物功能基因组学与发育调控湖南省重点实验室,长沙 410082)
摘要:为研究GH3.9基因在植物生长发育过程中的作用,利用RT-PCR成功克隆到GH3.9基因,该基因全长为1 750 bp。通过构建pEGAD-GH3.9过表达载体转化拟南芥,获得过表达GH3.9基因纯系转基因株系GH3.9ox-3和GH3.9ox-7。对拟南芥野生型(WT)和转基因株系(GH3.9ox-3和GH3.9ox-7)幼苗用不同光强和光质进行处理,结果显示:在蓝光、红光、远红光等不同光照强度下培养,过表达株系幼苗下胚轴的生长均明显受到抑制,且较野生型明显;采用不同光周期处理拟南芥幼苗,过表达幼苗下胚轴的伸长明显低于野生型;对成年植株表型进行观察,发现过表达株系植株矮小、雄蕊变短、果荚短小。研究表明:GH3.9基因参与了拟南芥生长发育调控,过表达GH3.9基因对拟南芥生长有抑制作用。
关键词:拟南芥;GH3.9基因;过表达;表型分析
收稿日期:2014-10-15;修改稿收到日期:2015-01-18
基金项目:湖南省自然科学基金(11JJA002);湖南省生物发育工程及新产品研发协同创新中心(20134486)
作者简介:周苹(1972-),女,硕士,实验师,主要从事生物化学与分子生物学研究。E-mail:76615803@qq.com
中图分类号:Q785;Q789 文献标志码:A
Overexpression and Phenotype Analysis ofGH3.9
Gene inArabidopsisthaliana
ZHOU Ping,TANGdongying,GUO Ming,TAN Zhenhua,ZHAO Xiaoying,LIU Xuanming*
(Hunan Province Key Laboratory of Plant Functional Genomics anddevelopmental Regulation,College of Biology,Hunan University,Changsha 410082,China)
Abstract:To investigate the role of GH3.9 in plant growth anddevelopment,we cloned the 1 750 bp full-length gene with RT-PCR method and obtained GH3.9ox-3 and GH3.9ox-9 pure lines of Arabidopsis thaliana by constructing pEGAD-GH3.9 overexpression vector and transforming A.thaliana.After treating the sowed wild-type and mutant seeds (GH3.9ox-3 and GH3.9ox-9) with blue,red and far-red light atdifferent intensity,we found that:the growth of hypocotyls in the mutants was more sensitive to the strong light suppression comparing with wild-type.Moreover,the hypocotyls of mutants appeared to grow slower when treateddifferent forms of white light.The mutants plant sizes and silique sizes appeared smaller.The results indicate that GH3.9 gene might play an important role in the growth anddevelopment of plants.
Key words:Arabidopsisthaliana;GH3.9 gene;overexpression;phenotype analysis
植物生长素能够诱导一些基因快速高表达,这些基因被称为生长素早期响应基因(primary-response genes)[1]。一般在生长素处理后2~3 min就能检测到基因的表达,进而调控植物相关基因的后续表达,影响植物的生长发育[2]。植物的GH3基因是一种典型的植物生长素早期响应基因[3]。第一个GH3基因于1987年在大豆中被发现,后来又陆续在水稻、拟南芥等植物中发现GH3基因家族成员。目前在拟南芥的基因组中包括20个GH3基因,据其序列的相似性分为3个亚族[4]。拟南芥大部分GH3蛋白都具有一种或多种植物生长素的氨基酸化合成酶活性[5-6],并参与光信号反应途径[7]。氨基酸化的生长素不具有生物活性,其中部分可以经蛋白水解酶水解成活性生长素,另外一部分被分解代谢。GH3蛋白的氨基酸化合成酶的作用和蛋白水解酶的共同作用维持了拟南芥体内生长素的动态平衡[8]。
GH3.9基因位于拟南芥的2号染色体上,属于GH3基因家族的II类,能催化IAA腺苷化以及与氨基酸的连接。研究表明,GH3.9基因的功能缺失突变体仅表现为初生根伸长,对IAA敏感性增强,在形态上没有多大变化[9-10]。本研究通过构建拟南芥GH3.9基因的过表达载体,获得了过表达的纯合株系,并从光质、光强、光周期等方面对拟南芥下胚轴发育的影响进行了分析,以期探讨该基因是否参与了拟南芥光信号反应途径和生长发育调控。
1材料和方法
1.1 材 料
本实验所用的野生型拟南芥(Arabidopsisthaliana)为Columbia-4生态型。
1.2 方 法
1.2.1拟南芥材料的收集和处理将拟南芥种子用75%酒精浸泡30 s,再用10% NaClO浸泡10 min,吸出浸泡液后,用无菌水洗4~6次,放入4 ℃冰箱处理4d。0.1%琼脂悬浮种子,然后直接将种子播在含0.8%琼脂的固体MS培养基表面,置22 ℃光照培养箱培养。用于观察成年植株表型的拟南芥,直接播种在土壤中,22 ℃长日照培养室培养。
1.2.2RNA提取和cDNA合成收集16d的野生型拟南芥幼苗,用RNAeasy Mini Kit按照说明提取总RNA,采用M-MLV逆转录系统合成cDNA,用作目的基因克隆的模板。根据Tair(http://arabidopsis.org/)中公布的拟南芥基因组序列设计PCR扩增引物,上游引物F1(5′-CCGAATTCATGGATGTAATGAAGCTTGATCACG-3′,引入EcoRⅠ酶切位点)和下游引物R1(5′-TTGGATCCTCATGGAACCCAAGTCGGGTC-3′,引入BamHⅠ酶切位点)。反应条件为:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸110 s,38个循环,72 ℃延伸5 min。扩增后的产物取10 μL进行琼脂糖凝胶电泳分析。
1.2.3植物过表达载体的构建根据回收试剂盒操作指南回收PCR产物,将纯化的已回收PCR片段与pGEM-T载体连接,连接产物转化大肠杆菌DH5α,经蓝白斑筛选鉴定,将阳性克隆送上海生物工程技术有限公司测序,所得序列分别在TAIR和GenBank进行Blast对比分析。将测序正确的质粒和pEGAD载体进行EcoRⅠ和BamHⅠ双酶切,分别纯化回收pEGAD载体线性片段和GH3.9基因片段,然后用T4连接酶连接,构建成由35S启动子驱动的含有GH3.9基因的植物表达载体。产物转化大肠杆菌DH5α,并在含有卡那霉素、利福平的LB平板中筛选,获得阳性克隆。
1.2.4农杆菌转化和过表达纯合子的筛选将pEGAD-GH3.9阳性重组质粒1 μL和农杆菌GV3101感受态40 μL混合,然后转移到预冷的电击杯小槽内电击。菌液涂布于含有卡那霉素50 μg/mL、利福平50 μg/mL的LB平板上,28 ℃培养2~3d。扩大培养后进行菌液PCR验证。采用花序浸泡法转化拟南芥,成熟期收取转基因种子。
种子经表面消毒,置于4 ℃冰箱冷处理4d。播种在培养土中,待长出2片真叶,喷洒1∶1 000的Basta除草剂进行筛选,利用GH3.9基因特异性引物,通过RT-PCR对具有Basta抗性的阳性植株进行鉴定,筛选GH3.9基因过表达转基因株系。
1.2.5半定量RT-PCR分析采用RNAeasy Mini Kit提取总RNA,采用M-MLV逆转录系统合成cDNA。 将cDNA稀释10倍,20 μL PCR反应体系中加1 μL稀释的cDNA模板。用RT-PCR半定量检测GH3.9基因的mRNA水平,以持家基因Actin2的PCR产物作为分子内标(表1)。PCR反应程序为:94 ℃预变性5 min;接着94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸110 s;循环数为35个。反应结束后,取10 μL PCR反应液,在1.0%琼脂糖凝胶上进行电泳。RT-PCR反应及电泳重复3次。
1.2.6不同光照强度处理拟南芥幼苗野生型和过表达植株的种子播种后直接放置于光强度为0.1、1.0、10.0、100.0 μmol·m-2·s-1的蓝光、红光、远红光及黑暗条件下培养,各取20株6日龄幼苗,测量下胚轴长度。
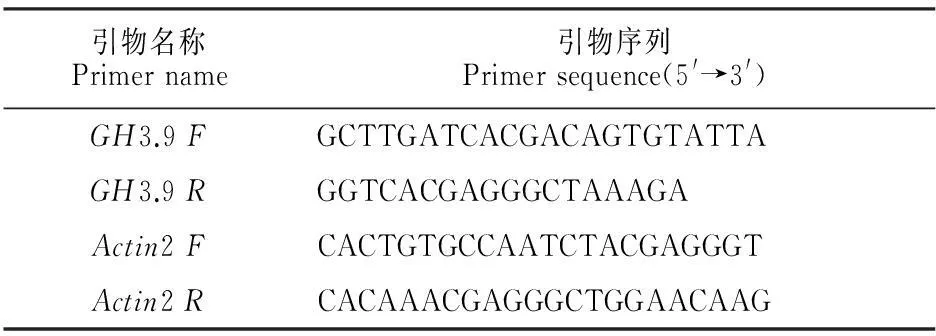
表1 RT-PCR引物
1.2.7不同光周期处理拟南芥幼苗野生型和过表达植株的种子播种后直接置于不同光周期处理,22 ℃恒温培养,随后各取20株7日龄幼苗,测量下胚轴长度。长日照处理为16 h光照,8 h黑暗;短日照处理为8 h光照,16 h黑暗。
2结果与分析
2.1 GH3.9基因的cDNA合成
以拟南芥Col-4野生型总RNA反转录产物cDNA为模版,PCR扩增1 750 bp的GH3.9基因全长,经琼脂糖凝胶电泳分析,扩增片段条带大小与理论大小一致(图1),说明利用RT-PCR已成功克隆到GH3.9基因。

图1 GH3.9基因扩增
2.2 GH3.9基因过表达突变体的构建及验证
将PCR扩增得到的GH3.9基因参照1.2.3方案导入到过表达载体pEGAD中,随后将筛选得到的pEGAD-GH3.9阳性重组质粒转入农杆菌GV3101中。用农杆菌浸花法转化拟南芥,经卡那霉素、利福平筛选获得纯合的过表达转基因株系用于后续实验。以Actin2为内参,采用半定量RT-PCR方法比较野生型和转基因植株GH3.9的表达情况,发现GH3.9基因确实在转基因植株中超表达(图2)。
2.3 不同光处理对 GH3.9基因过表达转基因拟南芥幼苗下胚轴伸长的影响
2.3.1不同光强和光质处理结果的比较图3显示,不同强度蓝光、红光、远红光处理后发现,在黑暗状态及0.1 μmol·m-2·s-1弱光照射下,过表达和野生型拟南芥幼苗下胚轴生长没有明显不同。强光下,和野生型相比,过表达株系下胚轴的伸长受到
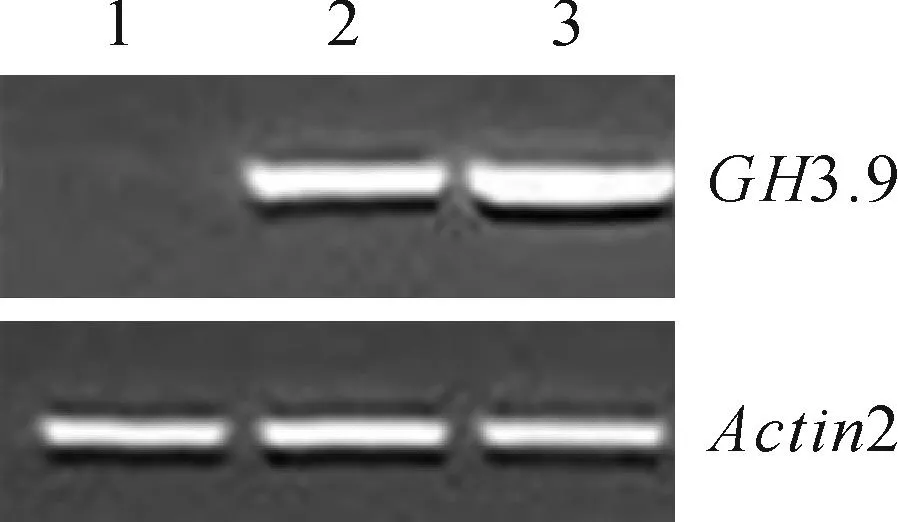
图2 转基因植株的RT-PCR鉴定

图3 不同光处理下拟南芥幼苗下胚轴生长
更强的抑制(图3)。可见,GH3.9基因的过表达突变体,对强光抑制下胚轴的伸长更加敏感,推测GH3.9基因可能参与植物的光信号转导。
2.3.2不同光周期处理的比较野生型和过表达植株的种子播种后,分别在长日照(16 h光照,8 h黑暗)和短日照(8 h光照,16 h黑暗)条件下培养。结果(图4)表明,与野生型相比,无论是哪种光周期

图4 不同日照条件下拟南芥幼苗各材料下胚轴长度比较

图5 长日照条件下拟南芥花各材料的
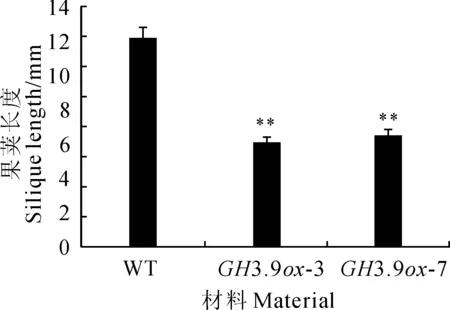
图6 拟南芥各材料果荚长度比较
下,过表达幼苗的下胚轴伸长都受到明显抑制(图版Ⅰ,A、B)。
2.4 GH3.9过表达转基因拟南芥表型分析
长日照培养下,收集成熟花20朵,雄蕊和雌蕊长度比(图5)显示,过表达转基因拟南芥的雄蕊明显变短(图版Ⅰ,C)。从成熟植株上直接收集成熟的果荚各20个,测量果荚长度,结果(图6)表明,野生型果荚要比过表达株系果荚长(图版Ⅰ,E),且过表达植株明显矮小(图版Ⅰ,D)。推测GH3.9基因过表达严重影响了植物的生长发育。
3讨论
光和生长素是影响植物生长发育的重要因素。其中,光调控转录因子与植物对生长素的反应相关,而生长素调控基因突变会影响光信号的传递。作为生长素早期响应基因,一方面 GH3蛋白通过调节游离生长素的浓度来实现对活性生长素的调控[4],这是因为GH3蛋白具有生长素氨基酸化酶活性,可以将氨基酸结合到生长素上,使其失去活性,以维持植物体内生长素的动态平衡[5];另一方面,GH3蛋白还参与光信号转导途径,通过影响植物对光的吸收来影响植物的生长发育[8]。通过对部分GH3基因过表达突变体研究发现,他们的表型跟野生型相比都有很明显的区别,例如根系变短、侧根变少、植株矮小[11-12]。
GH3.9基因作为拟南芥GH3基因家族20个基因中的第9号基因,目前对它的研究尚不够深入。我们通过前期对GH3.9基因的生物信息学分析发现,GH3.9基因的转录调控区域存在大量与光反应相关的调控元件,如G-box、GT1-motif、TCT-motif、GA-motif,推测植物GH3.9基因参与了光信号转导途径。本研究通过构建过表达GH3.9载体,筛选得到纯系过表达GH3.9植株。结果发现:在蓝光、红光、远红光等不同光照强度培养下,过表达植株幼苗下胚轴抑制均较野生型明显;而黑暗情况下,GH3.9基因过表达幼苗下胚轴发育与野生型相比无明显差异。进一步证明了该基因参与光对拟南芥生长发育的调控。同时还发现,正常光照下过表达GH3.9植株果荚短小、雄蕊变短、植株矮小,表明植物各个器官的生长发育均受抑制。推测过量表达的GH3.9蛋白除了通过光信号转导途径,还通过催化过多的游离生长素氨基酸化影响植物体内生长素动态平衡,进而抑制生长素信号途径,导致拟南芥形态的变化和生长发育抑制。我们的后续实验将对GH3.9基因的光以及生长素信号转导途径的具体调节机制进行深入探讨。
参考文献:
[1]SUN T(孙涛),CHAI T Y(柴团耀),LIU G Y(刘戈宇),etal.Progress in theGH3 gene family[J].ChineseJournalofBiotechnology(生物工程学报),2008,24(11):1 860-1 866(in Chinese).
[2]RAMOD J A,ZENSER N,LEYSER O,etal.Rapiddegradation of auxin/indoleacetic acid proteins requires conserved amino acids ofdomain Ⅱ and is proteasomedependent[J].ThePlantCell,2001,13(10):2 349-2 360.
[3]GUILFOYLE T J.Auxin-regulated genes and promoters[C]//HOOYKAAS P J J,HALL MA,LI- BBENGA K R.Biochemistry and molecular biology of plant hormones[J].Amsterdam:Elsevier,1999:423-459.
[4]HAGEN G,GUILFOYLE T.Auxin-responsive gene expression:genes,promoters and regulatory factors[J].PlantMolecularBiology,2002,49(3/4):373-385.
[5]STASWICK P E,SERBAN B,ROWE M,etal.Characterization of anArabidopsisenzyme family that conjugates amino acids to indole-3-acetic acid[J].ThePlantCell,2005,17(2):616-627.
[6]STASWICK P E,TIRYAKI I.The oxylipin signal jasmonic acid is activated by an enzyme that conjugates it to isoleucine inArabidopsis[J].ThePlantCell,2004,16(8):2 117-2 127.
[7]TAKASE T,NAKAZAWA M,ISHIKAWA A,etal.Ydk 1-D,an auxin-responsive GH3 mutant that is involved in hypocotyl and root elongation[J].ThePlantJournal,2004,37(4):471-483.
[8]LI Y(黎颖),ZUO K J(左开井),TANG K X(唐克轩).A survey of functional studies of theGH3 gene family in plants[J].ChineseBulletinofBotany(植物学通报),2008,25(5):507-515(in Chinese).
[9]KHAN S,STONE J M.ArabidopsisthalianaGH3.9 influences primary root growth[J].Planta,2007,226(1):21-34.
[10]BIERFREUND N M,TINTELNOT S,RESKI R,etal.Loss of GH3 functiondoes not affect phytochrome-mediateddevelopment in a moss,Physcomitrella patens[J].JournalofPlantPhysiology,2004,161(7):823-835.
[11]NAKAZAWA M,YABE N,ICHIKAWA T,etal.DFL1,an auxin-responsiveGH3 gene homologue negatively regulates shoot cell elongation and lateral root formation,and positively regulates the light response of hypocotyl length[J].ThePlantJournal,2001,25(2):213-221.
[12]PARK J E,SEO P J,LEE A K,etal.AnArabidopsisGH3 gene,encoding an auxin-conjugating enzyme,mediates phytochrome B-regulated light signals in hypocotyl growth[J].PlantandCellPhysiology,2007,48(8):1 236-1 241.

图版 Ⅰ拟南芥幼苗及成熟植株表型分析
每张图从左至右均依次为:拟南芥野生型、拟南芥过表达植株GH3.9ox-3和GH3.9ox-7
A.长日照下拟南芥幼苗;B.短日照下拟南芥幼苗;C.拟南芥花朵;D.50d龄拟南芥植株;E.拟南芥果荚。
Plate ⅠSeedlings and phenotype analysis ofA.thaliana
From left to right,they are wild-type,GH3.9ox-3 andGH3.9ox-7
Fig.A.Seedlings in longday;Fig.B.Seedlings in shortday;Fig.C.Flowers;Fig.D.50-old-day plants;Fig.E.Siliques.
(编辑:宋亚珍)
