肌球蛋白轻链激酶在急性坏死性胰腺炎大鼠小肠黏膜的表达及其作用
2016-01-11石慧荣,唐国都,覃蒙斌等
·论著·
肌球蛋白轻链激酶在急性坏死性胰腺炎大鼠小肠黏膜的表达及其作用
石慧荣唐国都覃蒙斌梁志海
【摘要】目的探讨肌球蛋白轻链激酶(MLCK)在急性坏死性胰腺炎(ANP)大鼠小肠黏膜的表达及其作用机制。方法56只雄性SD大鼠按数字表法随机分为对照组和ANP组。采用4%牛磺胆酸钠胰胆管逆行注射法制备ANP大鼠模型,以仅翻动胰腺作为对照组。造模后6、12、24、48 h分批处死大鼠,取血测定血清淀粉酶、TNF-α、IL-1β、二胺氧化酶(DAO)水平;取胰腺、小肠组织行病理学检查;电镜下观察小肠黏膜肠上皮细胞的超微结构及上皮细胞间紧密连接(TJ);免疫组织化学法测定小肠黏膜MLCK蛋白表达。结果与对照组比较,ANP组12 h点大鼠血清淀粉酶活性、TNF-α水平、IL-1β水平、DAO活性均显著升高,分别为(4 978±1 574)U/L比(1 176±124))U/L、(47.88±15.85)μg/L比(17.24±1.99)μg/L、(132.48±68.54)μg/L比(23.51±6.44)μg/L、(95.96±30.84)U/L比(38.06±17.73)U/L;胰腺、小肠病理学评分显著增加[(12.2±1.80)比(4.68±0.35)分,(2.58±0.52)比(0.58±0.26)分];小肠黏膜组织MLCK蛋白表达显著上调(0.1863±0.0230比0.1636±0.0049),差异均有统计学意义(P值均<0.05)。其他各时间点上述指标两组间差异也均有统计学意义(P值均<0.05)。ANP组大鼠肠上皮细胞的超微结构破坏明显,上皮细胞间TJ显著增宽。结论ANP大鼠血清TNF-α、IL-1β、DAO水平上调,小肠黏膜组织MLCK蛋白表达上调,由此可能通过破坏肠上皮细胞间紧密连接的完整性引起肠黏膜屏障功能障碍。
【关键词】胰腺炎,急性坏死性;紧密连接部;肌球蛋白轻链激酶;肠屏障
DOI:10.3760/cma.j.issn.1674-1935.2015.02.009
基金项目:国家自然科学基金(81260087)
收稿日期:(2014-09-24)
Expression and role of MLCK in small intestine mucosa in rats with acute necrotizing pancreatitisShiHuirong,TangGuodu,QinMengbin,LiangZhihai.DepartmentofGastroenterology,FirstAffiliatedHospital,GuangxiMedicalUniversity,Nanning530021,China
Correspondingauthor:TangGuodu,Email:tguodu02@126.com
Abstract【】ObjectiveTo explore the expression and function of myosin light streptokinase (MLCK) in small intestine mucosa of acute necrotizing pancreatitis (ANP) rats. MethodsFifty-six male SD rats were randomly assigned to control group and ANP group. A rat model of ANP was reproduced by retrograde injection of 4% sodium taurocholate into the biliopancreatic duct, while the control group underwent a sham operation. The rats were sacrificed at 6th, 12th, 24th, 48th hour after ANP induction. Serum amylase、TNF α, IL 1β, diamine oxidase (DAO) were measured. The pathological scores in the pancreas and small intestine were observed. The ultrastructure and tight junction (TJ) changes in the small intestine mucosa were observed with an electron microscope. The localization and expression of MLCK in small intestine mucosa was determined by immunohistochemistry method. ResultsCompared to the control group, the serum amylase, TNF-α, IL-1β, DAO level, in the ANP group were all significantly increased; [(4 978±1 574)U/L vs (1 176±124))U/L, (47.88±15.85)μg/L vs (17.24±1.99)μg/L, (132.48±68.54)μg/L vs (23.51±6.44)μg/L, (95.96±30.84)μg/Lvs(38.06±17.73)U/L at 12 h], and the pathology scores of pancreas and small intestine were both significantly elevated [12 h: (12.2±1.80) vs (4.68±0.35), (2.58±0.52) vs (0.58±0.26)] (P<0.05); the MLCK protein expression in small intestine mucosa was significantly increased in ANP group (12 h: 0.1863±0.0230vs0.1636±0.0049), and the difference was statistically significant (P<0.05). The small intestine ultrastructure was seriously damaged and TJ was widened significantly in ANP Group. ConclusionsThe increased serum TNF alpha and IL-1β concentration and DAO activity and up-regulated MLCK protein expression in small intestine mucosa may damage the integrity of tight junction of intestinal epithelial cell and cause intestine mucosa barrier dysfunction.

作者单位:530021南宁,广西医科大学第一附属医院消化科
通信作者:唐国都, Email:tguodu02@126.com
【Key words】Pancreatitis, acute necrotizing;Tight junctions;Myosin-light-chain kinase;Intestine barrier
重症急性胰腺炎(SAP)是临床常见急危重症之一,病程发展迅速,病情凶险,病死率高。SAP早期肠道缺血-再灌注可导致肠屏障功能损害,肠壁通透性增加,细菌或内毒素易位,造成肠源性感染,使胰腺组织继发感染,进而启动全身炎症反应综合征(SIRS),并引起多器官功能障碍综合征(MODS)[1-2],加重病情。因此,积极恢复和维持肠黏膜屏障功能在SAP治疗中非常必要。上皮细胞间紧密连接(tight junction, TJ)是维持肠黏膜屏障的重要结构基础,是决定肠壁通透性大小的主要因素。由肌球蛋白轻链激酶(myosin light chain, MLCK)诱导的肌球蛋白轻链(myosin light chain, MLC)磷酸化导致的TJ开放和细胞骨架的收缩是肠上皮屏障破坏的必需因素[3]。本研究检测急性坏死性胰腺炎(ANP)大鼠小肠MLCK蛋白表达,观察肠上皮细胞间TJ结构改变,探讨MLCK对小肠上皮细胞间TJ的调节作用及其对肠屏障功能的影响。
材料和方法
一、实验动物及分组
雄性SD大鼠56只,体质量250~300 g,清洁级,购自广西医科大学实验动物中心。大鼠适应性饲养1周,术前禁食12 h,自由饮水。按数字表法随机分为对照组、ANP组。采用4%牛磺胆酸钠(日本TCI公司)1 ml/kg体质量逆行胰胆管注射的方法制备ANP模型。对照组大鼠于开腹后用镊子轻翻动十二指肠及胰腺后关腹。术后皮下注射生理盐水10 ml/kg体质量。术后6、12、24、48 h分批处死大鼠,每个时点7只。右心房采血,离心取上清,置-80℃冰箱备用。取胰腺及回盲部以上5 cm左右的小肠组织,部分置甲醛液固定,部分置3%戊二醛液固定。
二、血淀粉酶、TNF-α、IL-1β、二胺氧化酶检测
血清淀粉酶活性用全自动生物化学检测仪测定。TNF-α、IL-1β水平采用ELISA方法测定,试剂盒购自欣博盛生物公司。二胺氧化酶(diamine oxidase, DAO)活性采用ELISA方法测定,试剂盒购自南京建成生物工程研究所,按说明书操作。
三、胰腺、小肠组织病理学检查
取固定的胰腺、小肠组织,常规石蜡包埋、切片,HE染色。参考Schmidt等[4]标准从水肿、炎性细胞浸润、出血及坏死4个方面对胰腺组织进行病理评分;参考Chiu等[5]标准从黏膜、绒毛损伤及炎症、出血等方面对小肠组织进行病理评分。
四、小肠组织超微结构观察
取固定的小肠组织,制备超薄切片,于透射电镜下观察肠上皮细胞的超微结构及细胞间TJ。
五、小肠黏膜组织MLCK表达检测
采用常规免疫组化法检测小肠组织MLCK蛋白的表达。兔抗大鼠MLCK多克隆抗体购自Sigma公司,工作浓度1∶200;即用型SP-9000免疫组化检测试剂盒及DAB试剂盒均购自北京中杉金桥公司。用PBS代替一抗作为阴性对照。肠上皮细胞胞质内出现棕黄色颗粒为阳性表达。每张切片在高倍镜下随机取5个视野,应用美国Imagepro plus 6.0专业图像分析软件获取每个视野的光密度值,取均值。
六、统计学处理
结 果
一、血淀粉酶、TNF-α、IL-1β、DAO水平的变化
与对照组比较,ANP组各时间点大鼠的血清淀粉酶、TNF-α、IL-1β、DAO水平均于造模后明显上升,显著高于相应时间点的对照组(P值均<0.05)。淀粉酶于术后6 h达峰值,TNF-α于12 h达峰值,IL-1β、DAO于24 h达峰值,并持续处于高水平(表1)。


指 标时间点(h)对照组(28只)ANP组(28只)t值P值淀粉酶(U/L)61841±1816015±1216-8.3390.001121176±1244978±1574-5.9000.002241360±2784225±647-9.2260.001481148±912125±805-2.9830.015TNF-α(μg/L)6 11.26±2.7629.43±5.83-5.6310.00112 17.24±1.99 47.88±15.85-3.8360.03024 9.19±3.98 47.69±21.11-3.5850.01248 12.45±3.5224.53±6.59-3.2070.018IL-1β(μg/L)6 26.91±16.01 91.25±44.01-2.7480.03312 23.51±6.44132.48±68.54-3.1660.04924 18.02±3.11204.06±76.71-5.1000.00248 37.67±21.26 85.78±44.27-2.8390.049DAO(U/L)6 36.96±9.36 79.62±15.03-5.5970.00112 38.06±17.73 95.96±30.84-3.3140.01324 57.76±8.02 153.30±30.67-6.7910.00148 33.35±11.12 45.66±12.52-2.6670.037
二、胰腺、小肠组织病理改变
对照组大鼠胰腺小叶完整,未见出血、坏死,偶有轻度水肿及少量炎性细胞浸润;ANP组大鼠胰腺间质增宽,腺小叶结构破坏,炎性细胞浸润,局灶或大片出血坏死。对照组大鼠小肠黏膜结构完整,未见固有层水肿及绒毛脱落,偶见绒毛顶端上皮下间隙增宽;ANP组大鼠小肠黏膜结构破坏,上皮下间隙增宽,固有层水肿、裸露,绒毛脱落,固有层出血及炎症细胞大量聚集。与对照组比较,ANP组各时间点大鼠的胰腺、小肠组织病理评分均显著高于同时间点的对照组,差异均有统计学意义(P值均<0.05)。 胰腺组织损伤于术后12 h最严重,小肠组织损伤于24 h最严重 (表2)。
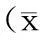
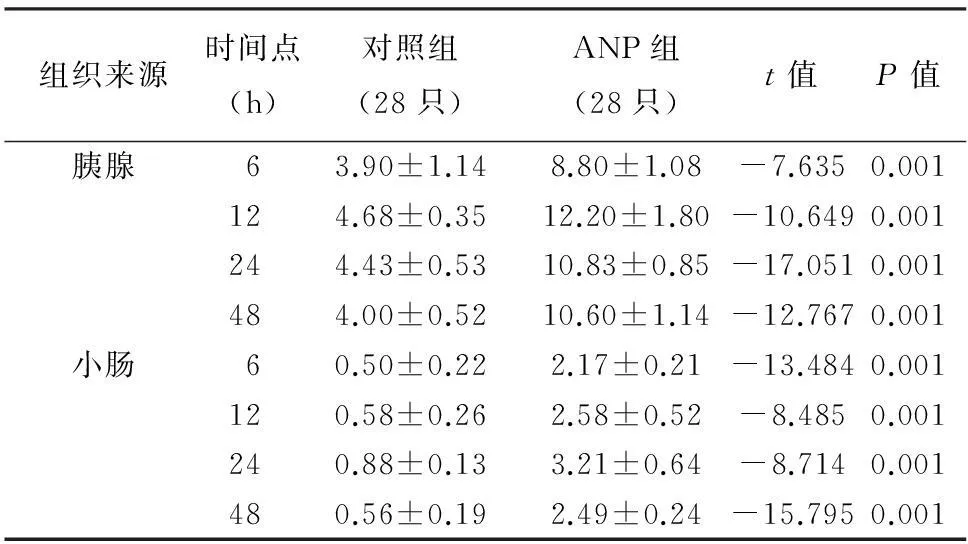
组织来源时间点(h)对照组(28只)ANP组(28只)t值P值胰腺63.90±1.148.80±1.08-7.6350.001124.68±0.3512.20±1.80-10.6490.001244.43±0.5310.83±0.85-17.0510.001484.00±0.5210.60±1.14-12.7670.001小肠60.50±0.222.17±0.21-13.4840.001120.58±0.262.58±0.52-8.4850.001240.88±0.133.21±0.64-8.7140.001480.56±0.192.49±0.24-15.7950.001
三、小肠组织超微结构及上皮细胞间TJ改变
对照组大鼠小肠黏膜超微结构未见明显改变,肠上皮微绒毛发达, 排列整齐;细胞内线粒体、内质网等结构未见异常;细胞间TJ可见,宽度无明显变化。ANP组小肠黏膜微绒毛破坏、减少、变短、缺失;细胞内线粒体肿胀、空泡变性,内质网扩张、脱粒, 细胞器明显减少;肠上皮细胞间TJ增宽(图1)。与对照组比较,ANP组各时点大鼠小肠上皮细胞间TJ均显著增宽,以24 h时的TJ增宽最明显。

图1 对照组(上)及ANP组(下)大鼠6(1A)、12(1B)、24(1C)、48 h(1D)时小肠黏膜上皮细胞的超微结构及细胞间TJ的改变(×50000)
四、小肠黏膜组织MLCK表达
对照组大鼠小肠组织不表达或弱阳性表达MLCK蛋白。ANP组大鼠小肠上皮细胞胞质内出现棕黄色颗粒,呈阳性表达(图2)。对照组大鼠6、12、24、48 h点小肠黏膜组织MLCK的相对表达量分别为0.1568±0.0028、0.1636±0.0049、0.1929±0.0024、0.1865±0.0074;ANP组大鼠分别为0.1680±0.0089、0.1863±0.0230、0.1995±0.0105、0.1947±0.0054。与对照组比较,ANP组大鼠小肠黏膜MLCK的表达量于造模后即上升,24 h达峰值,并持续处于高水平,较对照组同时间点显著增加,差异均有统计学意义(F值分别为-5.272、-3.340、-2.270、-2.445,P值均<0.05)。
讨 论
肠黏膜上皮屏障是体内重要的生物防御屏障,在抵御肠腔内细菌或内毒素易位中起重要作用。它主要包括完整的肠上皮细胞(intestinalepithelialcell,IEC)和上皮细胞间连接,包含TJ、黏附连接和缝隙连接等,其中TJ为最主要连接方式。TJ位于上皮细胞膜外侧顶部,是多蛋白结构复合体,其主要功能是只允许离子及小分子可溶性物质通过,不允许毒性大分子及微生物通过。此特殊生理功能在SAP病程中能防止细菌、内毒素、炎症介质的侵入。本研究建立了ANP大鼠模型,电镜下观察到ANP大鼠小肠黏膜上皮细胞的超微结构发生明显改变,肠黏膜微绒毛被破坏,肠上皮细胞间TJ增宽,提示ANP大鼠肠黏膜屏障功能损伤存在小肠上皮细胞间TJ的改变。

图2 对照组(2A)及ANP组大鼠6(2B)、12(2c)、24(2D)、48 h(2E)时小肠黏膜组织MLCK的表达(免疫组化 ×400)
MLCK是丝氨酸/苏氨酸蛋白激酶家族成员,是位于胞膜的钙调素依赖酶,能调节MLC磷酸化。MLC发生磷酸化后可活化肌球蛋白重链头部ATP,产生的能量使细胞骨架肌动蛋白微丝滑动,细胞收缩,通透性改变。因此,MLC磷酸化在细胞间TJ相关蛋白的调控及肠上皮屏障功能紊乱中起着重要作用[6-7]。MLCK诱导的MLC磷酸化水平升高被认为是肠上皮屏障通透性增加的重要分子基础[8],对维持TJ的完整性起着重要作用[9]。Shen等[10]建立胞膜MLCK持续高表达的体外细胞模型,观察到肠黏膜屏障功能受损。Clayburgh等[11]通过敲除MLCK基因和利用特异性MLCK抑制剂的方法均能减轻肠上皮细胞TJ的损伤。Moriez等[12]研究表明,MLCK特异性抑制剂能抑制内毒素血症状态下的肠黏膜菌群易位、减轻肠黏膜通透性的增加,并减轻细胞间TJ的损伤。
TNF-α和IL-1β可增加MLC磷酸酶转录和激活MLCK活性,上调MLCK蛋白表达,引起MLC磷酸化增加及TJ相关蛋白重新分布,改变TJ的结构及完整性[13-14],导致肠上皮细胞TJ的收缩和开放,增加肠道通透性[15-16]。DAO是位于肠黏膜上绒毛细胞中高度活性的细胞内酶,主要存在于回肠黏膜绒毛,其活性与黏膜细胞的核酸和蛋白质合成密切相关,能反映肠黏膜完整性和损伤程度[17]。当小肠上皮完整性受到破坏,小肠黏膜上皮内的DAO则会释放入血,因此,血液中DAO水平可以间接反映肠黏膜上皮细胞的完整性及肠屏障功能[18]。本研究结果表明,ANP大鼠中血清TNF-α、IL-1β、DAO水平均升高,与小肠病理损伤及超微结构动态改变一致,进一步证实ANP大鼠存在肠屏障功能障碍。
参考文献
[1]Liu H, Li W, Wang X, et al. Early gut mucosal dysfunction in patients with acute pancreatitis[J]. Pancreas, 2008,36(2):192-196.
[2]Mole DJ, Taylor MA, McFerran NV, et al. The isolated perfused liver response to a ‘second hit’ of portal endotoxin during severe acute pancreatitis[J]. Pancreatology, 2005,5(4-5):475-485.
[3]Boivin MA, Ye D, Kennedy JC, et al. Mechanism of glucocorticoid regulation of the intestinal tight junction barrier[J]. Am J Physiol Gastrointest Liver Physiol,2007,29(2):G590-G598.
[4]Schmidt J, Rattner DW, Lewandrowski K, et al. A better model of acute pancreatitis for evaluating therapy[J]. Ann Surg,1992,215(1):44-56.
[5]Chiu CJ, McArdle AH, Brown R, et al. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal[J]. Arch Surg, 1970,101(4):478-483.
[6]Matsumura F, Hartshorne DJ. Myosin phosphatase target subunit: Many roles in cell function[J]. Biochem Biophys Res Commun,2008,369(1):149-156.
[7]Goeckeler ZM, Bridgman PC, Wysolmerski RB. Nonmuscle myosin II is responsible for maintaining endothelial cell basal tone and stress fiber integrity[J]. Am J Physiol Cell Physiol,2008,295(4):C994-C1006.
[8]Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application[J]. Am J Pathol, 2006,169(6):1901-1909.
[9]Shen L, Turner JR. Role of epithelial cells in initiation and propagation of intestinal inflammation. Eliminating the static: tight junction dynamics exposed[J]. Am J physiol Gastrointest Liver Physiol, 2006,290(4):G577-G582.
[10]Shen L, Black ED, Witkowski ED, et al. Myosin light chain phosphorylation regulates barrier function by remodeling tight junction structure[J]. J Cell Sci,2006,119(Pt 10):2095-2106.
[11]Clayburgh DR, Barrett TA, Tang Y, et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo[J]. J Clin Invest, 2005,115(10):2702-2715.
[12]Moriez R, Salvador-Cartier C, Theodorou V, et al. Myosin light chain kinase is involved in lipopolysaccharide-induced disruption of colonic epithelial barrier and bacterial translocation in rats[J]. Am J Pathol, 2005,167(4):1071-1079.
[13]Ye D, Ma TY. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity[J]. J Cell Mol Med, 2008,12(4):1331-1346.
[14]Gilbert S, Zhang R, Denson L, et al. Enterocyte STAT5 promotes mucosal wound healing via suppression of myosin light chain kinase-mediated loss of barrier function and inflammation[J]. EMBO Mol Med,2012,4(2):109-124.
[15]Chen ML, Ge Z, Fox JG, et al. Disruption of tight junctions and induction of proinflammatory cytokine responses in colonic epithelial cells by Campylobacter jejuni[J]. Infect Immun, 2006,74(12):6581-6589.
[16]Turner JR. Intestinal mucosal barrier function in health and disease[J]. Nat Rev Immunol, 2009,9(11):799-809.
[17]张兴文, 王湘英, 卢义展, 等. 清胰汤对急性出血坏死性胰腺炎大鼠肠屏障功能障碍的保护作用[J]. 中国现代医学杂志,2011,21(11):1339-1342.
[18]Goto T, Matsubara T, Yoshizawa Y, et al. Diamine oxidase as blood biomarker in rats and humans to GI tract toxicity of fluorouracil anti-cancer drugs[J]. Gan To Kagaku Ryoho, 2011,38(5):765-769.
(本文编辑:吕芳萍)
