产纤维素酶酵母菌的筛选及鉴定
2016-01-09张璐璐卫旭彪张日俊
■张璐璐 卫旭彪 马 广 张日俊
(中国农业大学饲料生物技术实验室动物营养学国家重点实验室,北京 100193)
随着人们生活水平的提高,玉米纤维和豆渣的产量逐年升高。固态发酵玉米纤维、豆渣作为动物饲料成为高效利用粮食加工副产物的一种重要生产方式。工业生产中菌种的选择不但能够影响发酵后饲料的感官并且决定发酵后饲料的品质。以酵母菌作为发酵菌种,不仅能够提高发酵饲料的风味,还能够降解纤维素和生产菌体蛋白,提高饲料的利用价值[1]。酵母菌在饲料工业中有广泛的用途,易于在含糖量较高的偏酸性环境中生长。张亮等(2007)从实验室海洋酵母种库中筛选到一株CMC酶酶活为4.51 U/mg,滤纸酶酶活为4.75 U/mg的普鲁兰类酵母[2]。Sarawan等(2013)筛选到一株能产纤维素酶的假丝酵母菌KKUFW 10,在含有1.0%羧甲基纤维素的YPD培养基中发酵24 h所产纤维素酶酶活为58.24 U/ml[3]。酵母的代谢产物中含有丰富的维生素、氨基酸和促生长因子,然而关于产纤维素酶的酵母菌却鲜于报道。因此,本研究从高产纤维素酶菌株的筛选入手,对筛选到的菌株进行了形态学鉴定和分子生物学鉴定,生物学特性研究,为玉米纤维和豆渣的工业化生产提供了重要基础,对解决玉米纤维和豆渣的利用问题提供了必要前提,并具有重要的现实意义。
1 材料与方法
1.1 试验材料
米酒、酒糟、实验室保存菌种由中国农业大学饲料与生物技术实验室提供。
1.2 培养基及主要试剂配制
YPD培养基、孟加拉红培养基、CMC-Na培养基、BPY培养基、酵母菌液体发酵培养基(玉米粉20 g、酵母浸提物10 g、大豆蛋白胨20 g、麸皮5 g、1 000 ml蒸馏水、pH值6.0)、培养基Ⅰ[酵母浸提物10 g、大豆蛋白胨20 g、葡萄糖(单独灭菌)10 g、CMC-Na 5 g、pH值6.8、蒸馏水1 000 ml]、培养基Ⅱ(酵母浸提物10 g、大豆蛋白胨20 g、葡萄糖5 g、CMC-Na 10 g、蒸馏水1 000 ml、pH值6.0)、DNS试剂、pH值4.8乙酸缓冲液、10 mg/ml的葡萄糖标准贮备液、10 mg/ml的木糖标准贮备液。
1.3 产纤维素酶酵母菌的分离筛选
1.3.1 酵母菌的分离
取2 g或2 ml新鲜样品,加入盛有18 ml无菌生理盐水的三角瓶中,加灭菌玻璃珠,振荡2~3 min混匀,静置2 h,吸取5 ml上清液,加入无菌试管中。然后用无菌生理盐水按10倍稀释度逐级稀释至10-4、10-5、10-6梯度,在孟加拉红培养基上涂布,每个稀释度涂布3个平板,28℃、培养48 h,挑取具有酵母菌菌落特征且菌落较大的单菌反复在YPD培养基上划线分离至长出单菌落,并镜检确定菌体为纯菌后,进行YPD斜面保存。
1.3.2 产纤维素酶酵母菌的筛选
1.3.2.1 初筛
将分离到的酵母菌分别接种到装有30 ml YPD液体培养基的100 ml三角瓶中,在28℃、200 r/min振荡培养24 h后,按10倍逐级稀释并涂布于CMC-Na培养基上,放置28℃培养箱中培养72 h。采用0.2%的刚果红染色30 min,洗去染液,最后用5%醋酸溶液固定颜色。观察菌落周围是否产生透明圈,测量透明圈和菌落直径并计算其比值,挑选比值较大的菌落进行复筛。
1.3.2.2 复筛
将初筛到的产纤维素酶能力较强的菌株以1%的接种量接种于酵母菌液体发酵培养基中,28℃摇床200 r/min振荡培养48 h。发酵12 h后补加CMC-Na使培养基中CMC-Na的含量为0.5%左右。发酵后在 5 000 r/min的离心机上离心10 min,收集上清液即为待测粗酶液。测定纤维素内切葡聚糖酶酶活,选取酶活最大的为目标菌株。
1.4 酶活测定方法
1.4.1 葡萄糖标准曲线的绘制
利用10 mg/ml的葡萄糖标准液配制浓度分别为0、1、1.5、2、2.5、3、3.5 mg/ml一系列梯度的葡萄糖溶液,每一浓度3个平行,利用分光光度计在540 nm处测其吸光度,绘制葡萄糖标准曲线(见图1)。
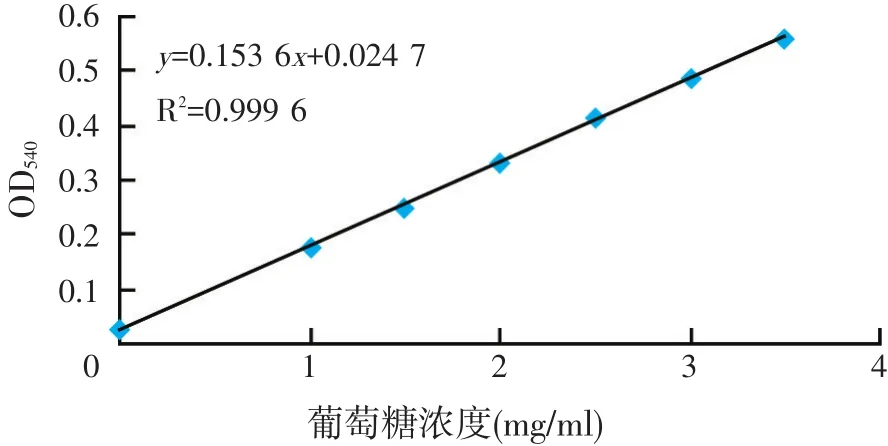
图1 葡萄糖浓度标准曲线
1.4.2 木糖标准曲线的绘制
利用10 mg/ml的木糖标准液配制浓度分别为0、1、1.5、2、2.5、3、3.5 mg/ml一系列梯度的木糖溶液,每一浓度3个平行,利用分光光度计在540 nm处测其吸光度,绘制木糖标准曲线(见图2)。
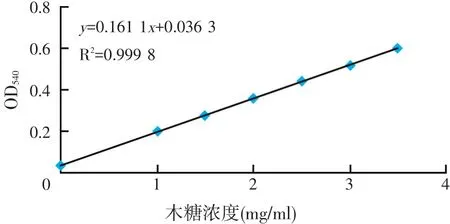
图2 木糖浓度标准曲线
1.4.3 粗酶液的制备
液体样品采取液态发酵后,离心,取上清液,即为粗酶液;固态样品采取固态发酵后取1.0 g发酵料加10 ml蒸馏水,室温下振荡浸泡1 h,离心,取上清液,即为粗酶液。
1.4.4 纤维素内切葡聚糖酶活力测定
取3支25 ml刻度的比色管,分别加入1.5 ml 1%的CMC-Na(pH值4.8乙酸缓冲液配制)。其中2支作为待测试管,在(50±0.5)℃恒温水浴锅中预热5 min,再加入0.5 ml粗酶液,另1支作为空白对照试管,同时置于(50±0.5)℃ 恒温水浴锅中水浴20 min,然后取出3支试管,并把空白对照试管迅速放入冰水中,向待测试管中加入3 ml DNS。待空白对照试管冷却后加入0.5 ml粗酶液和3 ml DNS。将三支试管沸水浴5 min后,迅速放入冰水中冷却,加蒸馏水至25 ml,以空白对照试管调零,在540 nm波长下测量OD值。
1.4.5 纤维素外切葡聚糖酶活力测定
取3支25 ml刻度的比色管,分别加入50 mg的脱脂棉球和1.5 ml乙酸冲液。其中2支作为待测试管,在(50±0.5)℃恒温水浴锅中预热5 min,再加入0.5 ml粗酶液,另取1支作为空白对照试管,同时置于(50±0.5)℃恒温水浴锅中水浴20 min,然后取出3支试管,并把空白对照试管迅速放入冰水中,向待测试管中加入3 ml DNS。待空白对照试管冷却后加入0.5 ml粗酶液和3 ml DNS。将3支试管沸水浴5 min后,迅速放入冰水中冷却,加蒸馏水至25 ml,以空白对照试管调零,在540 nm波长下测量OD值。
1.4.6 木聚糖酶活力测定
取3支25 ml刻度的比色管,分别加入1.5 ml 1%的木聚糖溶液(pH值4.8乙酸缓冲液配制),其中2支作为待测试管,在(50±0.5)℃恒温水浴锅中预热5 min,再加入0.5 ml粗酶液,另取1支作为空白对照试管,同时置于(50±0.5)℃恒温水浴锅中水浴20 min,然后取出3支试管,并把空白对照试管迅速放入冰水中,向待测试管中加入3 ml DNS。待空白对照试管冷却后加入0.5 ml粗酶液和3 ml DNS。将三支试管沸水浴5 min后,迅速放入冰水中冷却,加蒸馏水至25 ml以空白对照试管调零,在540 nm波长下测量OD值。
1.5 菌株鉴定
1.5.1 形态学鉴定
观察该菌在YPD平板上的菌落形态和显微镜下的菌体形态。
1.5.2 分子生物学鉴定
使用酵母菌基因组提取试剂盒提取总DNA,利用5.8SrDNA-ITS进行菌种鉴定,并根据ITS1、ITS4的保守序列进行引物设计,正向引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,反向引物 ITS4:5′-TCCTCCGCTTATTGATATGC-3′。对所提酵母菌DNA进行PCR扩增,采用0.8%的琼脂糖凝胶进行电泳,检测DNA提取情况及扩增后的分子量。将扩增后的基因测序,并对所测的序列在 GenBank数据库中进行BLAST比对以确定菌属。
1.6 酵母菌的驯化
将筛选到的产纤维素酶能力较强的目标菌株以1%的接种量接种于培养基Ⅰ中,28℃、200 r/min摇床振荡培养6 d。然后,将初步驯化的菌种再接种到培养基Ⅱ中摇床28℃、200 r/min振荡培养6 d,得到驯化后的菌种并进行酶活力测定。
1.7 耐酸性测定
取纯乳酸加到YPD液体培养基中,使pH值分别为2.5、3.0、3.5、4.0、4.5,每个pH值分别取250 ml至500 ml三角瓶中,121℃灭菌20 min。冷却至室温后接入7.5×108CFU/ml酵母菌28℃摇床200 r/min振荡培养,分别于12、24、36、48、60、72 h取样采用血球计数板进行计数。
1.8 模拟胃液试验
取1 mol/l的盐酸加水稀释至pH值为1.5、2.0、2.5、3.0、3.5,每个pH值分别取30 ml至100 ml三角瓶中121℃灭菌20 min,冷却至室温,用滤菌器向每个三角瓶中加入0.5 g胃蛋白酶,摇匀后待用,将培养12 h后的菌液3 ml加入各三角瓶中,分别测定酵母菌在0、1、2、3、4 h的OD600nm,并计算相对含量。
1.9 模拟肠液试验
将A液(A胰腺液:称取 1.1 g碳酸氢钠、0.85 g氯化钠加入100 ml蒸馏水中,用氢氧化钠调pH值至6.8,121℃灭菌20 min,冷却后,无菌操作下加入1.5 g胰蛋白酶混合备用。)和B液(B胆液:称取1.2 g牛磺酸胆盐加入至100 ml蒸馏水中,121℃灭菌20 min。冷却备用。)以2∶1体积混合即可得到人工肠液,每个三角瓶取100 ml人工肠液,放置待用。将培养12 h后的菌液3 ml加入各三角瓶中,分别测定酵母菌在0、1、2、3、4 h的OD600nm,并计算相对含量。
1.10 抑菌能力测定
将金黄色葡萄球菌接种于BPY液体培养基中,37 ℃、180 r/min培养12 h,稀释活菌数为106CFU/ml,取100μl涂布于BPY平板。将待测酵母菌在YPD液体培养基中培养24 h后12 000 r/min离心10 min,取200μl上清液加入牛津杯中,37℃培养12 h,观察是否出现抑菌圈。
2 结果
2.1 产纤维素酶酵母菌筛选
对筛到的12株菌进行CMC-Na平板筛选后,获得5株能够产纤维素酶的菌株(见图3),并测量和计算菌落直径、透明圈直径、透明圈直径与菌落直径的比值(见表1)。选取透明圈直径与菌落直径较大的菌株进行纤维素内切葡聚糖酶活力测定(见表2)。由表2可知,Y3内切葡聚糖酶活最高为2.92 U/ml,选定此菌株为目标菌株。
2.2 菌株鉴定
2.2.1 形态学鉴定
所筛酵母菌在YPD平板上菌落呈乳白色,湿润、圆形、表面光滑、边缘整齐、顶部突起、不透明(见图4a)。镜检观察菌株细胞形态:细胞较大,呈圆形或椭圆型,出芽生殖(见图4b)。
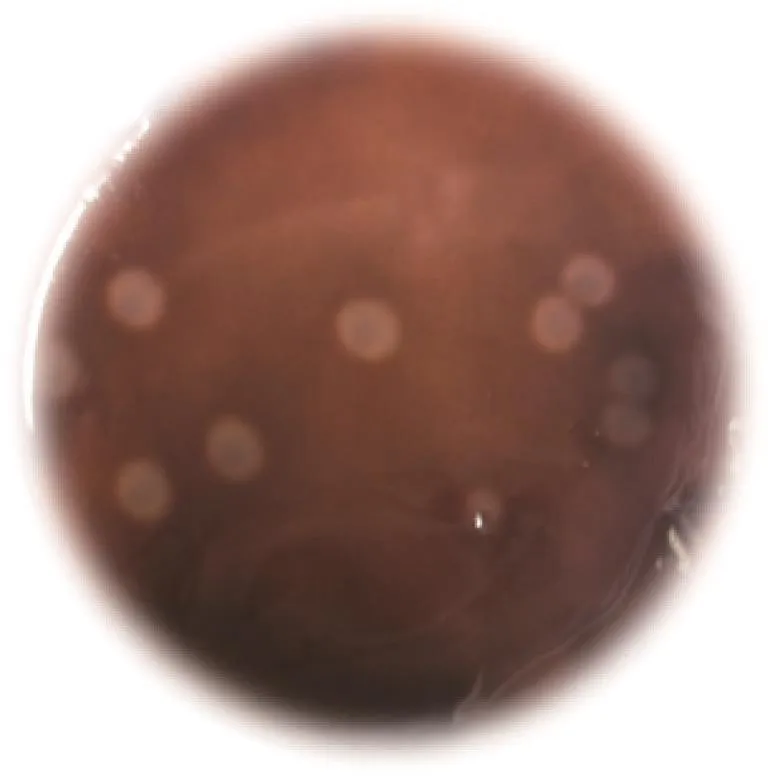
图3 酿酒酵母菌Y3在CMC-Na平板上的水解圈
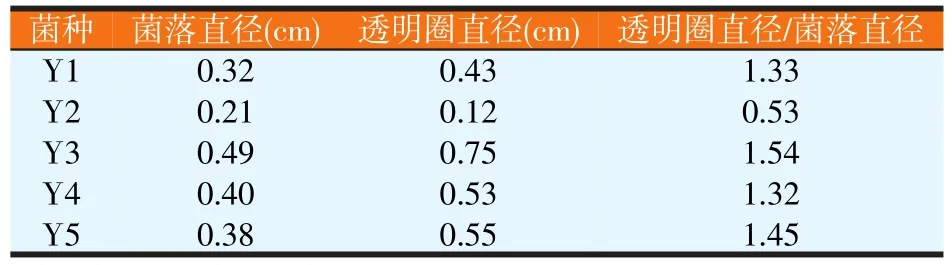
表1 酵母菌的初筛结果
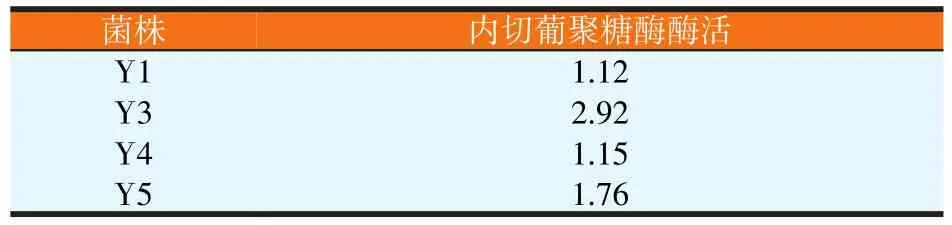
表2 酵母菌的复筛结果(U/ml)
2.2.2 分子生物学鉴定
将所选目标菌株使用ITS1和ITS4引物对其5.8S rDNA-ITS区基因PCR扩增,扩增产物900 bp。在GenBank对扩增产物的序列进行比对发现,所筛的Y3菌株序列片段与GenBank中酿酒酵母菌序列片段相似性达99%,从而鉴定其为酿酒酵母菌。
2.3 驯化后酿酒酵母菌Y3酶活
驯化后的酵母菌能有更高的耐受和产酶能力[4-5]。酿酒酵母菌Y3进行驯化,驯化后此菌株纤维素内切葡聚糖酶酶活达到3.27 U/ml,纤维素外切葡聚糖酶酶活为2.22 U/ml,木聚糖酶酶活为4.21 U/ml。
2.4 耐酸性试验
饲料发酵过程中,通常pH值<3.8时,有害菌才能完全被抑制,乳酸菌是主要产酸的菌。酵母菌一般在pH值4.0~6.0的环境中生长[6]。因此,耐酸的酵母菌的筛选将有利于饲料的发酵和提高饲料的发酵品质。本试验测定了筛选到的酿酒酵母菌Y3在不同pH值下,作用不同时间,酵母菌的活菌数,结果见表3。由表3可知,该酵母菌株对乳酸有较高的耐受性,并且该酵母菌随着时间不断增殖。在pH值2.5环境中,该酵母菌在36 h达到最大的生物量1.90×108CFU/ml。在pH值3.0~4.0环境中,该酵母菌在48 h达到最大生物量,分别是2.40×108、3.15×108、3.05×108CFU/ml。
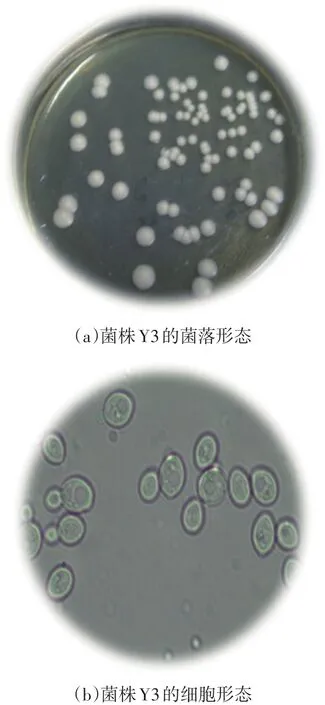
图4 菌株Y3的形态学鉴定
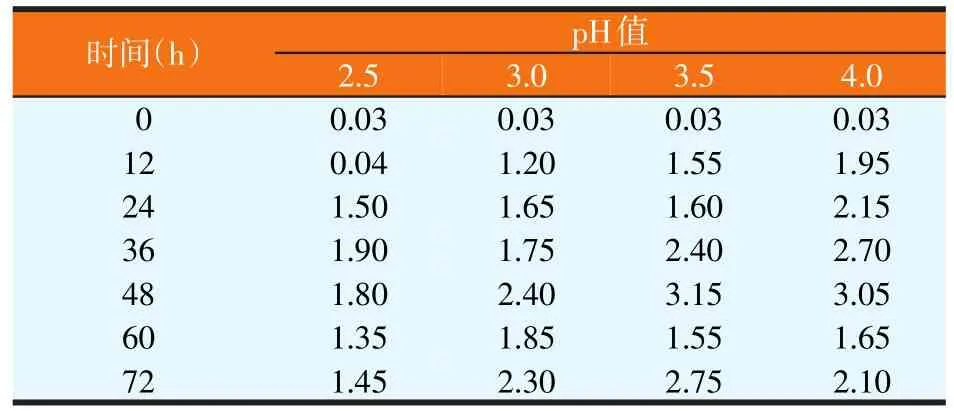
表3 酿酒酵母菌Y3耐酸性试验结果(×108 CFU/ml)
2.5 模拟胃液试验
成年猪胃与家禽肌胃内正常pH值为2.0~3.5,能够杀死大部分的微生物。微生物只有耐受胃液,才能进入小肠定植[7]。本试验测定了酿酒酵母菌Y3在不同pH值的模拟胃液中作用不同时间酵母菌的相对活菌数,结果见表4。由表4可知,该酵母菌对模拟胃液有较强的耐受性。在pH值1.5的模拟胃液中,该菌株的相对活菌数随时间逐渐降低,4 h时相对活菌数为68.0% 。当pH值≥2.0时,该菌株在前1 h进入适应期,之后菌株的相对活菌数随时间逐渐增加,并且pH值越大越适宜该菌株的繁殖。

表4 酿酒酵母菌Y3耐模拟胃液试验结果(%)
2.6 模拟肠液试验
动物肠道中存在大量的微生物,也是益生菌发挥作用的主要场所[8]。然而,小肠液偏碱性且含有大量的酶与胆盐,胆盐能够阻止微生物在肠道中增殖[9-10],因此,肠道环境不利于微生物的增殖。本试验测定了筛选到的酿酒酵母菌Y3在模拟肠液中作用不同时间酵母菌的相对活菌数,结果见图5。由图5可知,该株酿酒酵母菌对模拟肠液的耐受性较弱,模拟肠液处理3 h,该株酵母菌相对活菌数是37.0%;模拟肠液处理处理1 h,该株酿酒酵母菌相对活菌数是77.8%。
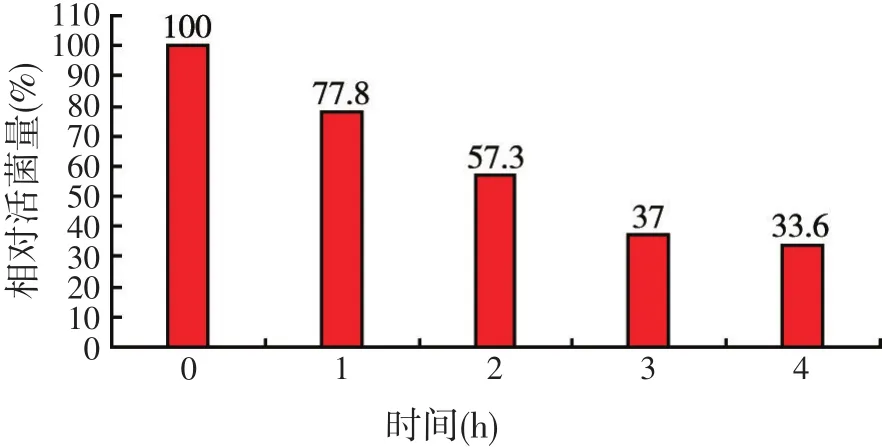
图5 酿酒酵母菌Y3耐模拟肠液试验结果
2.7 抑菌能力试验
通过取酿酒酵母菌Y3培养物的上清液,进行牛津杯37℃培养12 h后,发现未出现透明圈(见图6),即该酵母菌未能产生抗金黄色葡萄球菌的物质。
3 结论
通过初筛和复筛得到一株能够产纤维素酶的酵母菌Y3,对其进行形态学和分子生物学鉴定后,确定为酿酒酵母菌。酶活测定发现,该菌株所产纤维素内切葡聚糖酶酶活为3.27 U/ml,纤维素外切葡聚糖酶酶活为2.22 U/ml,木聚糖酶酶活为4.21 U/ml。此菌株有较强的耐酸和耐猪胆盐特性,在pH值2.5的乳酸环境中36 h,该酵母菌的生物量为1.90×108CFU/ml,在pH值1.5的模拟胃液中4 h,该酵母菌相对活菌数是68.0%。但该菌对模拟肠液耐受性较差,在模拟肠液处理3 h,其相对活菌数为37.0%;该菌对金黄色葡萄球菌没有抑制作用。
图6 酿酒酵母菌Y3抑菌试验图
