内质网应激相关蛋白GRP78及caspase-12在SAP大鼠急性肺损伤中的变化
2016-01-08郑建兴,任一鹏,张国志
内质网应激相关蛋白GRP78及caspase-12在SAP大鼠急性肺损伤中的变化
郑建兴1,任一鹏1,张国志2
(1.河北联合大学,河北 唐山 063000;2.河北联合大学附属医院普通外科,河北 唐山 063000)
摘要:目的观察内质网应激(ERS)相关蛋白在重症急性胰腺炎(SAP)大鼠急性肺损伤(ALI)中的变化,探讨ERS是否参与SAP大鼠ALI。方法60只SD雄性大鼠,随机取30只大鼠采用逆行胆胰管注射牛磺胆酸钠的方法制备SAP模型,造模后3、6、12 h三个时间点分批处死大鼠,分别为SAP1组、SAP2组、SAP3组各10只;30只为假手术(sham)组,仅打开腹腔,翻动胰腺组织后关腹,手术后3、6、12 h三个时间点分批处死大鼠,分别为sham1组、sham2组、sham3组各10只。检测血清淀粉酶、动脉血气分析、HE染色观察大鼠肺组织形态学变化、Western blot法检测大鼠肺组织GRP78及caspase-12表达情况。结果血清淀粉酶检测结果显示,SAP组大鼠各时间点血清淀粉酶较sham组对应时间点显著升高(P<0.05),SAP组大鼠各时间点血清淀粉酶呈时相性变化,随时间逐渐升高(P<0.05),sham组大鼠各时间点血清淀粉酶比较差异无统计学意义(P>0.05)。动脉血气分析结果显示,SAP组大鼠各时间点二氧化碳分压(PaCO2)较sham组对应时间点显著升高(P<0.05),动脉血氧分压(PaO2)明显下降(P<0.05);且SAP模型组按1、2、3组顺序,PaCO2逐渐递增,PaO2逐渐递减。HE染色结果显示,sham组大鼠肺组织病理学无明显变化,SAP组大鼠肺组织损伤逐步加重。Western blot结果显示,SAP模型组按1、2、3组顺序,GRP78及caspase-12表达水平逐渐增高,且SAP模型组明显高于对应时间点sham组表达水平(P<0.05),Sham各组之间GRP78及caspase-12表达差异无统计学意义(P>0.05)。结论ERS可能是SAP急性肺损伤发病机制之一。
关键词:重症急性胰腺炎;急性肺损伤;内质网应激;GRP78;caspase-12
中图分类号:R 563.8
DOI:10.3969/j.issn.1673-1492.2015.03.017
重症急性胰腺炎(SAP)是临床上较为常见的一类急腹症,起病急、进展快、临床病理变化复杂。SAP常在发病早期便会出现急性肺损伤(ALI),甚至进展为急性呼吸窘迫综合征(ARDS),如果不给予及时有效的治疗,可导致患者死亡[1]。国内外流行病学资料显示,ALI发病率和病死率居高不下,临床上ALI患者难以救治的重要原因是当前仍未能完全明确ALI的病理生理机制[2]。SAP早期体内就会发生全身炎症反应综合征(SIRS),细胞和组织暴露于缺氧、缺血、再灌注损伤等应激环境,此时能诱发内质网应激(ERS)。本研究主要观察ERS相关蛋白—GRP78及caspase-12的表达变化,探讨ERS是否为SAP肺损伤的发病机制之一。
1材料和方法
1.1 材料
1.1.1主要试剂牛磺胆酸钠购于美国Sigma公司,水合氯醛购于天津欧博凯化工有限公司,GRP78、caspase-12购于美国cell signaling公司,β-Tublin、辣根过氧化物酶标记山羊抗兔IgG、抗鼠IgG购于碧云天生物技术研究所,BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、BeyoECL Plus均购于碧云天生物技术研究所,显影剂D-72、定影剂D-72购于天津市世纪奥博商贸有限公司。
1.1.2实验动物健康雄性SD大鼠60只,体质量250~280 g(河北联合大学实验动物中心提供)。
1.2 方法
1.2.1分组大鼠适应性喂养1周后,随机分为假手术组(sham组)和模型组(SAP组)各30只。假手术(sham)组分别于手术后3、6、12 h三个时间点分批处死大鼠,为sham1组、sham2组、sham3组,每组10只;模型组分别于造模后3、6、12 h三个时间点分批处死大鼠,为SAP1组、SAP2组、SAP3组,每组各10只。
1.2.2大鼠模型的建立所有大鼠术前均禁食12 h,自由饮水。SAP组给予水合氯醛3 mL·kg-1,腹腔注射麻醉,经上腹正中切口入腹,找到十二指肠,以小号动脉夹分别夹住十二指肠段和肝门部胰胆管,用一次性静脉留置针经十二指肠大乳头逆行穿刺胰胆管,注射牛磺胆酸钠5 g·kg-1,持续1 min,停留5 min,然后拔出针头,去除动脉夹,观察到大鼠胰腺组织明显水肿、出血,分层缝合腹壁,消毒后将大鼠放入笼中,此时造模成功。假手术组模型的建立:仅打开腹腔,翻动胰腺组织后关腹。两组大鼠自由饮食、饮水。
1.2.3标本采集
SAP组及Sham组分别于术后第3、6、12 h三个时间点采集颈动脉血0.5 mL,全自动血气分析仪行动脉血气分析。再次麻醉,经原切口入腹,用采血针从下腔静脉采血3.5 mL,全自动生化仪检测血清淀粉酶。
1.2.3.2HE染色
各组大鼠采血后,分别取部分肺组织于4%多聚甲醛溶液中固定,取部分肺组织冻存。4%多聚甲醛溶液固定的肺组织常规石蜡包埋切片,行HE染色,光镜下观察各时间点肺组织的病理学改变。
1.2.3.3Western blot分析
将冻存肺组织研磨,加入组织裂解液(1 μL·mg-1)裂解蛋白,高速离心(4 ℃、12 000 r·min-1)15 min,留取上清。依据样品数量按试剂A∶试剂B=50∶1配制BCA工作液。按照BCA蛋白浓度测定试剂盒说明操作,将蛋白标准品按照0、1、2、4、8、12、16、20 μL加到96孔板中,加PBS补足至20 μL。样品孔中加入4 μL待测蛋白,PBS补足到20 μL,每孔加入200 μL BCA工作液,37 ℃ CO2孵箱中放置30 min。酶标仪测定545 nm波长下蛋白的吸光度值,根据标准曲线计算蛋白浓度,测定样品蛋白浓度,根据上一步所测得的蛋白浓度,取蛋白40~60 μg为上样量,行SDS-PAGE电泳,经硝酸纤维素膜转移,10%脱脂奶粉封闭,加一抗,4 ℃摇床过夜。回收一抗,PBS洗膜3次,10 min/次,加入相应二抗孵育1.5 h,回收二抗,PBS洗膜3次,10 min/次。然后按照BeyoECL Plus说明显色,X线胶片曝光,将胶片扫描,应用Image J软件对条带进行分析。以GAPDH孵育作为内参照。
1.3 统计学方法
与公路运输相比,运行的列车数量是有限的,因此为了做好铁路运输生产控制,最大化铁路运量与提升运输效率,保障铁路运输安全,需要通过行车调度工对既有铁路运输需求进行市场调研和分析,预测车流情况,消除生产运输过程中的安全隐患,更好地提升铁路运输质量。一般情况下,铁路运输的调度工作分为三级调度层级架构,从高到底分别为行车调度总体上是对时间和空间的双重调度,在时间上要分辨铁路列车在一定时间内的速度和出发时间,保障铁路运输安全[1]。
2结果
2.1 大鼠血清酶学检测结果
SAP各组大鼠血清淀粉酶(AMY)水平较sham各组明显升高,差异有统计学意义(P<0.05);SAP各组大鼠动脉血氧分压(PaO2)明显降低,二氧化碳分压(PaCO2)明显升高(P<0.05)(Tab.1)。
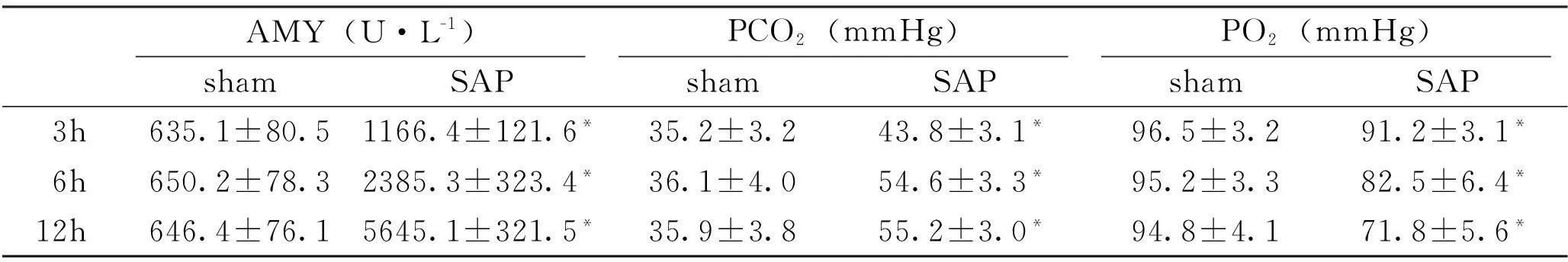
Tab.1 The value of AMY,PCO 2 and PO 2 in various groups
2.2 大鼠肺组织病理学变化
Sham各组肺组织病理学无明显变化,大鼠肺组织结构清晰,肺泡壁完整,肺间质无渗出。SAP1组大鼠肺组织局部出现轻度充血;SAP2组大鼠肺组织充血逐渐加重,体积逐渐增大,部分肺呈弥漫性出血;SAP3组大鼠肺组织有大面积出血点及瘀血(Fig.1)。

A:Sham;B:SAP1;C:SAP2;D:SAP3. Fig.1 Histological changes in lung tissues in various groups(HE,×100)
2.3 各组GRP78、caspase-12含量变化
SAP各组GRP78及caspase-12表达水平逐渐升高,且以12 h表达水平最高,差异有统计学意义(P<0.05);SAP各组较相对应sham各组GRP78及caspase-12表达水平明显升高(P<0.05);sham各组之间GRP78及caspase-12表达差异无统计学意义(P>0.05)。(Fig.2,Tab.2)
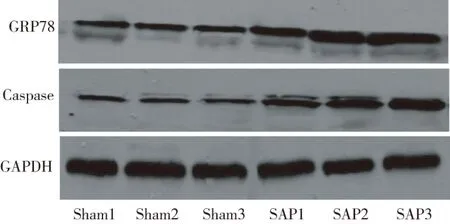
Fig.2 The expression of GRP78 and caspase-12 in lung tissues of rats in various group

Tab. 2 The expression of GRP78 and caspase-12 in lung tissues of rats in various group
3讨论
SAP是临床上较常见危重疾病,属于急性胰腺炎的特殊类型,是一种病情险恶、并发症多、病死率较高的急腹症,该病除引起胰腺局部损伤外,还可以出现胰腺外多器官功能障碍综合征,ALI和ARDS是最常见的早期并发症,SAP患者中大约30%~50%[3]合并有ALI和ARDS,有学者认为ALI/ARDS可以作为临床评价SAP严重程度的标准之一[4]。因此,对SAP合并ALI的诊断、治疗和发病机制的研究已成为SAP研究领域中的一项重要课题。目前SAP合并ALI的发病机制尚未完全阐明,其发病机制很多,近年来研究发现,ERS在机体炎症反应中发挥了重要作用,且ERS与炎症信号转导通路之间相互联系,ERS与机体多种疾病密切相关,如糖尿病、心血管疾病和神经系统疾病等,其机制可能与ERS诱导细胞凋亡有关[5-6]。本研究从ERS角度探讨SAP合并ALI时是否有ERS参与其中。
内质网是真核细胞中蛋白质合成、折叠、修饰及细胞内钙贮存的主要场所,在维持细胞稳态中发挥重要的作用。内质网内环境的稳定是实现内质网功能的基本条件,但有很多因素可导致内质网内稳态失衡,形成ERS。ERS是指由于某种原因使细胞内质网生理功能发生紊乱的一种亚细胞器病理状态,细胞有一套完整的机制来监督和帮助内质网内蛋白质的折叠与修饰,当错误折叠的蛋白质累积时,细胞通过一系列信号转导途径对其进行应答,ERS可促进内质网处理内质网内错误折叠或未折叠的蛋白质,从而维持细胞的正常功能[7]。
GRP78属于热休克蛋白(HSP70)家族,也称免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein,BiP),是内质网分子伴侣蛋白之一,生理情况下,GRP78在基础水平表达,对维持内质网稳态具有重要作用,主要功能是作为分子伴侣参与新生多肽链的折叠、装配和转运,通过与ERS元件PERK、IRE1及ATF6的结合抑制ERS的激活[8]。GRP78的诱导广泛被认为是ERS的标志性分子[9],ERS被诱导后,未折叠蛋白在内质网内堆积,使GRP78从3种跨膜蛋白上解离下来结合未折叠蛋白,解离后的感受蛋白被活化并启动UPR,减低未折叠或错误折叠蛋白在ER内的积聚,恢复内质网的正常功能。GRP78是触发UPR的关键蛋白,显示出细胞保护的潜在作用,有研究表明细胞过表达GRP78可以有效抵抗ERS[10]。
ERS可以激活多条途径诱导细胞凋亡,尽管ERS介导的凋亡途径并没有完全阐明,但是内质网膜上的caspase-12的活化已经被确认参与这个过程[11]。caspase-12是含半胱氨酸残基的天冬氨酸蛋白水解酶家族成员之一,随着ERS成为目前研究的热点,作为其凋亡途径之一的caspase-12激活受到了更大程度的关注。caspase-12定位于内质网的外膜,是介导ERS凋亡的关键蛋白酶,在膜受体或线粒体凋亡途径中不被活化,是ERS特有的凋亡途径。
为观察ERS相关蛋白GRP78及caspase-12在SAP大鼠ALI中的表达变化特点,我们选择了经大鼠胰胆管逆行注射5%牛磺胆酸钠溶液方法制备SAP动物模型[12]。该方法构建大鼠SAP并发ALI模型是研究SAP引起ALI的理想动物模型[12],但此方法制备大鼠SAP模型时大鼠病死率高,不便长时间观察,故本研究选择在造模成功后12 h内完成。为证实SAP模型大鼠是否并发ALI,我们在光镜下初步比较了SAP组和sham组大鼠肺组织病理改变情况,在SAP组大鼠肺组织HE染色病理切片观察到SAP1组大鼠肺组织局部出现轻度充血,SAP2组大鼠肺组织充血逐渐加重,体积逐渐增大,部分肺呈弥漫性出血,SAP3组大鼠肺组织有大面积出血点及瘀血;而sham组大鼠各组肺组织病理学均无明显变化,大鼠肺组织结构清晰,肺泡壁完整,肺间质无渗出。上述实验结果说明,我们成功构建了SAP并发ALI大鼠模型,SAP模型肺脏组织出现了ALI表现,因而SAP组肺脏组织可进一步用于实验的分子检测。造模成功后取静脉血行血清淀粉酶检测,SAP组大鼠血清淀粉酶在造模成功后3、6、12 h较相对应时间点sham组大鼠血清淀粉酶明显升高,且SAP组大鼠血清淀粉酶水平随造模后时间延长而逐渐升高,sham组大鼠各时间点血清淀粉酶无明显变化。血气分析提示,SAP组大鼠各时间点PaCO2较sham组对应时间点显著升高(P<0.05),PaO2明显下降(P<0.05);且SAP组按1、2、3组顺序,PaCO2逐渐递增,PaO2逐渐递减;sham组各时间点PaO2及PaCO2差异无显著性。
综上所述,本研究选取ERS发生的标志性分子GRP78及介导ERS凋亡的关键蛋白酶caspase-12,用Western blot法检测大鼠肺组织GRP78及caspase-12的表达情况,发现SAP组大鼠GRP78及caspase-12均逐渐增高,且增高水平明显高于相对应时间点的sham组,GRP78的增高提示ERS可能参与了SAP大鼠ALI,并且在ERS过程中caspase-12水平随时间逐渐增加,引起了肺泡上皮细胞的凋亡,导致肺组织病理学变化逐渐加重。
SAP大鼠导致ALI的发生机制有很多,ERS可能为其一,因此,对过度的ERS早期进行干预可能成为治疗SAP导致ALI的新方法,仍需要我们进一步研究。
参考文献:
[1]刘丙刚,秦春宏.重症急性胰腺炎致肺损伤发病机制研究进展[J].现代医药卫生,2010,26(3):393-395.
[2]Erickson S E,Martin G S,Davis J L,et al.Recent trends in acute lung injury mortality:1996—2005[J].Crit Care Med,2009,37(5):1574-1579.
[3]李成玉.内毒素致大鼠急性肺损伤模型的建立[J].临床肺科杂志,2012,17(4):657-659.
[4]王静宜.依达拉奉对肺损伤保护作用的研究进展[J].临床肺科杂志,2012,17(7):1300-1301.
[5]Gotoh T,Endo M,Oike Y.Endoplasmic reticulum stress-related inflammation and cardiovascular diseases[J].Int J Inflam,2011,2011:259462.
[6]Papa F R.Endoplasmic reticulum stress,pancreatic β-cell degeneration,and diabetes[J].Cold Spring Harb Perspect Med,2012,2(9):a007666.
[7]Malhotra J D,Miao H,Zhang K,et al.Antioxidants reduce endoplasmic reticulum stress and improve protein secretion[J].Proc Natl Acad Sci USA,2008,105:18525-18530.
[8]Rao R V,Peel A,Logvinova A,et al.Coupling endoplasmic reticulum stress to the cell death program:Role of the ER chaperone GRP78[J].FEBS Lett,2002,514(23):122-128.
[9]Ni M,Lee A S.ER chaperones in mammalian development and human diseases[J].FEBS Lett,2007,581(19):3641-3651.
[10]Morris J A,Dorner A J,Edwards C A,et al.Immunoglobulin binding protein(BiP)function is required to protect cells from endoplasmic reticulum stress but not required for the secretion of selective proteins[J].J Biol Chem,1997,272(7):4327-4334.
[11]Zhang K,Kaufman R J.The unfolded protein response:A stress signaling pathway critical for health and disease[J].Neurology,2006,66(2 Suppl 1):S102-S109.
[12]Kim H S,Christine C,Christopher C.Review of experimental animal models of acute pancreatitis[J].HPB(Oxford),2006,8(4):264-286.
[责任编辑:李蓟龙]
