养殖水温对星洲红鱼生长、消化和免疫的影响
2016-01-08黄永春集美大学水产学院厦门361021
黄永春(集美大学水产学院,厦门361021)
养殖水温对星洲红鱼生长、消化和免疫的影响
黄永春
(集美大学水产学院,厦门361021)
摘 要:为研究不同养殖水温对星洲红鱼的生长、消化和免疫的影响,选取300尾体长为(12.5±1.5)cm,体重为(25.1±2.3)g的健康星洲红鱼分别在温度为15、20、25、30和35℃的水体中饲养40 d。每一温度设3个重复,每个重复20尾星洲红鱼。结果表明:各养殖水温下星洲红鱼的特定生长率表现为30℃>35℃>25℃>20℃>15℃,且组间差异显著(P<0.05);特定生长率(y)与养殖水温(x)的回归关系为:y=-0.118 2x3+0.917x2-1.457 5x+1.082 7(r=0.997 8)。各组星洲红鱼的成活率为86.67%~98.33%,在15℃时最高,在35℃时最低,除30与25℃组间差异不显著(P>0.05)外,其他组间差异显著(P<0.05)。饲料系数表现为35℃>25℃>30℃>20℃>15℃,除15和35℃组间差异显著(P<0.05)外,其他组间差异不显著(P>0.05)。随养殖水温从15℃升高到30℃,各组肌肉RNA/DNA逐步上升,在35℃时又有所下降,除15与20℃组间差异不显著(P>0.05)外,其他组间差异显著(P<0.05)。星洲红鱼肝胰腺、肠和胃蛋白酶、淀粉酶和脂肪酶活性均随养殖水温的升高先上升后下降,其中蛋白酶和淀粉酶活性在30℃以后开始下降,而脂肪酶活性在25℃以后开始下降。除25和35℃组的淀粉酶活性以及20与30℃组的脂肪酶活性差异不显著(P>0.05)外,各消化酶活性在各组间差异显著(P<0.05)。星洲红鱼血清酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)和过氧化物酶(POD)活性均在30℃达到最高,在35℃时间有所下降。除血清SOD活性外,血清AKP、ACP和POD活性在25和35℃组间差异不显著(P>0.05),其他组间差异显著(P<0.05)。由此得出,养殖水温在27~34℃时星洲红鱼生长快、消化能力强、免疫相关酶活性高;通过回归分析得出,当养殖水温为31℃时星洲红鱼的生长最佳。
关键词:星洲红鱼;养殖水温;生长;消化酶;免疫酶
星洲红鱼(Singapore red tilapia,O.mossambi⁃cus)属鲈形目鲡鱼科罗非鱼属种间杂交的一个品种,由新加坡、台湾等地的养殖专家经过20余年的不断改良而成,其体色鲜红、生长快,当年鱼苗可长至800~1 300 g,是集观赏、养殖、垂钓于一体,具有养殖前景的罗非鱼新品种[1]。
环境温度是水生动物重要的外界环境因子之一,影响鱼类正常的生理活动和行为特征。因此,温度变化不仅影响鱼类的摄食生长[2-9]、饲料转化率[4,7-8],还影响其消化酶活性[5,7,10-14]、免疫功能[14-17],进而影响鱼类机体的新陈代谢和生理调节机制。目前,有关环境温度对罗非鱼消化酶活性影响的研究仅见王辉等[7]、黎军胜等[11]报道的环境温度对奥尼罗非鱼(Oreochromis niloticus×O.aureus)成鱼消化酶活性的影响。养殖水温对星洲红鱼生长、消化酶和血液免疫因子活性的影响尚未见报。本试验设置15、20、25、30、35℃5个养殖水温,通过40 d的饲养研究星洲红鱼在不同水温下的生长性能、肌肉RNA/DNA、消化酶(蛋白酶、脂肪酶、淀粉酶)及免疫相关酶[碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)和过氧化物酶(POD)]活性的变化规律,为星洲红鱼养殖提供科学依据,并为进一步开展星洲红鱼配合饲料的研制提供基础资料和理论依据,促进星洲红鱼养殖产业发展。
1 材料与方法
1.1 试验用鱼
试验用星洲红鱼来自集美罗非鱼养殖场。选择健康、规格一致,体长为(12.5±1.5)cm,体重为(25.1±2.3)g的星洲红鱼,暂养1周左右以适应养殖环境,暂养水温为22.3℃。
1.2 试验设计
星洲红鱼经暂养适应后开始正式试验。试验设15、20、25、30、35℃共5个养殖水温,每一温度设3个重复,每个重复20尾星洲红鱼,以重复为单位置于25 cm×30 cm×50 cm的水族箱中。应用大连汇新科技发展有限公司生产的海鲜蓄养智能控温仪控制降温,以暂养水温22.3℃为基准,分别以每12 h升或降0.5℃的控温速度到达各试验温度,试验期间投喂罗非鱼商品饲料(含28%粗蛋白质),根据星洲红鱼的活动、摄食情况,每天投喂2次,日投喂量为体重的3%~5%,定期记录存活尾数,试验期为40 d。
1.3 样品制备
试验结束后,禁食24 h取样,从每一试验温度中取18尾(每个重复中随机抽取星洲红鱼6尾),分别用1 mL注射器在鱼尾椎动(静)脉取血,于4℃下经10 000 r/min离心20 min,制备血清,将血清放于-80℃冰箱保存备用。记录体重后将鱼置于冰盘活体剖开,取出胃、肝胰腺、肠和背部肌肉,剔除附着物,用预冷的重蒸水清洗后用滤纸吸干,装袋,称重后液氮保存用于测定胃、肝胰腺、肠消化酶活性及肌肉RNA/DNA。
各组剩余试验鱼测体重,记录备案。
1.4 指标测定
1.4.1 生长性能测定
饲养结束后,测量各组鱼的体重,各生长性能指标采用以下公式计算:
平均日增重(ADG,g/d)=(W2-W1)/t;
饲料系数(FCR)=G/(W2-W1);
特定生长率(SGR,%/d)=100×(lnW2-lnW1)/t;
存活率(SR,%)=100×Nt/N0。
式中:W1为初始平均体重(g);W2为终末平均体重(g);t为试验天数(d);G为消耗的饲料重(g);Nt每个重复中的存活尾数;N0为每个重复中的投放尾数。
1.4.2 消化器官(肝胰腺、肠和胃)消化酶活性测定
将各消化器官样品取出解冻后,按重量∶体积=1∶10(g/mL)加入预冷重蒸水,用玻璃匀浆器冰浴匀浆后于4℃、4 000 r/min离心机离心20 min,取上清液即为粗酶提取液,并于4℃冰箱中保存备用,24 h内完成测定。
蛋白酶活性采用福林酚试剂法测定,淀粉酶活性采用3,5-二硝基水杨酸比色定糖法测定,脂肪酶活性采用聚乙烯醇橄榄油乳化液水解法测定,反应温度对应各养殖水温(15、20、25、30和35℃)。
组织蛋白质浓度采用考马斯亮蓝染色法测定。各消化酶的活性均以比活力(U/mg prot)表示。
1.4.3 肌肉RNA/DNA测定
RNA/DNA测定采用Buckley[18]的方法进行,并略作修改。
1.4.4 血清免疫相关酶活性测定
AKP、ACP、SOD和POD活性均采用南京建成生物工程研究所生产的试剂盒测定。
1.5 数据分析与处理
试验数据以平均值±标准差表示,采用SPSS 10.0软件进行统计分析,差异显著水平为P<0.05。
2 结果与分析
2.1 不同养殖水温下星洲红鱼的生长性能
养殖水温与星洲红鱼的生长关系密切,随着养殖水温的上升,星洲红鱼的平均日增重和特定生长率逐步增加,当养殖水温达30℃时二者达到高峰,35℃后呈下降趋势。在各养殖水温下,星洲红鱼的平均日增重和特定生长均表现为30℃>35℃>25℃>20℃>15℃,且组间差异显著(P<0.05)(表1)。特定生长率(y)与养殖水温(x)的回归关系:y=-0.118 2x3+0.917x2-1.457 5x+1.082 7(r=0.997 8)(图1),经分析得出,养殖水温在27~34℃之间时星洲红鱼的特定生长率>2.0;当养殖水温为31℃时,星洲红鱼的特定生长率最高,为2.380。
养殖水温为15℃时星洲红鱼的存活率最高,为98.33%,35℃时存活率最低,为86.67%(表1),15与35℃组星洲红鱼的存活率与其他各组差异显著(P<0.05),其他各组之间差异不显著(P> 0.05)。
星洲红鱼在不同养殖水温下饲料系数各不相同,表现为35℃>25℃>30℃>20℃>15℃,15 和35℃组的饲料系数与其他各组差异显著(P<0.05),20、25和30℃组的饲料系数差异不显著(P>0.05)(表1)。
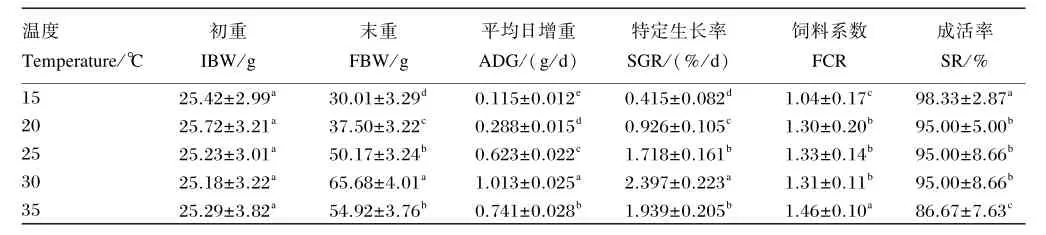
表1 不同养殖水温下星洲红鱼的生长性能Table 1 Growth performance of Singapore red tilapia cultured in different water temperature
2.2 不同养殖水温下星洲红鱼肌肉RNA/DNA
在15、20、25、30、35℃养殖水温下星洲红鱼肌肉RNA/DNA分别为1.23±0.12、1.51±0.12、2.01±0.19、2.55±0.22和2.80±0.20,除15与20℃组间差异不显著(P>0.05)外,其他各组间差异显著(P<0.05),且肌肉RNA/DNA随养殖水温的升高先逐步上升,至30℃时达最高,尔后开始下降(图2)。

图1 养殖水温与星洲红鱼特定生长率的回归关系Fig.1 Regression relation between culture water temperature and SGR of Singapore red tilapia
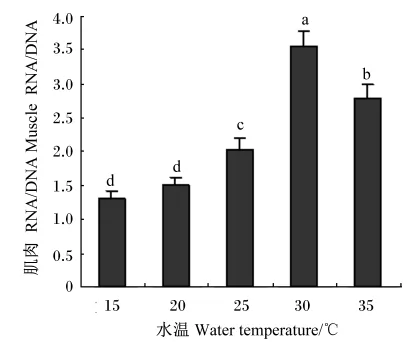
图2 不同养殖水温下星洲红鱼肌肉RNA/DNAFig.2 Muscle RNA/DNA of Singapore red tilapiacultured in different water temperature
2.3 不同养殖水温下星洲红鱼消化器官消化酶活性
2.3.1 蛋白酶活性
如表2所示,星洲红鱼肝胰腺、肠和胃蛋白酶活性均先随养殖水温的升高而上升,在30℃以后随养殖水温的升高开始下降。星洲红鱼肝胰腺、肠和胃蛋白酶活性均表现为15℃<20℃<25℃<35℃<30℃,组间差异显著(P<0.05)。在相同养殖水温条件下,星洲红鱼消化器官中蛋白酶活性大小均为肠>胃>肝胰腺,且肠与胃和肝胰脏相比差异显著(P<0.05)。
2.3.2 淀粉酶活性
如表2所示,星洲红鱼肝胰腺、肠和胃淀粉酶活性均先随养殖水温的升高而上升,在30℃以后随着养殖水温的升高开始下降。星洲红鱼肝胰腺、肠和胃淀粉酶活性均表现为15℃<20℃<35℃<25℃<30℃,25和35℃组间差异不显著(P>0.05),其余各组间差异显著(P<0.05)。在相同养殖水温条件下,星洲红鱼消化器官中淀粉酶活性大小均为肝胰腺>肠>胃,除15℃下肝胰脏与肠道淀粉酶活性差异不显著(P>0.05)外,其他养殖水温下不同消化器官间显著差异(P<0.05)。
2.3.3 脂肪酶活性
如表2所示,星洲红鱼肝胰腺、肠和胃脂肪酶活性均先随养殖水温的升高而上升,在25℃以后随着养殖水温的升高开始下降。星洲红鱼肝胰腺、肠和胃脂肪酶活性均表现为15℃<20℃<35℃<30℃<25℃,除20与30℃组肝胰腺和肠脂肪酶活性差异不显著(P>0.05)外,其他各组之间差异显著(P<0.05)。在相同养殖水温条件下,星洲红鱼消化器官中脂肪酶活性大小均为肠>胃>肝胰脏,且不同消化器官间显著差异(P<0.05)。
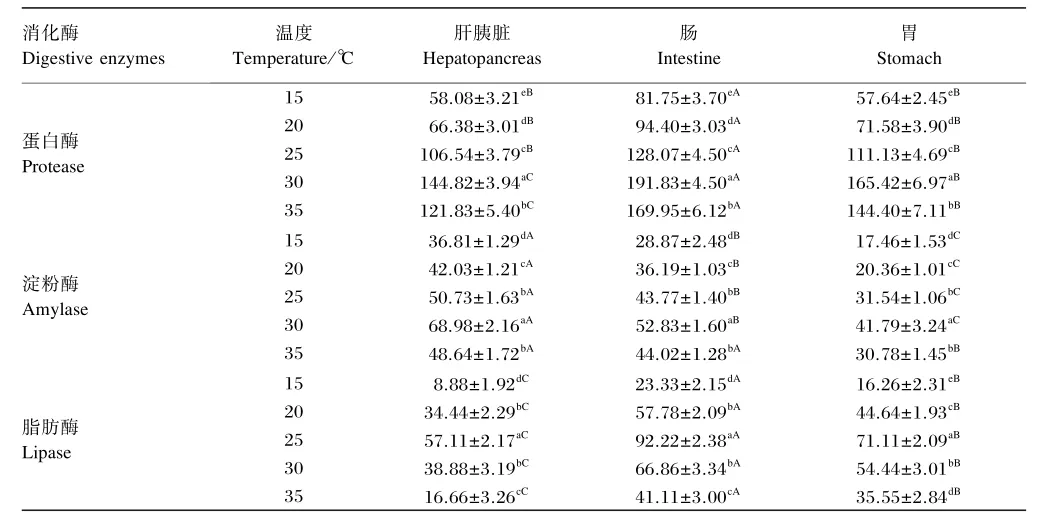
表2 不同养殖水温下星洲红鱼消化酶活性Table 2 Digestive enzyme activities of Singapore red tilapia cultured indifferent water temperature U/mg prot
2.4 不同养殖水温下星洲红鱼的血清免疫相关酶活性
2.4.1 AKP活性
在15、20、25、30和35℃水温下,星洲红鱼血清AKP活性先随养殖水温的升高而上升,30℃达到最高,而后开始下降,分别为(2.75± 0.30)U/mL、(4.65±0.94)U/mL、(6.74± 0.58)U/mL、(10.01±1.03)U/mL、(6.70± 1.08)U/mL,除了25和35℃组间差异不显著(P>0.05)外,其他组间差异显著(P<0.05)(图3)。2.4.2 ACP活性
在15、20、25、30和35℃水温下,星洲红鱼血清ACP活性先随养殖水温的升高而上升,30℃达到最高,而后开始下降,分别为(7.68±1.30)U/mL、(12.45±1.09)U/mL、(19.08± 2.03)U/mL、(27.41±0.47)U/mL、(18.56± 2.21)U/mL,除了25和35℃组间差异不显著(P<0.05)外,其他组间差异显著(P<0.05)(图3)。
2.4.3 SOD活性
在15、20、25、30和35℃水温下,星洲红鱼血清SOD活性先随养殖水温的升高而上升,30℃达到最高,而后开始下降,分别为(22.88± 2.10)U/mL、(43.66±2.94)U/mL、(60.67± 3.11)U/mL、(72.06±5.44)U/mL、(70.63± 3.88)U/mL。除了30和35℃组间差异不显著(P>0.05)外,其他各组间差异显著(P<0.05)(图3)。
2.4.4 POD活性
在15、20、25、30和35℃水温下,星洲红鱼血清POD活性先随养殖水温的升高而上升,30℃达到最高,而后开始下降,分别为(36.56± 3.58)U/mL、(68.22±6.25)U/mL、(95.81± 11.17)U/mL、(135.22±6.27)U/mL、(113.89± 10.46)U/mL,各组间差异显著(P<0.05)(图3)。
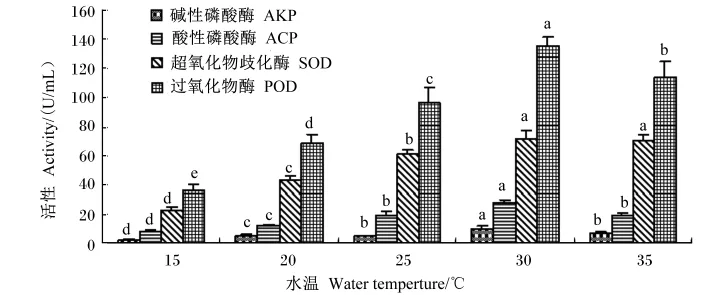
图3 不同养殖水温下星洲红鱼血清AKP、ACP、SOD、POD活性Fig.3 Activities of serum AKP,ACP,SOD and POD of Singapore red tilapia cultured in different water temperature
3 讨 论
3.1 养殖水温与生长
鱼类的生长取决于鱼类的采食量,对饲料的消化、吸收以及转变为机体组织的效率,而养殖水温是影响鱼类生长与存活最重要的环境因子[9]。本研究发现,星洲红鱼在15℃的养殖水温下,虽然成活率最高(98.33%),饲料系数最低(1.04),但在该水温下星洲红鱼的活动差、摄食弱,吸收以及转变为机体组织的效率也差,生长缓慢;随养殖水温升高,星洲红鱼抢食强、饲料利用率高、生长速度明显加快。经回归分析得出,在养殖水温27~34℃范围内星洲红鱼的特定生长率>2.0,当水温31℃时,星洲红鱼的特定生长率最高,达2.380。这与奥尼罗非鱼仔稚鱼在22~31℃范围内时生长速度随温度升高而加快,31℃时达到最高,但34℃时开始降低一致[7],也与Azaza等[6]在尼罗罗非鱼幼鱼上所得结果基本相同。另外,高淳仁等[5]报道,大菱鲆(Scophthalmus maximus)幼鱼在水温为12~16℃时生长最快,水温高于20℃时生长速度明显下降;Burel等[3]报道,鲶鱼(Silurus asotus)的采食量随着养殖水温的升高明显升高,饲料转化效率明显提高,当水温达到22.8℃时,鲶鱼的采食量和饲料转化效率最高;超过22.8℃以后,鲶鱼的采食量和饲料转化效率将会下降而影响生长。王辉等[7]和Xie等[2]认为:当养殖水温超过某一临界值时,该水温条件成为鱼类生长的胁迫因子,使生长速度减慢,过高的水温可能已使体内的代谢发生紊乱,且水温的升高对鱼类的生长有正面和反面2种作用。因此,结合特定生长率与养殖水温的回归分析,本试验认为31℃可能是星洲红鱼养殖水温的临界点,确切水温还有待进一步研究。
另外,在蛋白质合成的生化过程中,信使RNA和转运RNA是重要的参与者,当蛋白质合成速度加快时,RNA浓度增加,因而RNA的浓度是测定生物生长率的敏感指标[18]。而细胞中细胞核内DNA数目恒定,且含量不随环境条件的改变而发生变化,RNA/DNA可以作为鱼类种群长期生长状况评价指标[19],因此RNA/DNA比单独的RNA浓度更能精确地反映生长状况[20]。本研究结果表明,星洲红鱼在15~35℃水温条件下肌肉RNA/DNA随水温升高逐步上升,至30℃时最高,而后开始下降,这与表观生长性能相一致。
3.2 养殖水温与消化酶活性
鱼类消化酶活性的高低决定鱼类对营养物质消化吸收的能力,从而决定鱼类生长发育的速度。在一定温度范围内,随着反应温度的升高,酶催化反应的速度加快,并在某一温度下酶活性达到最大值,但超过一定数值后,酶催化反应的速度反而随温度的升高而减慢。本研究表明:星洲红鱼的消化酶活性随养殖水温的升高明显呈现先升后降的趋势,水温在15~35℃范围内时,在30℃时蛋白酶和淀粉酶活性达到最高,而后开始下降;脂肪酶活性则在25℃时达到最高,而后开始下降。区又君等[21]在19~31℃养殖水温下,卵形鲳鲹(Trachinotus ovatus)幼鱼蛋白酶、淀粉酶、脂肪酶活性随水温的升高均呈先上升后下降的趋势,蛋白酶活性在28℃时最高,淀粉酶活性在25℃时最高,脂肪酶活性在22℃时最高;刘洋等[14]研究得出细鳞鱼(Brachymystax lenok)幼鱼在水温6、14 和22℃时消化器官(胃、幽门盲囊、肝脏和肠)中的蛋白酶、淀粉酶和脂肪酶活性均在14℃时最高;田宏杰等[13]报道14、21、28℃水温下饲养施氏鲟(Acipenser schrenckii Brandt)幼鱼的肝脏蛋白酶活性均以21℃时最高,十二指肠和胃蛋白酶活性则在28℃时最高,淀粉酶活性在21℃时最高;脂肪酶活性在14℃时最高。上述结果与本试验结果基本一致。然而,王辉等[7]报道奥尼罗非鱼仔稚鱼养殖水温在22~34℃时,胃蛋白酶、胰蛋白酶和淀粉酶活性随养殖水温的升高而持续上升,均在34℃时最高;脂肪酶活性在31℃时最高;黎军胜等[11]报道奥尼罗非鱼养殖水温在17~32℃时,消化酶活性随着水温的升高而上升。这与本试验结果有差异。研究表明,在一定温度范围内,升高养殖水温,鱼类肠道蠕动加快,摄食能力增强,标准代谢增强[7],但此种正相关不是无限的,对于鱼类来说,有一个极限温度,在这个极限温度以上,机体代谢紊乱,生长速度变慢,消化酶的活性也会随着温度的升高而呈逐渐下降趋势[9]。对此,刘红等[12]在研究温度对条纹石鮨(Morone saxatilis)蛋白酶活性影响时发现,水温较低时(15℃),由于储存作用相对较大,代谢水平不高,故其蛋白酶活性最高;随着水温的上升,代谢作用明显增强,蛋白酶活性也会随之下降。养殖水温除了直接影响消化酶的活性外,还通过调节机体的代谢,改变体内的离子浓度、pH等,从而间接影响消化酶活性,因此养殖水温比反应温度更显著地影响消化酶活性。
3.3 养殖温度与血清免疫相关酶活性的关系
AKP和ACP是体内最重要的2种水解酶,广泛存在于动物血液和各种器官内,可以加速物质的摄取和转运,形成水解酶体系,破坏和消除侵入体内的异物,达到机体防御的功能,是评价动物生理代谢水平的一项重要指标[22]。本研究结果表明,星洲红鱼血清AKP、ACP活性随着养殖水温的升高先上升,30℃达到最高,而后开始下降。这可能是因为在水温(低温和高温)胁迫下,星洲红鱼细胞生理代谢效率降低,代谢水平下降,从而导致在细胞中的AKP和ACP活性下降。方美娟等[17]报道低温和高温都会使花鱼骨(Hemibarbus macu⁃latus)的血清中AKP、ACP活性显著降低,导致免疫力下降,出现死亡;王天神等[23]报道水温为10~15℃时,克氏原螯虾(Procumburus clurkii)血液中AKP、ACP的活性保持稳定,20℃时二者活性达到峰值,水温继续升高时二者活性逐渐降低。上述结果与本试验结果基本一致。
SOD和POD是生物体内非常重要的2种抗氧化酶,特别是SOD,能清除超氧阴离子自由基,促使O-2歧化为过氧化氢(H2O2)和水(H2O),随后过氧化氢酶(CAT)再将H2O2催化为H2O和氧气(O2),从而达到为机体解毒的目的。在此过程中POD起到催化H2O2反应的作用,是抗氧化防御系统的关键酶[24]。本研究中,随养殖水温的升高,星洲红鱼血清SOD和POD活性逐步提高,这表明星洲红鱼随水温的升高可以使鱼体代谢加快及耗氧量增加,加快氧自由基的产生,从而引起抗氧化酶活性的升高,维持机体代谢平衡,提高机体的免疫力和抗病力。但长期在高温(35℃)下胁迫,星洲红鱼血清SOD和POD活性开始下降,清除自由基的能力则减弱,过多的自由基如不能被及时清除,将损害机体细胞和组织正常的生理机能和免疫防御能力,进而对病原生物的易感性提高[25],因此35℃时其成活率最低。这与李大鹏等[15]报道的中华鲟(Acipenser sinensis Gray)血清SOD活性在12~31℃范围内随养殖水温的升高先升后降,26℃时SOD活性最高,26℃之后,SOD活性略有下降的结果一致。
4 结 论
由此得出,养殖水温在27~34℃时星洲红鱼的生长快、消化能力强、免疫相关酶活性高;通过回归分析得出,当养殖水温为31℃时星洲红鱼的生长最佳。
参考文献:
[1] 黄永春,林祥日,许洪玉,等.星洲红鱼对温度适应性的研究[J].福建水产,2012,34(5):398-404.
[2] XIE X J,SUN R Y.The bioenergetics of the southern catfish(Silurus meridionalis Chen):growth rate as a function of ration level,bady weight,and temperature [J].Journal of Fish Biology,1992,40(5):719-730.
[3] BUREL C,PERSON⁃LE RUYET J,GAUMET F,et al.Effects of temperature on growth and metabolism in juvenile turbot[J].Journal of Fish Biology,1996,49 (4):678-692.
[4] BJÖRNSSON B,STEINARSSON A,ODDGEIRS⁃SON M.Optimal temperature for growth and feed con⁃version of immature cod(Gadus morhua L.)[J].IC⁃ES Journal of Marine Science,2001,58(1):29-38.
[5] 高淳仁,王印庚,马爱军,等.温度对大菱鲆幼鱼生长、成活率和体内蛋白酶活性的影响[J].海洋水产研究,2006,27(6):33-36.
[6] AZAZA M S,DHRAÏEF M N,KRAÏEM M M.Effects of water temperature on growth and sex ratio of juvenile Nile tilapia Oreochromis niloticus(Linnae⁃us)reared in geothermal waters in southern Tunisia [J].Journal of Thermal Biology,2008,33(2):98-105.
[7] 王辉,强俊,李瑞伟.温度对奥尼罗非鱼仔稚鱼生长、饲料利用和消化酶活力的影响[J].广东海洋大学学报,2008,28(6):14-19.
[8] ƔRNASON T,BJÖRNSSON B,STEINARSSON A,et al.Effects of temperature and body weight on growth rate and feed conversion ratio in turbot(Scophthalmus maximus)[J].Aquaculture,2009,295(3/4):218-225.
[9] 欧阳利剑,郭学武.温度对鱼类摄食及生长的影响[J].海洋科学集刊,2009(49):87-95.
[10] 刘红,汲长海,施正锋,等.温度对条纹石鮨蛋白消化酶活性影响的初步研究[J].水产科技情报,1998,25(3):103-107.
[11] 黎军胜,李建林,吴婷婷.饲料成分与环境温度对奥尼罗非鱼消化酶活性的影响[J].中国水产科学,2004,11(6):585-588.
[12] 赵东海.黄鳝消化酶活性与温度的关系[J].河北大学学报:自然科学版,2005,23(3):323-325.
[13] 田宏杰,庄平,章龙珍,等.水温对施氏鲟幼鱼消化酶活力的影响[J].中国水产科学,2007,14(1):126-131.
[14] 刘洋,牟振波,徐革锋,等.水温对细鳞鱼幼鱼消化酶活性的影响[J].水产学杂志,2011,24(3):6-9.
[15] 王文博,李爱华.环境胁迫对鱼类免疫系统影响的研究概况[J].水产学报,2002,26(4):368-374.
[16] 李大鹏,刘松岩,谢从新,等.水温对中华鲟血清活性氧含量及抗氧化防御系统的影响[J].水生生物学报,2008,32(3):327-332.
[17] 方美娟,刘凯,李智强,等.花血清免疫酶活力对水温耐受性的研究[J].浙江海洋学院学报:自然科学版,2010,29(4):336-339.
[18] BUCKLEY L J.Relationships between RNA/DNA ra⁃tio,prey density,and growth rate in Atlantic cod(Ga⁃dus morhua)larvae[J].Journal of the Fisheries Re⁃search Board of Canada,1979,36(12):1497-1502.
[19] HOFER R.Protein digestion and proteolytic activity in the digestive tract of an Omnivorous cyprinid[J].Comparative Biochemistry and Physiology Part A:Phtsiology,1982,72(1):55-63.
[20] HAINES T A.An evaluation of RNA/DNA ratio as a measure of long⁃term growth in fish populations[J].Journal of the Fisheries Research Board of Canada,1973,30(2):195-199.
[21] 区又君,罗奇,李加儿,等.卵形鲳鲹消化酶活性的研究Ⅳ.养殖水温和酶反应温度对幼鱼酶活性的影响[J].海洋渔业,2011,33(1):28-32.
[22] MUTA T,IWANGA S.The role of hemolymph coagu⁃lation in innate immunity[J].Current Opinion in Im⁃munology,1996,8(1):41-47.
[23] 王天神,周鑫,赵朝阳,等.不同温度条件下克氏原螯虾免疫酶活性变化[J].江苏农业科学,2012,40 (12):239-241.
[24] PARIHAR M S,JAVERI T,HEMNANI T,et al.Re⁃sponses of superoxide dismutase,glutathione peroxi⁃dase and reduced glutathione antioxidant defenses in gills of the freshwater catfish(Heteropneustes fossil⁃is)to short⁃term elevated temperature[J].Journal of Thermal Biology,1997,22(2):151-156.
[25] 宋林生,季延宾,蔡中华,等.温度骤升对中华绒螯蟹(Eriocheir sinensis)几种免疫化学指标的影响[J].海洋与湖沼,2004,35(1):74-77.
Effects of Cultural Water Temperature on Growth,Digestion and Immune of Singapore Red Tilapia(O.mossambicus)
HUANG Yongchun
(责任编辑 菅景颖)
(Fishery College of Jimei University,Xiamen 361021,China)
Author,HUANG Yongchun,associate professor,E⁃mail:ychuang@jmu.edu.cn
Abstract:In order to study the effects of different cultural water temperature on growth,digestion and im⁃munes of Singapore red tilapia(O.mossambicus),a total of 300 healthy Singapore red tilapia with the body weight of(25.1±2.3)g and body length of(12.5±1.5)cm were cultured at the water temperature was 15,20,25,30 and 35℃for 40 days,respectively.Each temperature had 3 replicates,and each replicate had 20 fish.The results showed that there was significant difference in the specific growth rate(SGR)at different cul⁃tural water temperature(P<0.05),which was 30℃>35℃>25℃>20℃>15℃.The regression relation of SGR(y)and cultural water temperature(x)was:y=-0.118 2x3+0.917x2-1.457 5x+1.082 7(r=0.997 8).The survival rate was 86.67%to 98.33%at different temperature,and the highest survival rate was at 15℃and the lowest survival rate was at 35℃,in which there was significant difference among different temperature groups(P<0.05)except 30 and 25℃groups(P>0.05).The feed conversion ratio at different temperature was 30℃>35℃>25℃>20℃>15℃,in which there was no significant difference among different tempera⁃ture groups(P>0.05)except 15 and 35℃groups(P<0.05).The muscle RNA/DNA was increased with cul⁃tural water temperature increasing from 15 to 30℃,and then decreased at 35℃,in which there were signifi⁃cant difference among different temperature groups(P<0.05)except 15 and 20℃(P>0.05).The activities of protease,amylase and lipase of hepatopancreas,intestine and stomach were firstly increased and then de⁃creased with cultural water temperature increasing,in which the activities of protease and amylase were de⁃creased after 30℃and the activity of lipase were decreased after 25℃.There were significant difference a⁃mong different temperature groups(P<0.05)except amylase activity at 25 and 35℃groups and lipase activity at 20 and 30℃groups(P>0.05).The activities of alkaline phosphatase(AKP),acid phosphatase(ACP),superoxide dismutase(SOD)and peroxydase(POD)in serum had the highest values at 30℃,and decreased at 35℃.Except serum SOD activity,there was significant diffenences in the activities of AKP,ACP and POD among different temperature groups(P<0.05)except 25 and 35℃groups(P>0.05).Therefore,Singapore red tilapia grow faster with stronger digestive ability and higher immune enzyme activities when the water tem⁃perature is 27 to 34℃.Regression anaylsis result shows that Singapore red tilapia has the best growth when the water temperature is 31℃.[Chinese Journal of Animal Nutrition,2015,27(7):2264⁃2271]
Key words:Singapore red tilapia(O.mossambicus);cultural water temperature;growth;digestive enzyme;immune enzyme
作者简介:黄永春(1966—),男,福建长汀人,副教授,博士,从事水产健康养殖和良种选育研究。E⁃mail:ychuang@jmu.edu.cn
基金项目:福建省质量监督局《星洲红鱼种质标准》(2011—2012);李尚大集美大学学科建设基金“星洲红鱼(red tilapia)种质特性和养殖生态学的研究”(ZC2010001)
收稿日期:2015-02-09
doi:10.3969/j.issn.1006⁃267x.2015.07.034
文章编号:1006⁃267X(2015)07⁃2264⁃08
文献标识码:A
中图分类号:S963
