胸苷磷酸化酶在肿瘤细胞中的表达及与卡培他滨治疗效果的关系
2016-01-06李海聪刘倩雯
李海聪,雷 建,刘倩雯,谭 军
(1.广州市番禺区第二人民医院外科,广州 511430; 2.广州医科大学附属第一医院外科,广州 510120)
胸苷磷酸化酶在肿瘤细胞中的表达及与卡培他滨治疗效果的关系
李海聪1,雷建2,刘倩雯1,谭军1
(1.广州市番禺区第二人民医院外科,广州 511430; 2.广州医科大学附属第一医院外科,广州 510120)
摘要:目的探讨胸苷磷酸化酶(thymidine phosphorylase,TP)在肿瘤细胞中的表达及与卡培他滨治疗效果的关系。方法选取280例肿瘤患者,其中胃癌94例、结直肠癌101例、乳腺癌85例。检测不同类型癌症的癌组织与其对应癌旁正常组织的TP表达,对不同癌症患者均给予卡培他滨治疗,比较各组治疗效果,并观察TP表达与卡培他滨治疗效果的关系。结果胃癌、结直肠癌、乳腺癌中TP表达阳性率分别为64.89%、69.31%、81.18%,均明显高于癌旁正常组织(均P<0.01);乳腺癌TP表达阳性率明显高于胃癌与结直肠癌(均P<0.01);胃癌、结直肠癌、乳腺癌采用卡培他滨治疗后疗效比较差异有统计学意义(P<0.05),其中乳腺癌的疾病控制率明显高于胃癌(P<0.05);采用卡培他滨治疗后TP阳性患者疾病控制率明显高于TP阴性患者(90.59%比37.18%,P<0.01)。结论与正常组织比较,TP在癌组织中呈过度表达;TP阳性表达的癌症患者采用卡培他滨治疗效果更为确切,故对于TP表达阳性的患者可选择使用卡培他滨进行治疗。
关键词:胸苷磷酸化酶; 肿瘤细胞; 卡培他滨
胸苷磷酸化酶(thymidine phosphorylase,TP)为嘧啶核苷合成及分解过程中所需的重要酶,在多种实体肿瘤细胞中呈过度表达。TP是促肿瘤微血管生长因子之一,可诱导血管生成,与肿瘤的生长和转移密切相关。相反地,TP又可通过催化5-氟尿嘧啶(5-FU)前体药物,起到化疗抗癌的作用[1]。卡培他滨是一种新型口服氟尿嘧啶类抗肿瘤药,以氨基甲酸酯的形式存在。卡培他滨本身无细胞毒性,氨基甲酸酯可促使其以原药形式被迅速吸收,再经酶的催化代谢为氟尿嘧啶,起到抗肿瘤的作用。卡培他滨代谢过程中TP是肿瘤组织内氟尿嘧啶选择性生成的关键酶,卡培他滨之所以在肿瘤组织内优先转化成氟尿嘧啶,是因为TP在肿瘤组织中比在正常组织中具有更高的活性[2]。本研究通过检测胃癌、结直肠癌、乳腺癌肿瘤细胞中TP的表达,探讨TP表达及与卡培他滨疗效的相关性。
1资料与方法
1.1一般资料
选取广州市番禺区第二人民医院及广州医科大学附属第一医院2011年6月至2014年5月收治的280例恶性肿瘤患者,男95例,女185例,年龄21~86岁,平均(52.7±4.8)岁。其中胃癌94例,结直肠癌101例,乳腺癌85例。同时收集所有患者手术切除癌组织标本以及周围正常组织标本。全部肿瘤与正常组织经组织病理学检查证实。
1.2治疗方法
所有患者均在基础化疗基础上加用卡培他滨治疗,其中胃癌采取奥沙利铂130 mg·m-2静脉滴注,第1天,亚叶酸钙200 mg·m-2,第1—5天,卡培他滨1 250 mg·m-2口服,2次·d-1,第1—14天,每3周重复,4周期为1个疗程;结直肠癌采取奥沙利铂130 mg·m-2静脉滴注,第1天,卡培他滨1 250 mg·m-2口服,2次·d-1,第1—14天,每3周重复,4周期为1个疗程;乳腺癌采取多西他赛75 mg·m-2静脉滴注,第1天,卡培他滨1 250 mg·m-2口服,2次·d-1,第1—14天,每3周重复,4周期为1个疗程。疗程结束后1个月进行疗效评定。
1.3疗效评定标准
参照WHO有关实体瘤药物治疗的疗效标准,分为完全缓解(CR)、部分缓解(PR)、无变化(NC)、疾病进展(PD)。其中CR+PR为有效,CR+PR+NC为疾病控制。
1.4TP检测方法
采取亲和组织化学技术:酶标链亲和素-生物素技术(S-P法)。使用双抗体夹心酶联免疫吸附法(ELISA)检测血清TP浓度。鼠抗人TP/PD-ECGF单克隆抗体购自美国LABVISION公司,PS超敏试剂盒购自福州迈新生物技术开发有限公司。染色步骤按试剂盒说明书进行。
1.5结果判定标准
胞质和(或)包膜内呈棕黄色染色即为阳性。将切片中阳性细胞占比评分与阳性显色细胞染色程度评分结合起来,以二者乘积作为判定结果。0~2分为阴性(-),3~4分为弱阳性(+),5~8分为中度阳性(),9~12分为强阳性()。≥3分为阳性,<3分为阴性。
1.6统计学方法
2结果
2.1TP表达
胃癌、结直肠癌、乳腺癌肿瘤细胞中TP表达阳性率分别为64.89%、69.31%、81.18%,均明显高于癌旁正常组织(均P<0.01);乳腺癌的TP表达阳性率明显高于胃癌与结直肠癌(P<0.01);正常胃组织与乳腺组织TP表达阳性率分别为14.29%、11.54%,正常结直肠组织则无表达。见表1。
2.2疗效
胃癌、结直肠癌、乳腺癌使用卡培他滨治疗后疗效比较差异有统计学意义(P<0.05),其中乳腺癌的疾病控制率明显高于胃癌(P<0.05),见表2。
2.3TP表达与卡培他滨疗效的关系
采用卡培他滨治疗后TP阳性患者疾病控制率为90.59%,TP阴性患者疾病控制率为37.18%,TP阳性患者疾病控制率明显高于TP阴性患者(P<0.01),见表3。
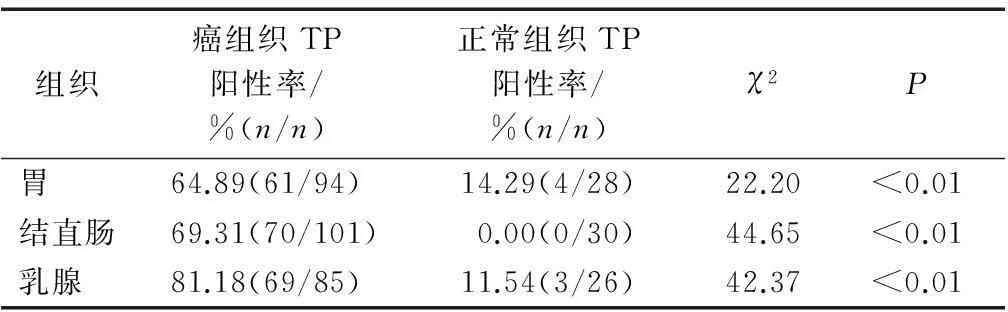
表1 不同癌组织与其相应正常组织TP表达的比较

表2 不同癌症卡培他滨治疗效果比较 例
*P<0.05与胃癌比较。

表3 直肠癌患者TP表达与卡培他滨疗效之间的关系
*P<0.01与TP阴性相比。
3讨论
癌细胞的增殖、转移、抗凋亡等恶性生物学行为和细胞生长因子的活性作用密不可分。TP是近年来发现的一种细胞生长因子,由2条多肽链构成的二聚体,其不仅在嘧啶核苷代谢中起到重要作用,还能促进血管生成[3]。TP在体内分布广泛,早在1990年Yoshimura等[4]就从人胎盘内提取出人TP,并以其制出抗体检测TP在人体各组织中的表达,发现TP在癌组织中的TP表达显著高于癌旁正常组织。本研究发现,胃癌、结直肠癌、乳腺癌癌组织中TP表达阳性率分别为64.89%、69.31%、81.18%,均明显高于癌旁正常组织,与Yoshimura等[4]的研究一致。
TP除了能诱导肿瘤血管生成,在肿瘤的治疗上同样能起着重要作用。TP可通过催化5-FU前体药物的活性,起到抗肿瘤作用[5]。故TP提供了治疗肿瘤的2个可能的作用靶点:其一是使用5-FU前体药物(如卡培他滨),通过提高肿瘤细胞组织内TP的表达,起到活化5-FU前体药物、增加癌细胞组织中药物浓度的作用;其二是通过抑制TP使癌细胞血管生成活性降低,经典的TP抑制剂主要为6-氨基-5-嗅尿嘧啶。
卡培他滨是5-FU前体药物的一种,是近年来用于临床的细胞毒类化疗新药,口服后可迅速吸收,并以完整药物进入肝脏。TP催化卡培他滨转化成5-FU的过程一般需经历3个序贯反应步骤。卡培他滨经肠道吸收后先经肝脏转化为5′-脱氧-5-氟胞嘧啶,再被肝脏及肿瘤组织转化为5-氟脱氧尿苷(5′-DFUR),5′-DFUR随着血液进入到肿瘤细胞中经TP转化为5-FU,进而阻断肿瘤细胞的DNA合成起到靶向抗肿瘤作用[2]。由于卡培他滨最大的特点为“选择性肿瘤内活化”,肿瘤组织5-FU浓度高,正常组织5-FU浓度低,故能最大限度地减少对正常组织的损害。由于TP在体内分布差异较大,故在TP表达水平高的肿瘤中应用卡培他滨疗效更为确切,检测肿瘤组织中的TP表达可作为提示化疗有效性的一个预测因子。本研究中,乳腺癌TP表达阳性率为81.18%,明显高于胃癌和结直肠癌,在对这3类癌症同剂量使用卡培他滨治疗后,乳腺癌的疾病控制率明显高于胃癌(P<0.05)。癌组织内TP的过度表达尽管是不良预后因素,但这也意味着在TP的作用下,卡培他滨在肿瘤组织中更易于被选择性激活,使肿瘤组织中5-FU浓度增加,进而增强抗肿瘤作用。
总之,TP的检测有利于了解肿瘤生物学特性,为肿瘤预后判断与治疗提供帮助。本研究中,采用卡培他滨治疗后TP阳性患者疾病控制率要明显高于TP阴性患者,故可对肿瘤患者检测TP,若TP为阳性者,可考虑选择卡培他滨治疗。
参考文献:
[1]卢振霞,邢洪存,郭芳芳.胸苷磷酸化酶在大肠癌组织中的表达及其临床意义[J].中国实验诊断学,2009,13(5):625-627.
[2]杨冬阳,黎莹,刘建化,等.晚期结直肠癌联合化疗后卡培他滨维持治疗的临床评价[J].南方医科大学学报,2013,33(12):1815-1818,1830.
[3]肖永胜,周俭,樊嘉,等.干扰素对肝癌细胞胸苷磷酸化酶表达和凋亡的双重影响[J].世界华人消化杂志,2009,17(35):3630-3634.
[4]Yoshimura A,Kuwazuru Y,Furukawa T,et al.Purification and tissue distribution of human thymidine phosphorylase;high expression in lymphocytes,reticulocytes and tumors[J].Biochim Biophys Acta,1990,1034(1):107-113.
[5]高庆,刘剑,张继民.结直肠癌组织胸苷磷酸化酶表达临床意义研究的现状[J].中华肿瘤防治杂志,2012,19(1):76-80.
(责任编辑:钟荣梅)
收稿日期:2015-01-28
基金项目:广州市番禺区科技计划项目(2013-Z03-34)
作者简介:李海聪(1978—),男,本科,主治医师,主要从事普通外科学的研究。
中图分类号:R73.3
文献标志码:A
文章编号:1009-8194(2015)07-0034-03
DOI:10.13764/j.cnki.lcsy.2015.07.012
Expression of Thymidine Phosphorylase in Tumor Cells
and Its Correlation with Curative Efficacy of Capecitabine
LI Hai-cong1,LEI Jian2,LIU Qian-wen1,TAN Jun1
(1.DepartmentofSurgery,theSecondPeople’sHospitalofPanyuDistrictof
Guangzhou,Guangzhou511430,China; 2.DepartmentofSurgery,theAffiliated
FirstHospitalofGuangzhouMedicalUniversity,Guangzhou510120,China)
ABSTRACT:ObjectiveTo investigate the expression of thymidine phosphorylase(TP) in tumor cells and its correlation with curative efficacy of capecitabine.MethodsThe expression of TP in cancer tissue and adjacent normal tissue was detected in 94 patients with gastric cancer,101 patients with colorectal cancer and 85 patients with breast cancer.All the 280 patients were treated with capecitabine.The curative efficacy was compared among different groups.In addition,the relationship between TP expression and capecitabine efficacy was observed.ResultsCompared with adjacent normal tissue,the positive rate of TP expression significantly increased in gastric cancer(64.89%),colorectal cancer(69.31%) and breast cancer(81.18%)(P<0.01).Compared with colorectal cancer or gastric cancer,the positive rate of TP expression significantly increased in breast cancer(P<0.01).There were significant differences in the curative efficacy of capecitabine among gastric cancer,colorectal cancer and breast cancer(P<0.05).Compared with patients with gastric cancer,the disease control rate significantly increased in patients with breast cancer(P<0.05).Compared with TP- negative patients,the disease control rate significantly increased in TP-positive patients after treatment with capecitabine(90.59%比37.18%,P<0.01).ConclusionCompared with normal tissue,TP expression increases in cancer tissue.The curative efficacy of capecitabine in TP-positive patients is more precise than that in TP- negative patients.Therefore,capecitabine treatment can be used in TP-positive patients.
KEY WORDS:thymidine phosphorylase; tumor cells; capecitabine
