常压室温等离子体诱变选育高产曲酸米曲霉
2016-01-05陈锡剑陈建华
陈锡剑,陈建华
(中国药科大学生命科学与技术学院,江苏 南京 210009)
常压室温等离子体诱变选育高产曲酸米曲霉
陈锡剑,陈建华
(中国药科大学生命科学与技术学院,江苏 南京 210009)
摘要:以米曲霉KA2308作为出发菌株,首次利用常压室温等离子体诱变技术选育高产曲酸菌株,通过96孔板高通量筛选获得一株曲酸生产菌KA1515,曲酸产量提高到47.28 g·L-1,比出发菌株提高了31.48%,经过多次传代,曲酸产量仍比较稳定。表明采用常压室温等离子体诱变能有效提高米曲霉曲酸产量。
关键词:米曲霉;曲酸;常压室温等离子体诱变;突变株;高通量筛选
曲酸(kojic acid)是微生物有氧发酵产生的一种有机酸,具有抑制酪氨酸酶的作用[1-2]及抗菌活性[3-4],因此被广泛用作食品防腐剂、保鲜护色剂[5-6]及美白添加剂[7]。微生物发酵是曲酸工业化生产的主要途径,由于曲酸是微生物代谢的次级产物,其合成过程较复杂,合成机制至今仍不清楚,因此,应用基因工程的方法提高曲酸产量仍有困难。目前,诱变育种提高发酵菌种的产酸量仍是研究的重点。
多年来,学者们通过运用多种不同的诱变方法进行曲酸生产菌株的选育,获得了一些曲酸高产菌株,但诱变方法仍以传统的物理诱变(如紫外诱变[8])和化学诱变(如EMS[9])居多。传统的物理诱变回复突变严重,而化学诱变的诱变剂多数有强致癌性,存在安全隐患。虽然近年来出现了一些新的诱变手段,如60Co[10]、N+离子注入[11],但这类方法普遍设备昂贵,不易操作,因此应用范围有限。常压室温等离子体(atmospheric and room temperature plasma,ARTP)生物诱变育种技术是一种新型的诱变手段,具有射流温度低、产生的等离子体均匀、无需真空装置、操作简单、成本低、与生物大分子和细胞作用明显等优点[12]。目前已应用于酵母[13]、大肠杆菌[14]及刺糖多孢菌[15]等多种微生物诱变选育并取得良好效果,但尚未有利用ARTP诱变选育曲酸生产菌株米曲霉的报道。作者首次利用ARTP诱变育种仪对本实验室选育保藏的米曲霉KA2308进行诱变,并通过96孔板进行高通量筛选,得到一株较为稳定的曲酸高产菌株。
1实验
1.1 菌种与培养基
米曲霉(Aspergillusoryzae)KA2308,本实验室选育保藏。
麦芽汁琼脂培养基:自制麦芽汁 6°Bé,琼脂2%。
初筛培养基:葡萄糖 10%,酵母膏 0.25%,KH2PO40.1%,KCl 0.05%,MgSO4·7H2O 0.05%,pH值自然。
发酵培养基:葡萄糖 10%,酵母膏 0.4%,K2HPO40.01%,MgSO4·7H2O 0.02%,pH值6.0。
1.2 试剂与仪器
曲酸,Sigma公司;琼脂粉、磷酸氢二钾、磷酸二氢钾、磷酸、盐酸,南京化学试剂有限公司;葡萄糖,国药集团化学试剂有限公司;硫酸镁,上海美兴化工股份有限公司;酵母膏,江山生物试剂有限公司。
ARTP-Ⅱ型诱变育种仪,无锡源清天木生物科技有限公司;PHS-25型pH测量仪,上海雷磁仪器厂;摇床,上海智诚分析仪器制造有限公司;TGL-16型台式高速离心机,金坛科析仪器有限公司;722S型可见分光光度计,上海棱光技术有限公司;GHX-9080B-1型隔水式恒温培养箱,上海福玛实验设备有限公司。
1.3 出发菌株的筛选
将米曲霉KA2308活化,挑取27株单菌落,用摇瓶发酵后,取上清液用三氯化铁比色法选出曲酸产量最高的菌株,作为诱变的出发菌株。
1.4 菌种诱变
1.4.1孢子悬浮液的制备
取培养5 d的斜面,用生理盐水洗下孢子,将孢子打散后过滤得到孢子悬浮液,用血细胞计数板计数,调节孢子数约为106个·mL-1。
1.4.2ARTP诱变
将孢子悬浮液适当稀释后,在诱变育种仪上进行诱变,诱变时间分别为100 s、120 s、140 s、160 s、180 s、200 s,处理0 s作为对照,处理结束后用生理盐水进行洗脱,适当稀释后取100μL涂平板,30 ℃培养箱中倒置培养2 d。
1.4.3高通量筛选方法
挑取单菌落于30 ℃斜面培养3 d,在96孔板中加入200μL初筛培养基,取适量菌丝至孔中,30 ℃培养3 d后取适量培养液至另一96孔板中,加1滴FeCl3溶液显色,适当稀释后用酶标仪测OD500值。
1.4.4摇瓶复筛
将一环初筛较高的菌株的孢子接入发酵培养基中进行复筛,培养条件:500 mL 锥形瓶装液量40 mL,摇床转速200 r·min-1,30 ℃发酵5 d。
1.4.5突变株的遗传稳定性考察
通过5次菌种传代,并测定曲酸产量,考察突变菌株的遗传稳定性。
1.5 测定方法[16]
1.5.1曲酸标准曲线的绘制
1)显色剂的配制
称取10 g FeCl3,加入22.5 mL浓盐酸,用蒸馏水定容到1 000 mL。
2)标准曲线的绘制
准确称取曲酸标准品0.1000 g,溶于蒸馏水中,定容至100 mL,用吸管分别吸取0 mL、1 mL、2 mL、3 mL、4 mL、5 mL、6 mL、7 mL、8 mL、9 mL标准品样液于10个100 mL容量瓶中,分别加入显色剂2 mL,定容至100 mL,得到浓度分别为0.000 g·L-1、1.000 g·L-1、2.000 g·L-1、3.000 g·L-1、4.000 g·L-1、5.000 g·L-1、6.000 g·L-1、7.000 g·L-1、8.000 g·L-1、9.000 g·L-1的标准溶液,在波长500 nm下分别测定吸光度(OD500),绘制标准曲线。
1.5.2发酵液中曲酸含量的测定
发酵液适当稀释后,取1 mL稀释液至100 mL容量瓶中,加入2 mL显色剂,蒸馏水定容至100 mL,500 nm下测定吸光度,由线性回归方程计算得曲酸浓度,乘以稀释倍数后即得发酵液中曲酸含量。
2结果与讨论
2.1 曲酸标准曲线
曲酸能和0.1×10-6的Fe3+不可逆反应生成红色络合物,该络合物在500 nm波长处有吸收峰,且在一定范围内,曲酸浓度与OD500值呈正比。三氯化铁比色法较为灵敏,广泛用于曲酸含量测定[11,17-18]。
以曲酸标准溶液浓度为横坐标、OD500值为纵坐标,绘制标准曲线,结果如图1所示。
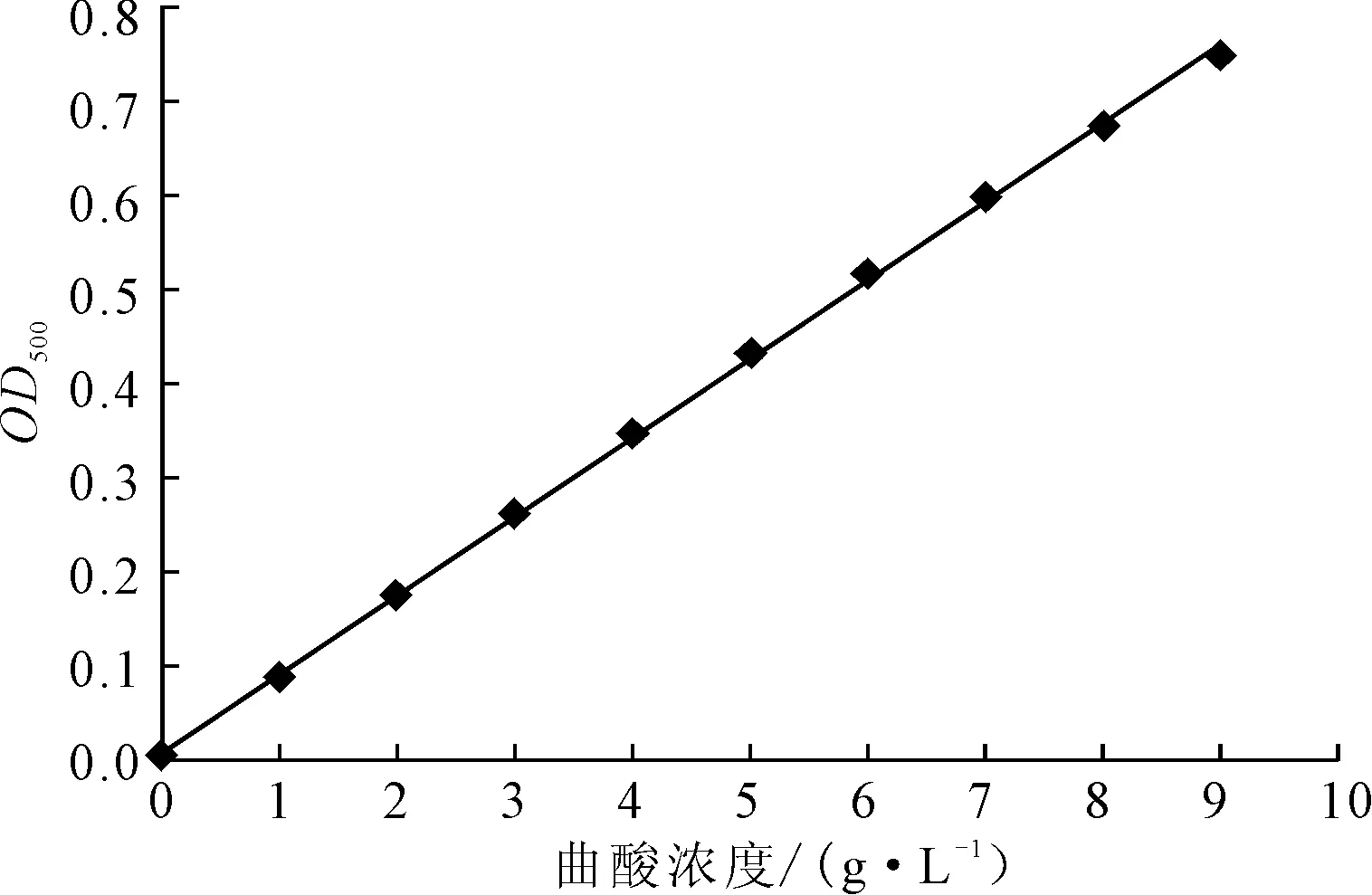
图1 曲酸标准曲线Fig.1 Standard curve of kojic acid
由图1拟合得线性回归方程为:y=0.832x+0.0096,式中y为OD500值,x为样品中曲酸浓度(g·L-1),R2=0.9993。
2.2 出发菌株的筛选结果
将本实验室保藏的米曲霉菌种活化后得到27个单菌落,对这27株菌进行筛选,结果如图2所示。

图2 出发菌株选育结果Fig.2 The breeding results of original strain
由图2可知,编号为KA2308-11菌株产酸最高,故选定KA2308-11菌株为诱变出发菌株,原始产酸量为35.96 g·L-1。
2.3 ARTP诱变致死率及选育结果
由于米曲霉的孢子具有较厚的孢子壁,需要较长的处理时间。ARTP诱变选育的致死率曲线见图3。

图3 ARTP诱变致死率曲线Fig.3 The lethal rate curve of ARTP
由图3可知,对米曲霉的孢子诱变处理时间为100~200 s。随着诱变时间的延长,菌体的致死率不断上升;处理100~180 s的致死率差别不大,均在90%左右;但当处理200 s时,致死率明显提高到99.61%。因此,选择诱变处理时间为200 s。
2.4 高产曲酸菌株的筛选
由于高产菌株曲酸产量较高,与FeCl3反应后颜色较深,可适当稀释后借助酶标仪测定其OD500值来筛选。本实验用96孔板法初筛得到5株高产菌株,将这5株菌摇瓶发酵进行复筛,最终得到一株曲酸产量达到47.28 g·L-1的高产菌株KA1515,产酸能力比出发菌株提高了31.48%。
2.5 突变株的遗传稳定性
为了考察曲酸高产菌株KA1515的遗传稳定性,进行了菌种传代实验,结果如图4所示。

图4 KA1515菌株斜面传代稳定性Fig.4 Genetic stability of the strain KA1515 on slant culture
由图4可知,KA1515在摇瓶发酵培养条件下,连续传代5次,曲酸产量均维持在47 g·L-1左右,表明突变株KA1515遗传性能稳定,具有一定工业生产潜力和应用价值。
2.6 讨论
经典的诱变育种造成微生物遗传性状的改变是随机的,筛选工作费时费力,如何在大量的随机突变中快速筛选出目标菌株,成为制约诱变育种的瓶颈。三氯化铁比色法是测定曲酸含量的常规方法,但该法较为繁琐且耗时、耗力,难以实现菌株的高通量筛选。多种发酵技术可用于曲酸发酵,如深层发酵、固态和表面培养、分批发酵培养、分批补料发酵培养、连续发酵培养等。表面静置培养是指让霉菌在没有任何搅拌或振荡的固体或液体培养基上生长的技术,96孔板静置培养结合三氯化铁显色反应能够定性地筛选出曲酸正突变株,操作简单,适合大批量筛选,大大提高了筛选效率,是一种可靠的高通量初筛方法。
3结论
以米曲霉KA2308为出发菌株,采用新型的ARTP诱变手段进行诱变,得到一株曲酸产量为47.28 g·L-1的高产菌株,产酸能力比出发菌株提高了31.48%,且该菌株产酸性能较为稳定,说明ARTP诱变育种是有效可行的提高曲酸产量的育种手段。
参考文献:
[1]刘波.曲酸对苹果汁酶促褐变抑制作用的研究[J].四川食品与发酵,2007,43(5):39-41.
[2]陆珊,胡源,刘鑫,等.曲酸对马铃薯酪氨酸酶的抑制作用研究[J].化学研究与应用,2005,17(6):729-732.
[3]苏国成,汤凤霞,杨秋明,等.曲酸对常见食品污染菌的抑制作用[J].食品与发酵工业,2005,31(3):47-51.
[4]董静,孟宪军.曲酸的抑菌作用研究[J].粮油加工,2009,(12):175-177.
[5]滕晓焕,曾维丽.曲酸及其在食品工业中的应用[J].科技咨询导报,2007,(11):248-249.
[6]陶文沂,孙微,许正宏,等.曲酸在食品中的应用[J].中国食品添加剂,2000,(2):26-31.
[7]MASSE M O,DUVALLET V,BORREMANS M,et al.Identification and quantitative analysis of kojic acid and arbutine in skin-whitening cosmetics[J].Int J Cosmet Sci,2001,23(4):219-232.
[8]宋德贵,侯美珍,卫军,等.曲酸生产菌的紫外线诱变及发酵条件研究[J].广西师范大学学报(自然科学版),2006,24(1):89-93.
[9]YAN S,TANG H,WANG S,et al.Improvement of kojic acid production inAspergillusoryzaeB008 mutant strain and its uses in fermentation of concentrated corn stalk hydrolysate[J].Bioprocess and Biosystems Engineering,2014,37(6):1095-1103.
[10]孙微,陶文沂.曲酸菌选育及发酵工艺研究[J].微生物学通报,1997,24(5):274-277.
[11]凌帅,刘咏,姚建铭,等.紫外线与N+注入复合诱变选育曲酸高产菌株[J].食品科学,2013,34(1):234-238.
[12]张雪,张晓菲,王立言,等.常压室温等离子体生物诱变育种及其应用研究进展[J].化工学报,2014,65(7):2676-2684.
[13]王方方,孙沛勇,银会娟,等.常压室温等离子体快速诱变酒精酵母及其突变株的特性研究[J].中国酿造,2013,(10):117-119.
[14]万青,曹伟佳,张常青,等.常压室温等离子体诱变高效利用木糖产丁二酸菌株[J].生物工程学报,2013,29(11):1692-1695.
[15]乔长晟,赵男,石漫漫,等.基于核糖体工程理论的常压室温等离子体诱变筛选多杀菌素高产菌[J].中国生物工程杂志,2014,(1):71-78.
[16]卫军,刘凤珠,马歌丽,等.曲酸生产菌种的分离筛选与发酵条件研究[J].食品工业科技,2003,24(4):17-19.
[17]赵鑫,赵金,吴思国,等.曲酸高产菌株的诱变选育[J].激光生物学报,2010,19(4):542-545.
[18]解西玉,曾柏全,周小芹,等.曲酸生产菌的60Co-γ射线诱变选育及表征[J].食品工业科技,2010,(12):212-237.
Mutation ofAspergillusOryzaeby Atmospheric and Room Temperature Plasma for Improving Kojic Acid Production
CHEN Xi-jian,CHEN Jian-hua
(SchoolofLifeScience&Technology,ChinaPharmaceuticalUniversity,Nanjing210009,China)
Abstract:The strain of Aspergillus oryzae KA2308 was exposed on atmospheric and room temperature plasma(ARTP) jet to improve kojic acid production for the first time.A high kojic acid-producing strain KA1515 was obtained by high-throughput screening method with 96-well plates.The yield of kojic acid of mutant reached up to 47.28 g·L-1,increasing by 31.48% compared with original strain.Kojic acid yield was stable after several passages.The results showed that mutation by atmospheric and room temperature plasma could raise kojic acid yield of Aspergillus oryzae effectively.
Keywords:Aspergillus oryzae;kojic acid;atmospheric and room temperature plasma(ARTP);mutant strain;high-throughput screening
中图分类号:TQ 921.7
文献标识码:A
文章编号:1672-5425(2015)05-0052-03
doi:10.3969/j.issn.1672-5425.2015.05.013
收稿日期:2015-02-01
作者简介:陈锡剑(1988-),女,河北唐山人,硕士研究生,研究方向:生物转化;
通讯作者:陈建华,教授,E-mail:chenjhnj@163.com。
