Fmoc保护氨基酸-卟啉化合物的设计合成与光谱性能研究
2016-01-05刘晓星甄亚枝邢晓丽陶敏莉
刘晓星,甄亚枝,邢晓丽,陶敏莉
(1.天津大学理学院化学系,天津 300072;2.天津化学化工协同创新中心,天津 300072)
Fmoc保护氨基酸-卟啉化合物的设计合成与光谱性能研究
刘晓星1,2,甄亚枝1,2,邢晓丽1,2,陶敏莉1,2
(1.天津大学理学院化学系,天津 300072;2.天津化学化工协同创新中心,天津 300072)
摘要:为了获得结构和性能更加接近天然卟啉的合成卟啉化合物,采用Fmoc保护氨基酸(甘氨酸、缬氨酸、L-酪氨酸),将氨基酸引入卟啉体系,设计合成了系列新型卟啉-氨基酸化合物,并对其光谱性能进行了研究。结果表明,在合成以酯键相连的卟啉-氨基酸化合物时,甘氨酸、缬氨酸反应生成含有2个氨基酸单元的化合物,L-酪氨酸生成含1个氨基酸单元的化合物。在合成以酰胺键相连的化合物时,反应得到含有1个氨基酸单元的化合物。卟啉的光谱性能不因不同Fmoc保护氨基酸单元的引入而改变。
关键词:Fmoc保护;卟啉-氨基酸化合物;互变异构;光谱性能
卟啉化合物是细胞色素、叶绿素及血红蛋白等生物大分子的核心部分,在生物体系中有着十分重要的作用。氨基酸是蛋白质的基本单元,引入氨基酸侧链对卟啉环进行修饰,可使人工合成的卟啉化合物在结构和性能上更加接近天然卟啉,有利于模拟生物过程[1]。
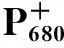
氨基酸含有1个碱性氨基和1个酸性羧基,可形成内盐。氨基活性比羧基高,当以羧基为反应基团时,需要易于脱去的基团保护分子中的氨基。在众多的氨基保护方法中, Boc(叔丁氧羰基)保护法和Fmoc(9-芴甲氧羰基)保护法最常用且互补。Boc保护法适用于碱性条件, Fmoc保护法适用于酸性条件[3-4]。作者采用Fmoc保护法对氨基酸中的氨基进行保护,再用SOCl2活化羧基,将氨基酸(甘氨酸、缬氨酸、L-酪氨酸)引入卟啉体系,设计合成了系列新型卟啉-氨基酸衍生物,对其光谱性能进行了系统研究,并对其生成机理进行了探讨。
1实验
1.1 试剂与仪器
所用试剂均为分析纯。CH2Cl2用CaH2回流干燥;吡咯、SOCl2用前重馏;5-对羟基苯基-10,15,20-三萘基卟啉(TNPPOH)、5-对氨基苯基-10,15,20-三苯基卟啉(ATPP)的合成参照文献[5-6]。
VG ZAB-HS与Finnigan LCQ型质谱仪;Bruker 400 MHz型核磁共振仪;Varian CARY ECLIPSE型荧光分光光度计;Thermo Spectronic,Helios Gamma型紫外可见光谱仪; LP920型激光闪光光解光谱仪。
1.2 方法
1.2.1Fmoc保护氨基酸的合成(图1)
1)1a的合成
向单口烧瓶中加入甘氨酸0.3 g(3.9 mmol)、K2CO3水溶液8.3 mL(10%质量分数),冰浴冷却至5 ℃以下。将芴甲氧羰酰琥珀酰亚胺1.1 g(Fmoc-OSu,3.3 mmol)溶于7.5 mL 1,4-二氧六环中,快速倒入反应液中,室温搅拌20 min。加100 mL水稀释,用乙醚萃取除去油溶性杂质。在控制水相温度不超过5 ℃的条件下,用浓盐酸调节pH值至2, 乙酸乙酯萃取,有机相用30 mL水洗涤2次,再用30 mL 饱和食盐水溶液洗涤1次,干燥,过滤,减压蒸馏得1a 1.02 g,收率88.0%。熔点177~178 ℃(文献[7]值:174~175 ℃)。

图1 Fmoc保护氨基酸的合成路线Fig.1 Synthetic routes of Fmoc-amino acid
2)1b的合成
以缬氨酸为原料,按上述方法合成,无水MgSO4干燥,过滤,蒸除溶剂,用100 mL石油醚和10 mL CH2Cl2重结晶得1b 0.97 g,收率82.3%。熔点142~143 ℃(文献[8]值:142~144 ℃)。
3)1c的合成
将L-酪氨酸0.9 g(5 mmol)溶于15 mL四氢呋喃和10 mL水中,加入NaOH水溶液5 mL(1 mol·L-1),并在搅拌下加入Fmoc-OSu 1.69 g(5 mmol),反应液用NaOH水溶液调节pH值至7,继续搅拌6 h。向上述溶液中加入固体柠檬酸1.5 g,乙酸乙酯萃取,有机相用30 mL柠檬酸水溶液(10%质量分数)洗涤2次,饱和食盐水溶液洗涤1次,干燥,过滤,蒸除溶剂,用CH2Cl2重结晶得1c 1.74 g,收率89.4%。熔点126~130 ℃(文献[9]值:120~124 ℃)。
1.2.2以酰胺键相连的卟啉-氨基酸化合物的合成(图2)
称取1a~1c 0.5 mmol溶于10 mL干燥CH2Cl2中,加入3 mL新蒸SOCl2,在55~60 ℃条件下反应2 h。反应完成后,多次加入干燥CH2Cl2,减压蒸馏除去残余的SOCl2。45 ℃真空干燥过夜,得到中间体2a~2c。
将5-对氨基苯基-10,15,20-三苯基卟啉20 mg(0.03 mmol)溶于5 mL干燥CH2Cl2中,加入三乙胺0.1 mL,冰浴冷却至5 ℃以下。向反应液中缓慢滴入溶于10 mL干燥CH2Cl2的中间体2a~2c,薄层色谱跟踪反应至原料点消失,蒸除溶剂,柱色谱分离提纯(CH2Cl2/乙酸乙酯),得蓝紫色固体,3a:27 mg,收率93.7%;3b:28 mg,收率92.7%;3c:26 mg,收率80.7%。

图2 以酰胺键相连的卟啉-氨基酸化合物的合成路线Fig.2 Synthetic routes of the porphyrin-amino acid adducts connected by amide bond
1.2.3以酯键相连的卟啉-氨基酸化合物的合成(图3)
将5-对羟基苯基-10,15,20-三萘基卟啉20 mg(0.025 mmol)溶于5 mL干燥CH2Cl2中,加入三乙胺0.1 mL,冰浴冷却至5 ℃以下。向反应液中缓慢滴加溶于10 mL干燥CH2Cl2的中间体2a~2c,冰浴反应30 min后,室温反应24 h,蒸除溶剂,柱色谱分离提纯(CH2Cl2/乙酸乙酯),得蓝紫色固体,4a:5 mg,收率17.4%;4b:6 mg,收率19.4%;4c:12 mg,收率40.1%。
2结果与讨论
2.1 卟啉-氨基酸化合物的合成
当羟基卟啉与Fmoc保护甘氨酸和缬氨酸缩合时,得到了含有2个氨基酸单元的化合物f(4a,4b),而并未得到预期产物d。可能的反应过程如图4所示。

图3以酯键相连的卟啉-氨基酸化合物的合成路线
Fig.3Synthetic routes of the porphyrin-amino acid adducts connected by ester bond

图4 2个氨基酸单元化合物的可能的生成过程Fig.4 The process that may generate two amino acid units adducts
在生成含有1个氨基酸单元的化合物d后,羰基氧与氨基氢发生氢键作用,形成五元环过渡态e,氨基的亲核性增强,与反应液中过量的酰氯继续反应,最终生成含有2个氨基酸单元的化合物f。f中*标记的羰基氧与*标记的氨基氢作用,无法活化**标记的氨基,不再继续反应。为了验证上述推论,将含有2个氨基酸单元的化合物4a与过量的2b在常温下反应48 h,结果发现并未生成含有3个氨基酸单元的目标产物。
另外,含有2个氨基酸单元侧链化合物的生成,是进攻五元环背面的氮原子,空间位阻过大的取代基不再继续发生反应。L-酪氨酸具有较大的空间位阻,使反应停留在1个氨基酸单元阶段,生成化合物4c。
当Fmoc保护氨基酸与氨基卟啉缩合时,首先生成含有1个氨基酸单元的酰胺结构,因存在酰胺与烯醇胺的互变异构(图5),无法形成五元环过渡态,羰基氧不再对氨基进行活化,因此不再进一步发生反应。

图5 酰胺键的异构化Fig.5 Tautomerism of amide bond
2.2 化合物稳态光谱性能研究
2.2.1紫外可见吸收光谱
卟啉-氨基酸化合物的紫外可见吸收光谱数据如表1所示(溶剂为CH2Cl2,浓度为5×10-6mol·L-1)。

表1 卟啉-氨基酸化合物的紫外可见吸收光谱数据/nmTab.1 UV-Vis Absorption spectral data of porphyrin-amino acid adducts/nm
由表1可知,所有Fmoc保护氨基酸-卟啉化合物均具有自由碱卟啉的特征吸收光谱。化合物3a~3c、4a~4c的吸收峰位置相近,这表明卟啉的光谱性能不因不同Fmoc保护氨基酸的引入而改变。
2.2.2荧光光谱
以酰胺键相连得到的卟啉-氨基酸化合物的荧光光谱如图6所示(溶剂为CH2Cl2,浓度为5×10-6mol·L-1)。
由图6可知,与紫外可见吸收光谱相对应,化合物3b、3c发射峰的位置、强度也几乎一致,发射波长较母体卟啉发生蓝移,这表明化合物3b、3c的激发态与基态之间的能级差增大。
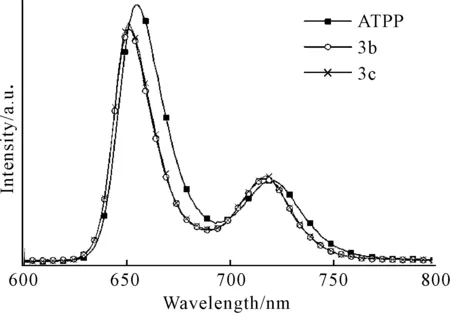
图6 以酰胺键相连的卟啉-氨基酸化合物的荧光发射光谱Fig.6 Fluorescence emission spectra of porphyrin-amino acid adducts connected by amide bond
以酯键相连的卟啉-氨基酸化合物的荧光光谱及在590 nm激发下的发射光谱数据如表2所示(溶剂为CH2Cl2,浓度为5×10-6mol·L-1)。

表2 以酯键相连的卟啉-氨基酸化合物的荧光光谱数据/nmTab.2 Foluorescence spectral data of porphyrin-amino acid adducts connected by ester bond/nm
由表2可知,以最大吸收波长的光为激发光时,化合物的发射波长较相应的母体卟啉发生不同程度蓝移;在590 nm下激发,化合物的发射光谱与最大吸收波长激发下的发射光谱一致。这是由于分子吸收不同能量的光量子后,无论被激发到哪一个激发态上,都会很快通过内部转换和振动弛豫回到第一激发态的最低振动能级上,并且这些非辐射去活化过程的速度远远大于由较高激发态直接发射光子回到基态的速度,因此电子最终都从第一激发态最低振动能级辐射跃迁回到基态的各振动能级上,所以不同激发波长下的发射光谱是相同的。
2.3 化合物瞬态光谱性能研究
图7为Fmoc保护氨基酸-卟啉化合物3a的瞬态吸收光谱,该化合物在540 nm、570 nm、615 nm、675 nm、780 nm处出现吸收峰。与母体卟啉的瞬态吸收光谱一致,归属为卟啉三重态特征吸收,卟啉阳离子自由基P+的特征吸收没有出现,说明体系中没有发生分子内的电子传递,Fmoc保护氨基酸的引入对卟啉化合物的光学性能没有明显的影响。由于氧气对激发三重态有很强的猝灭作用,因此三重态寿命会因空气的通入而明显缩短,如图8所示。

图7 化合物3a的瞬态吸收光谱Fig.7 Transient absorption spectrum of compound 3a
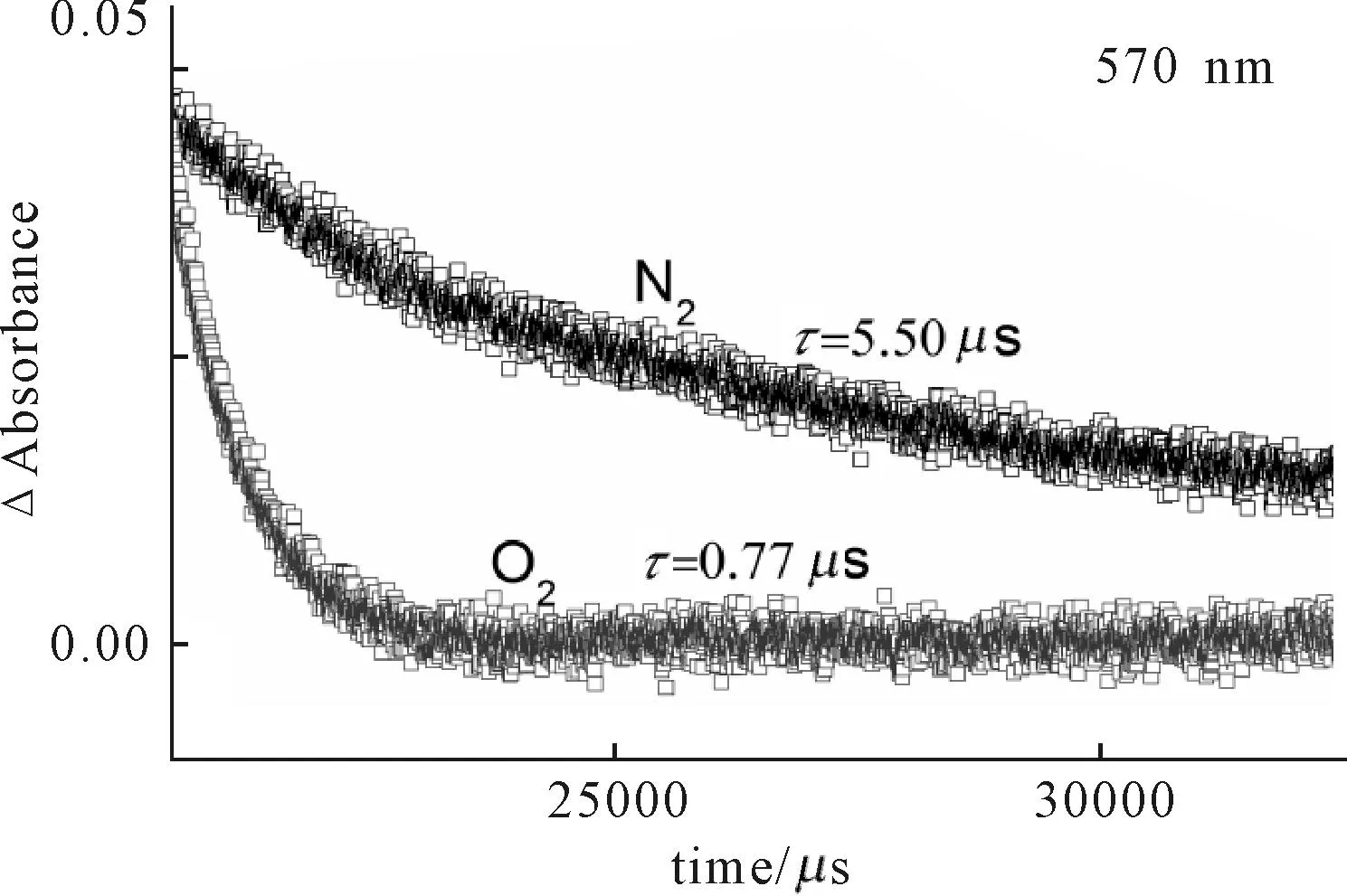
图8 化合物3a在570 nm处的动力学衰减曲线Fig.8 Kinetic decay curves of compound 3a at 570 nm
2.4 结构表征
3a:1HNMR (CDCl3),δ:-2.78(s,2H),4.16(s,2H),4.26~4.28(m,1H),4.53~4.55(d,J=5.2 Hz,2H),5.79(s,1H),7.24~7.30(m,2H),7.31~7.38(m,2H),7.62~7.70(m,2H),7.71~7.77(m,11H),7.87~7.89(d,J=6.4 Hz,2H),8.15~8.22(m,8H),8.59(s,1H),8.84(s,8H);ESI-MS(m/z):909.5(M++1),731.4,687.5。
3b:1HNMR (CDCl3),δ:-2.77(s,2H),1.12(m,6H),2.20(s,1H),4.28~4.32(m,1H),4.47(s,1H),4.57~4.59(d,J=6.4 Hz,2H),5.47(s,1H),7.26~7.36(m,2H),7.39~7.43(m,2H),7.61~7.67(m,2H),7.71~7.79(m,11H),7.92~7.99(m,2H),8.17~8.23(m,8H),8.47(s,1H),8.86(s,8H);ESI-MS(m/z):951.5(M++1),773.3,729.5。
3c:1HNMR (CDCl3),δ:-2.78(s,2H),3.21(s,2H),4.23~4.27(t,1H),4.51~4.53(m,2H),4.64(s,1H),5.61(s,1H),6.81~6.83(d,J=7.6 Hz,2H),7.19(s,2H),7.26~7.33(m,2H),7.38~7.41(m,2H),7.57~7.61(m,2H),7.71~7.77(m,13H),8.13~8.23(m,8H),8.58(s,1H),8.85(s,8H);ESI-MS(m/z):1 015.4(M++1),849.3,837.2,793.3。
4a:1HNMR (CDCl3),δ:-2.38(s,2H),4.03(s,4H),4.26(s,1H),4.50(s,2H),5.43(s,1H),6.63(s,1H),7.58~7.67(m,13H),7.74~7.87(m,6H),8.12~8.29(m,14H),8.48(s,4H),8.58(s,2H),8.74(s,2H);FAB-MS(m/z):1 117.1(M+)。
4b:1HNMR(CDCl3),δ:-2.38(s,2H),4.03(s,4H),4.26(s,1H),4.50(s,2H),5.55(m,1H),6.55(m,1H),7.46~7.55(m,13H),7.76~7.88(m,6H),8.09~8.31(m,14H),8.48(s,4H),8.59(s,2H),8.75(s,2H);FAB-MS(m/z):1 201.3(M+)。
4c:1HNMR (CDCl3),δ:-2.39(s,2H),3.32~3.40(m,2H),4.26~4.44(m,1H),4.47~4.55(m,2H),5.01(s,1H),5.44~5.45(d,J=5.2 Hz,1H),6.83~6.85(d,J=8.0 Hz,2H),7.11(s,2H),7.33~7.57(m,11H),7.62~7.68(m,2H),7.77~7.87(m,6H),8.09~8.29(m,14H),8.47(s,4H),8.59(s,2H),8.75(s,2H),10.00(s,1H);ESI-MS(m/z):1 166.4(M+),988.4,944.2,781.3。
3结论
采用Fmoc保护氨基酸,SOCl2活化氨基酸中羧基,向卟啉体系中引入氨基酸侧链,合成了6个未见文献报道的新型卟啉-氨基酸化合物,并对其光谱性能进行了研究。在合成以酯键相连的卟啉-氨基酸化合物时,氨基酸中的氨基受邻近羰基的活化,进一步反应生成含有2个氨基酸单元的化合物,因L-酪氨酸具有较大的空间位阻,反应生成含1个氨基酸单元的化合物。在合成以酰胺键相连的化合物时,由于存在酰胺与烯醇胺的互变异构,无法形成五元环过渡态,羰基氧原子不再对氨基进行活化,因此不发生进一步反应,得到含1个氨基酸单元的化合物。卟啉-氨基酸化合物的光谱性能不因不同Fmoc保护氨基酸的引入而改变,这为设计合成含有氨基酸基团的卟啉衍生物奠定了基础。
参考文献:
[1]金晓敏,吴健.氨基酸卟啉衍生物的合成[J].浙江大学学报(理学版),2003,30(2):183-187.
[2]MAGNUSON A,BERGLUND H,KORALL P,et al.Mimicking electron transfer reactions in photosystem Ⅱ:Synthesis and photochemical characterization of a ruthenium(Ⅱ) tris(bipyridyl) complex with a covalently linked tyrosine[J].Journal of American Chemical Society,1997,119(44):10720-10725.
[3]ADAMSON J G,BLASKOVICH M A,GROENEVALT H,et al.Simple and convenient synthesis of tert-buty ethers of Fmoc-serine,Fmoc-threonine and Fmoc-tyrosine[J].Journal of Organic Chemistry,1991,56(10):3447-3449.
[4]CARPINO L A,HAN G Y.The 9-fluorenylmethoxycarbonyl amino-protecting group[J].Journal of Organic Chemistry,1972,37(22):3404-3409.
[5]KRUPER W J,CHAMBERLIN T A,KOCHANNY M.Regiospecific aryl nitration ofmeso-substituted tetraarylporphyrins:A simple route to bifunctional porphyrins[J].Journal of Organic Chemistry,1989,54(11):2753-2756.
[6]TAO M L,ZHOU X Q,JING M,et al.Fluorescence and electrochemical properties of naphthylporphyrins and porphyrin-anthraquinone dyads[J].Dyes and Pigments,2007,75(2):408-412.
[7]NOWSHUDDI S,RAO M N A,REDDY A R.Efficient procedure for the preparation of oligomer-free N-Fmoc amino acids[J].Synthetic Communications,2009,39(11):2022-2031.
[8]HENKLEIN P,HEYNE H U,HALATSCH W R,et al.5-Norbornene-2,3-dicarboximido carbonochloridate.A new stable reagent for the introduction of amino-protecting groups[J].Synthesis,1987,(2):166-167.
[9]JENSEN K J,MELDAL M,BOCK K.Glycosylation of phenols:Preparation of 1,2-cisand 1,2-transglycosylated tyrosine derivatives to be used in solid-phase glycopeptide synthesis[J].Journal of the Chemical Society,Perkin Transactions 1,1993,(17):2119-2129.
Synthesis and Spectral Property Study of Fmoc-Protected Porphyrin-Amino Acid Adducts
LIU Xiao-xing1,2,ZHEN Ya-zhi1,2,XING Xiao-li1,2,TAO Min-li1,2
(1.DepartmentofChemistry,SchoolofSciences,TianjinUniversity,Tianjin300072,China;
2.CollaborativeInnovationCenterofChemicalScienceandEngineering(Tianjin),
Tianjin300072,China)
Abstract:To obtain the porphyrins similar to the natural ones in structure and properties,novel porphyrin-amino acid adduct protected by Fmoc were synthesized and their spectral properties were investigated.Results showed that,two amino acid units porphyrin adducts(with glycine,valine) and one amino acid unit prophyrine adduct(with L-tyrosin) were obtained when Fmoc-amino acid reacted with hydroxy porphyrins by ester bond.Porphyrin adducts containing one amino acid unit were formed when Fmoc-amino acid was condensed with aminoporphyrins by amide bond.The introduction of different Fmoc-amino acids had litttle influence on spectral properties of porphyrins.
Keywords:Fmoc-protected;porphyrin-amino acid adduct;tautomerism;spectral property
中图分类号:O 626.13
文献标识码:A
文章编号:1672-5425(2015)05-0020-06
doi:10.3969/j.issn.1672-5425.2015.05.005
作者简介:刘晓星(1990-),女,河北衡水人,硕士研究生,研究方向:卟啉衍生物的合成与研究,E-mail:lxx@tju.edu.cn;通讯作者:陶敏莉,副研究员,E-mail:mltao@tju.edu.cn。
收稿日期:2015-02-06
基金项目:国家自然科学基金资助项目(21306133),天津市应用基础与前沿技术研究计划项目(14JCYBJC22600)
