血小板特异性抗体联合检测在免疫性血小板减少症鉴别诊断中的价值*
2016-01-05李芳,朴文花,李芹等
·论著·
血小板特异性抗体联合检测在免疫性血小板减少症鉴别诊断中的价值*
李芳,朴文花△,李芹,白洁,杜宗孝
(宁夏回族自治区人民医院临床医学检验诊断中心,宁夏银川 750002)
摘要:目的通过检测血小板减少症患者外周血B淋巴细胞血小板膜糖蛋白特异性抗体的变化,探讨其表达水平变化对血小板减少症鉴别诊断的临床意义。方法应用流式微球技术检测血小板减少症患者及健康对照者外周血GPⅡb/Ⅲa、GPⅠb/ⅠX的表达水平。结果原发ITP与继发ITP患者血小板特异性抗体GPⅡb/Ⅲa、GPⅠb/ⅠX与对照组比较差异有统计学意义(P<0.05);血小板特异性抗体GPⅠb/ⅠX诊断原发ITP的敏感度43%,特异度89%;GPⅡb/Ⅲa诊断原发ITP的敏感度86%,特异度83%。两者联合诊断敏感度90%,特异度83%。结论联合检测两种血小板抗体,提高原发ITP和SLE的诊断阳性率;GPⅠb/ⅠX在ITP中的诊断优势不如GPⅡb/Ⅲa。
关键词:免疫性血小板减少症;血小板特异性抗体;流式微球技术
原发免疫性血小板减少症(ITP),既往称“特发性血小板减少性紫癜”,是一组最为常见的以皮肤黏膜出血为主要特征的血小板减少性疾病,在临床上属于一种自身免疫性综合征。儿童发病率为1.9~6.4/10万;成年人发病率5~10/10万。临床上为一种综合患者病史、临床表现、实验室检查的排外性诊断。目前,国内外针对血小板特异性抗体的检测主要方法有ELISA及血小板抗原单克隆抗体固相化检测(MAIPA)[1]。本实验应用流式微球技术(CBA),联合检测原发和继发ITP患者血小板膜表面糖蛋白特异性抗体GPⅡb/Ⅲa、GPⅠb/ⅠX,提高ITP诊断的敏感度和特异度,为ITP的早期诊断、鉴别诊断及疗效评价提供可靠的实验室资料。
1资料与方法
1.1一般资料筛选2010年1月至2013年2月在宁夏回族自治区人民医院血液科住院治疗的原发ITP114例,其中男性46例,女性68例,中位年龄(49.6±17.1)岁,原发性ITP患者诊断均符合国内标准[2]。系统性红斑狼疮(SLE)25例,其中男性3例,女性22例,中位年龄(43.6±14.6)岁;肝硬化44例,男性26例,女性18例,中位年龄(63.3±9.1)岁;类风湿性关节炎(RA)39例,男性16例,女性23例,中位年龄(37.6±10.6)岁。对照组为血小板减少的急、慢性白血病共32例,其中男性16例,女性16例,中位年龄58岁,平均(44.1±12.2)岁;急、慢性白血病诊断均符合国内标准[2]。病例组包括原发ITP、SLE、RA和肝硬化。
1.2仪器与试剂FACS AriaII Cell Sorter流式细胞仪(美国BD公司);CD41(GPⅡb/Ⅲa)单抗、CD42(GPⅠb/ⅠX)单抗、羊抗鼠抗体均为BD医疗器械(上海)有限责任公司提供;亲和纯化的碱性磷酸酶标记的羊抗人IgG(Fc)及蛋白酶抑制剂Sigma公司产品。
1.3方法
1.3.1样品处理采集EDTA抗凝的外周静脉血,混匀后800 r/min离心10 min,吸取上层血浆至EP管中,2 500 r/min离心10 min,吸取血小板裂解液各50 μL至4个EP管中,然后分别加入用4种单抗包被的微球各50 μL(反应体积100 μL),室温振荡孵育2 h,洗涤液洗涤3次,加入FITC标记的羊抗人IgG抗体。室温震荡30 min,洗涤后加500 μL 0.01 mol/L PBS缓冲液重悬微球。
1.3.2样品检测于第1、2、5、10、20、30、40天应用FITC标记的羊抗鼠IgG多克隆抗体检测包被聚苯乙烯微球的荧光强度,以测试包被微球稳定性。FSC/SSC散点图圈出检测微球门,获取2 000~3 000个微球,记录FL-2直方图中检测微球的平均荧光强度(MFI)。检测样本的同时,将3个健康人的血样作为对照组,计算对照组MFI的均值,将样本的MFI与之比较并计算比率。
1.4统计学处理采用SPSS13.0统计软件分析结果,多个样本的两两比较采用秩和检验,率的比较采用χ2检验,P<0.05为差异有统计学意义。
2结果
2.1血小板抗体GPⅠb/Ⅸ与GPⅡb/Ⅲa在病例组与对照组荧光强度表达病例组与对照组血浆中血小板特异性抗体GPⅡb/Ⅲa、GPⅠb/Ⅸ表达差异有统计学意义(P<0.05)。
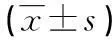
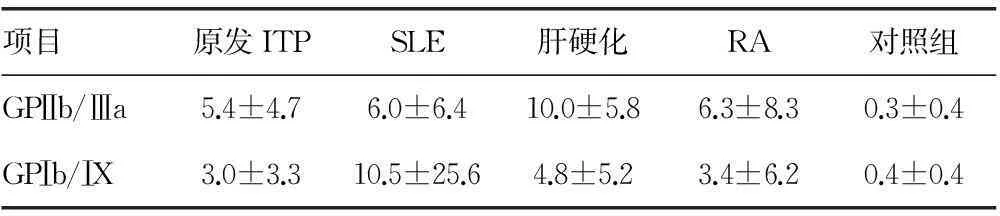
项目原发ITPSLE肝硬化RA对照组GPⅡb/Ⅲa5.4±4.76.0±6.410.0±5.86.3±8.30.3±0.4GPⅠb/ⅠX3.0±3.310.5±25.64.8±5.23.4±6.20.4±0.4
2.2血小板抗体GPⅡb/Ⅲa与 GPⅠb/ⅠX在免疫相关血小板减少症中的阳性率测定所有患者血清中GPⅡb/Ⅲa 与GPⅠb/ⅠX抗体,见表2,GPⅠb/ⅠX抗体总阳性率较GPⅡb/Ⅲa抗体低(P<0.05)。在16例GPⅡb/Ⅲa抗体阴性的原发ITP中有5例GPⅠb/ⅠX抗体阳性;5例GPⅡb/Ⅲa抗体阴性的SLE中有3例GPⅠb/ⅠX抗体阳性。将两种抗体联合检测,原发ITP和SLE的诊断阳性率明显提高。
表2两种血小板抗体GPⅡb/Ⅲa与 GPⅠb/ⅠX在血小板减少症中的阳性率(%)
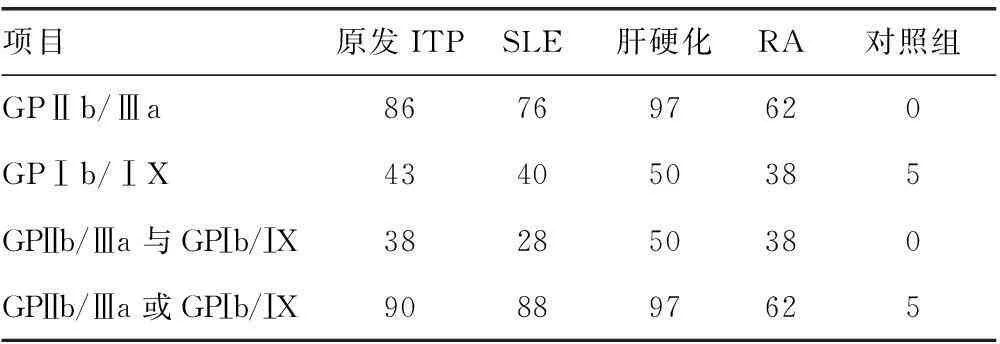
项目原发ITPSLE肝硬化RA对照组GPⅡb/Ⅲa867697620GPⅠb/ⅠX434050385GPⅡb/Ⅲa与GPⅠb/ⅠX382850380GPⅡb/Ⅲa或GPⅠb/ⅠX908897625
2.3血小板抗体联合检测对原发ITP的诊断价值GPⅡb/Ⅲa与GPⅠb/ⅠX血小板抗体检测原发ITP的敏感度、特异度,阳性预测值,见表3。联合两种血小板抗体检测原发ITP的敏感度、阴性预测值提高、特异度及阳性预测值基本未变。
表3两种血小板抗体诊断原发ITP敏感度、特异度、阳性预测值(%)
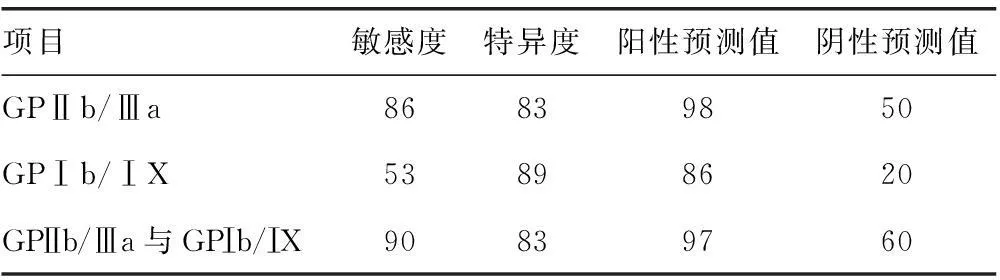
项目敏感度特异度阳性预测值阴性预测值GPⅡb/Ⅲa86839850GPⅠb/ⅠX53898620GPⅡb/Ⅲa与GPⅠb/ⅠX90839760
3讨论
血小板减少症是临床上最为常见的出血性疾病、是临床常见的症状。引起血小板减少的原因较多,从病因学上主要分为累及“细胞” 和“抗体”所导致的血小板生成减少(障碍)和外周血小板破坏增多。“抗血小板自身抗体”导致的“血小板破坏增多”是ITP的主要病因[3-4],其次是抗复合体GPⅠb/ⅠX以及其他血小板糖蛋白。2007年,国际ITP工作组将既往命名的“特发性血小板减少性紫癜”更名为“免疫性血小板减少症”,英文缩写不变,按病因分为“原发ITP”和“继发ITP”[5]。2009年国内中华医学会血液分会在《中华血液学杂志》上发表“成人原发免疫性血小板减少症诊治的中国专家共识(第1版)”[2],正式将本病更名为“原发免疫性血小板减少症”。血小板减少可见于SLE、肝硬化等自身免疫性疾病。血小板破坏增多,既可由免疫性因素引起,也可由非免疫性因素(聚集消耗)引起。采用流式细胞技术检测血小板减少症患者外周血血浆中的血小板特异性抗体。流式微球技术是基于流式细胞术而发展的新技术,以聚苯乙烯微球为反应界面,利用特异性抗体包被后即可俘获一些小分子物质,再通过放大作用进行检测[6-7]。
本研究表明,GPⅠb/ⅠX抗体在原发ITP及继发ITP中均可检测到,ITP患者大部分血小板特异性自身抗体的靶抗原是GPⅡb/Ⅲa,血小板抗体GPⅠb/ⅠX在ITP诊断中敏感度较GPⅡb/Ⅲa低。分析血小板抗体GPⅠb/ⅠX检出率低可能原因是在多数ITP患者中,均是血小板抗体GPⅠb/ⅠX和GPⅡb/Ⅲa两种抗体联合存在的,只有很少部分患者是单独存在GPⅠb/ⅠX抗体。联合这两种血小板抗体提高了ITP诊断敏感度及特异度。一部分SLE患者GPⅡb/Ⅲa阴性,联合这两种血小板抗体对于SLE的诊断有价值。
综上所述,血小板特异性抗体检测具有较高的特异度,将两种抗体联合检测,原发ITP和SLE的诊断阳性率明显提高,同时在血小板减少症(ITP和非ITP)的鉴别诊断中具有一定价值[8-9]。
参考文献
[1]冯建军,杨林花.血小板特异性抗体检测对免疫性与非免疫性血小板减少症的鉴别诊断价值[J].中国药物与临床,2013,13(1):9-11.
[2]中华医学会血液分会血栓与止血组.成人原发免疫性血小板减少症诊治的中国专家共识(修订版)[J].中华血液学杂志,2011,32(3):214-216.
[3]张之南.血液病诊断和疗效标准[M].3版,北京:科学出版社,2007:131-151.
[4]秦平,侯明.2012版成人原发免疫性血小板减少症诊治的中国专家共识解读[J].临床血液学杂志,2013,26(3):152-153.
[5]Rodeghiero F,Stasi R,Gernsheimer T,et al.Standardization of terminology,definitions and outcome criteria in immune thrombocytopenic purpura of adults and children:report from an international working group[J].Blood,2009,113(1):2386-2393.
[6]Morgan E,Vario R,Sepulveda H,et al.Cytometric bead array:a multiplexed assay platform with applications in various areas of biology[J].Clin Immunol,2004,110(3):252-266.
[7]李锦霞,杨炳华,何杨,等.流式微球技术检测血小板特异性抗体[J].临床检验杂志,2010,28(2):808.
[8]Nomura S,Yanabu M,Soga T,et al.Analysis of idiopathic thrombocytopenic purpura patients with antiglycoprotein IIb/IIIa or Ib autoantibodies[J].Acta Haematol,1991,86(1):25-30.
[9]Go RS,Johnston KL,Bruden KC.The association between platelet autoantibody specificity and response to intravenous immunoglobulin G in the treatment of patients with immune thrombocytopenia[J].Haematologica,2007,92(2):283-284.
The differential diagnosis value of detection of platelet specific autoantibody on idiopathic thrombocytopenic*
LiFang,PiaoWenhua△,LiQin,BaiJie,DuZongxiao
(ClinicalMedicalTestDiagnosisCenter,NingxiaPeople′sHospital,Yinchuan,Ningxia750002,China)
Abstract:ObjectiveTo detect the changes and clinical significance of the expression of anti-GPⅡb/Ⅲa and anti-GPⅠb/ⅠX on anti-secreting B cells in patient with thrombocytopenia.MethodsExpression of anti-GPⅡb/Ⅲa and anti-GPⅠb/ⅠX specific autoantibodies in thrombocytopenia were tested with(CBA).ResultsThere were significantly more circulating anti-GPⅠb/ⅠX and anti-GPⅡb/Ⅲa antibody-producing B cells in primary ITP(P<0.05) for all comparisons.For diagnosing primary ITP,the anti-GPⅠb/ⅠX had 43% sensitivity and 89% specificity,whereas the anti-GPⅡb/Ⅲa had 86% sensitivity and 83% specificity.When two tests were combined,the sensitivity improved to 90% without a reduction in specificity.ConclusionThe assay for detecting anti-GPⅠb/ⅠX is useful for identifying patients with ITP,but its utility for diagnosing ITP is inferior to the anti-GPⅡb/Ⅲa assay.
Key words:immune thrombocytopenia;platelet specific autoantibody;cytometric bead assay
(收稿日期:2015-05-05)
DOI:10.3969/j.issn.1673-4130.2015.15.004
文献标识码:A
文章编号:1673-4130(2015)15-2135-02
*基金项目:宁夏自然科学基金自助项目(NZ11167)。
作者简介:李芳,女,副主任医师,主要从事血液病细胞形态学、病理学及流式细胞学诊断研究。△通讯作者,E-mail:wenhuapiao@163.com。
