氢氧化镁水热提纯的实验研究*
2015-12-31李金平曹长青江津河
李金平,曹长青,江津河
(1.青岛科技大学,山东 青岛 266042;2.潍坊学院,山东 潍坊 261061)
氢氧化镁作为一种重要的化工原料,在塑料、橡胶、制药、日用化工、化工材料和中间体等行业中有着广泛的应用。我国氢氧化镁的工业技术及生产起步较晚,同时生产的氢氧化镁绝大部分为质次价低的产品,纯度一般低于96%,且粒度分布很宽,致使应用面很窄。但国内外对高纯微细氢氧化镁的需求却日益增大,其主要用途是作为各种高档复合材料的阻燃成分。限于我国氢氧化镁工业生产技术的现状,并不能满足对高纯氢氧化镁的需求,大规模的改造升级生产设备及生产技术来满足社会需求在短时间内是不现实的。本文以工业氢氧化镁粗品为原料,对氢氧化镁进行水热提纯来制得高纯氢氧化镁。
金永成等[1-4]对溶液组成对氢氧化镁水热改性的影响的研究表明,采用H2O、MgCl2、NH4Cl和NH4OH 等虽可在一定程度上改善氢氧化镁的形貌和团聚状态,但效果不甚明显;而NaOH 水热溶液则可改变氢氧化镁晶体的生长方向,使生成的氢氧化镁晶体结构更稳定,由此制得高分散的氢氧化镁产物。
1 实验部分
1.1 试剂与仪器
主要试剂与仪器:PCF03-10高压反应釜(烟台科立化工设备有限公司);氢氧化钠(分析纯,天津市永大化工有限公司);氢氧化镁(潍坊恒基化工有限公司);GZX-9076MBE 电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司)。
1.2 实验内容
称取一定量的Mg(OH)2粉末与一定浓度的NaOH 溶液混合均匀后加入高压反应釜中,开启高压反应釜电源开关,调节一定的搅拌速率和升温速率,恒温一定时间后高压反应釜中的溶液自然冷却至室温,抽滤,用热蒸馏(约80 ℃)洗涤抽滤2次,得滤饼。将滤饼放入干燥箱中105 ℃下恒温干燥至恒重,充分碾磨,得Mg(OH)2产品,并对其进行滴定检测和表征。
2 结果和讨论
2.1 NaOH 溶液浓度对粗氢氧化镁提纯的影响
在反应时间为4h,搅拌速度为160r/min,反应温度为180 ℃,氢氧化镁的质量为8g,填充度为50%的条件下,控制单一变量NaOH 浓度由1mol/L 逐渐增至5mol/L。由图1可知,随着NaOH 浓度的增大,氢氧化镁纯度先增大再减小,其中,在浓度区间1mol/L-2mol/L中,氢氧化镁纯度提高比较显著,这是因为在该区间,NaOH 浓度的增加使溶液体系中OH-浓度增加,OH-浓度的增加有利于氢氧化镁的水热反应;在浓度区间2mol/L-4mol/L 中,氢氧化镁的纯度变化不大,呈缓慢增长趋势,说明在该区间,OH-浓度与氢氧化镁浓度达到了一定的平衡;在浓度区间4mol/L-5mol/L 中,氢氧化镁的纯度呈下降趋势,说明在该浓度区间OH-浓度的增大不利于氢氧化镁的水热反应。当NaOH 为4mol/L 时,氢氧化镁纯度达到最大值。

图1 NaOH 对氢氧化镁纯度的影响

图2 温度对氢氧化镁纯度的影响
2.2 温度对粗氢氧化镁提纯的影响
在反应时间为4h,搅拌速度为160r/min,NaOH 浓度为4mol/L,氢氧化镁的质量为8g,填充度为50%的条件下,控制单一变量反应温度由160 ℃变化到200 ℃。由图2可知,氢氧化镁的纯度温度区间160 ℃-180℃逐渐增大,在温度区间180℃-200℃逐渐减小,并在180℃时达到最大值。王艳[5-9]等的研究成果表明,NaOH 水溶液在高压反应釜的填充度为10%-80%时,反应釜内压强沿气液平衡线变化,反应釜内的压强随反应温度的升高而升高,在温度区间160 ℃-180 ℃,温度的升高有利于水热反应向正向移动,并在180 ℃左右达到平衡;在温度区间180 ℃-200 ℃,温度的升高有利于水热反应的逆向移动,因此,氢氧化镁的纯度温度区间160 ℃-180 ℃逐渐增大,在温度区间180 ℃-200 ℃逐渐减小,并在180℃时达到最大值。
2.3 粗氢氧化镁的质量对粗氢氧化镁提纯的影响
在反应时间为4h,搅拌速度为160r/min,NaOH 浓度为4mol/L,反应温度为180℃,填充度为50%的条件下,控制单一变量氢氧化镁的质量由8g变化到24g,由图3可知,氢氧化镁的纯度随着氢氧化镁质量的增加而逐渐减小。在其他变量一定的条件下,随着氢氧化镁质量的增加,反应体系中Mg2+浓度增加,OH-相对浓度逐渐减小,OH-相对浓度的减小不利于生长基元Mg(OH)形成,减弱了Mg(OH)2晶体的水热生长过程,结晶质点排斥外来杂质的能降低,故随着氢氧化镁质量的增加,水热反应中氢氧化镁的纯度逐渐降低。
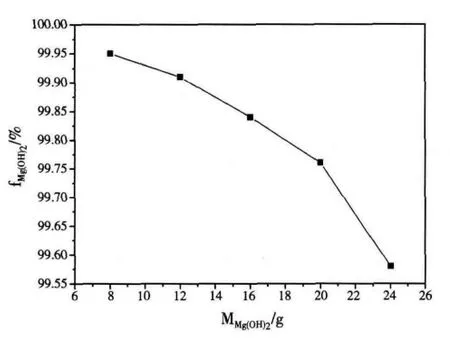
图3 氢氧化镁质量对氢氧化镁纯度的影响
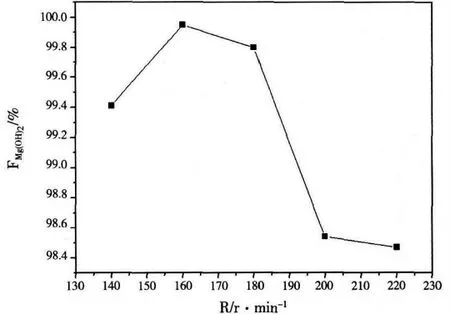
图5 转速对氢氧化镁提纯的影响
2.4 反应时间对粗氢氧化镁提纯的影响
在搅拌速度为160r/min,NaOH 浓度为4 mol/L,氢氧化镁的质量为8g,反应温度为180℃,填充度为50%的条件下,控制单一变量反应时间由1h变化到6h。由图4可知,氢氧化镁的纯度随着反应时间的增大先增大再减小。在水热环境中,氢氧化镁经过溶解过程与长大过程,经过水热反应过程晶体粒子长大,形成新的氢氧化镁晶体。随着反应时间的延长,体系中杂质的增多,氢氧化镁晶体可能以某种杂质为晶核生长,导致了氢氧化镁纯度的降低。
2.5 转速对粗氢氧化镁提纯的影响
在反应时间为4h,NaOH 浓度为4mol/L,氢氧化镁的质量为8g,反应温度为180 ℃,填充度为50%的条件下,控制单一变量搅拌速度由140r/min变化到220r/min。由图5可知,随着转速的增大,氢氧化镁的纯度先增大再减小,在160r/min时,氢氧化镁纯度达到最大值。
3 结论
(1)研究结果表明,通过水热反应能有效提纯粗工业氢氧化镁的纯度,温度、转速、NaOH 浓度、氢氧化镁质量和反应时间是影响水热反应的重要因素。在填充度为50%的条件下,温度为180 ℃,NaOH 浓度为4mol/L,氢氧化镁质量为8g,反应时间为4h,转速为160r/min时,水热提纯氢氧化镁的条件最优。
(2)本实验主要探究了水热提纯对粗氢氧化镁纯度的影响,对提纯后氢氧化镁晶体晶粒的研究还有待进一步的探究。另外,转速、填充度对氢氧化镁水热提纯的影响也有需进一步探讨。
[1]金永成,向兰,金涌.溶液组成对氢氧化镁水热改性的影响[J].海湖盐与化工,2002,31(1):1-4.
[2]王伟.超细片状氢氧化镁的制备及阻燃聚丙烯的应用研究[D].武汉:武汉工程大学,2013.
[3]向兰,金永成,金涌.氢氧化钠溶液中氢氧化镁的水热改性[J].过程工程学报,2003,3(2):116-120.
[4]闫修川,李召好,马培华,等.水热法提纯制备氢氧化镁的研究[J].盐湖研究,2006,14(1):36-38,54.
[5]王艳,刘畅,柏扬,等.水热反应釜中高温高压离子水溶液热力学性质[J].化工学报,2006,57(8):1856-18864.
[6]孙雨,高恩双,潘旭杰,等.水热法合成高分散易过滤高阻燃氢氧化镁[J].无机盐工业,2013,45(4):29-30,37.
[7]闫修川,马培华,李法强,等.水热法制备阻燃剂氢氧化镁的工艺研究[J].海湖盐与化工,2005,34(6):24-26.
[8]冯玉铖,马海宾,赵洪江.水热法可控合成纳米氢氧化镁[J].神华科技,2013,11(6):64-67,72.
[9]唐卫平,苏明阳.非离子表面活性剂存在下纳米氢氧化镁的水热处理[J].化学工程师,2014,(11):68-71.
