儿童胸壁横纹肌肉瘤的CT诊断
2015-12-30CTDiagnosisofChestWallRhabdomyosarcomainChildren
CT Diagnosis of Chest Wall Rhabdomyosarcoma in Children
邓立维1,2DENG Liwei吴慧莹3WU Huiying徐文彪3XU Wenbiao陈希文3CHEN Xiwen黄杰灵2HUANG Jieling成官迅4CHENG Guanxun
论著
儿童胸壁横纹肌肉瘤的CT诊断
CT Diagnosis of Chest Wall Rhabdomyosarcoma in Children
邓立维1,2DENG Liwei
吴慧莹3WU Huiying
徐文彪3XU Wenbiao
陈希文3CHEN Xiwen
黄杰灵2HUANG Jieling
成官迅4CHENG Guanxun
作者单位1.南方医科大学 广东广州 510515 2. 南方医科大学第五附属医院影像科 广东广州 510900 3. 广州市妇女儿童医疗中心放射科 广东广州 510120 4. 南方医科大学南方医院影像诊断中心广东广州 510515
目的原发于胸壁的横纹肌肉瘤(RMS)少见,关于儿童胸壁RMS影像学表现的研究较少,本文分析了儿童胸壁RMS的CT影像学表现,以提高儿童胸壁RMS的诊断准确率。资料与方法回顾性分析经手术病理证实为胸壁RMS的5例患儿的CT影像资料,总结患儿RMS的CT影像特点。结果5例患儿中,病灶位于前胸壁1例,后胸壁2例,侧胸壁(腋下)2例。病灶形态呈类圆形或梭形,部分肿块呈浅分叶。平扫病灶密度不均匀、可见斑片状低密度坏死区2例,密度较均匀3例;5例病灶均未见钙化及脂肪组织。肿块侵犯邻近椎管1例;肿块突入胸腔压迫肺组织1例,压迫心脏及肝脏1例;肿块包绕血管生长2例。5例病灶均紧邻肋骨、肱骨、肩胛骨及脊柱骨等,有骨质破坏1例。增强扫描5例病灶呈不均匀轻-中强化,以周边强化明显,病灶内可见较多增粗、扭曲的供血动脉影,其内坏死区不强化。2例出现肺转移灶,1例出现胸腔积液及腹腔积液,1例出现淋巴结转移。结论儿童胸壁RMS的CT表现为胸壁较大或巨大软组织肿物,密度均匀或欠均匀,内无钙化及脂肪组织,部分有坏死区,邻近组织受推压甚至侵犯,可出现淋巴结及远处转移;增强扫描后病灶呈不均匀轻-中度强化,以周边强化明显。结合临床表现,综合分析增强CT影像表现可提高诊断准确率。
胸部肿瘤;横纹肌肉瘤;胸壁;体层摄影术,X线计算机;病理学,外科;儿童
横纹肌肉瘤(rhabdomyosarcoma,RMS)是一种好发于儿童期及青春期的间充质恶性肿瘤,其发病率占儿童恶性肿瘤的5%、软组织肿瘤的50%,居儿童颅外实体肿瘤第3位,仅次于神经母细胞瘤和肾母细胞瘤[1]。RMS好发于头颈部、泌尿生殖道及四肢[2],原发于胸壁的RMS极少见,相关影像表现的研究报道较少[3-5]。本文探讨5例胸壁RMS患儿的CT影像特点,以提高对RMS的认识和诊断水平。
1 资料与方法
1.1 研究对象 收集2010年4月—2014年4月南方医院和广州市妇女儿童医疗中心经手术病理证实为RMS 的5例患儿,其中男2例,女3例;年龄7个月~6岁,中位年龄1岁6个月;病程1个月~1年1个月;5例均以发现胸壁肿物就诊,肿块呈逐渐增大,无明显压痛,肿块质地硬、活动度差。5例患儿临床表现见表1。
1.2 仪器及方法 采用Toshiba Aquilion 64层CT扫描仪行胸部横断面平扫及增强扫描,摄片分别取软组织窗、肺窗和骨窗。扫描范围自肺尖到肋膈角。患儿扫描前均口服10%水合氯醛0.5 ml/kg。扫描参数:管电压120 kV,管电流20~25 mAs,视野(FOV)24 cm× 24 cm,层厚0.5 mm,连续扫描。增强扫描采用对比剂优维显,经肘静脉注射对比剂2~3 ml/kg,注射速度1.0~1.5 ml/s;扫描时间:动脉期20~25 s,延迟期55~60 s。
1.3 图像分析 所有图像由1名主治医师和1名主任医师分析,意见不一致时协商统一。观察病灶的发病部位、大小、密度、增强扫描的强化特点、病灶与周围组织的分界、病灶对邻近骨质的破坏情况、有无远处转移及胸腔、腹腔积液。
1.4 手术与病理学检查 病理获取途径:2例行胸壁肿瘤切除术,3例行穿刺活检术治疗。所有病理标本均为5 μm切片,HE染色,经光镜、免疫组化切片明确诊断。
2 结果
2.1 手术与病理结果 术中肿瘤最大径为6~10 cm,见肿瘤切面呈“鱼肉状”,质地不均。病理镜下见大量不成熟间叶细胞和梭形肿瘤细胞,肿瘤细胞排列呈腺泡状;胞质红染或红色胞,细胞疏密不均;核大,可见明显核仁,核分裂象多见;部分出现围血管现象。免疫组化波形蛋白、结蛋白、肌浆蛋白、Actin、CD56、CD99均阳性。5例均为腺泡型横纹肌肉瘤(图2D)。
2.2 CT表现 ①发病部位:病灶位于前胸壁1例,后胸壁2例,侧胸壁(腋下)2例;病灶均见部分或大部分边缘贴近皮下脂肪层;位于侧胸壁者可见部分瘤体位于深部肌肉间隙内。②大小:5例病灶大小约为4.8 cm ×5.7 cm×6.4 cm~9.7 cm×7.8 cm×4.8 cm;病灶形态呈类圆形或梭形,部分肿块可浅分叶。③密度:平扫瘤体实性成分密度与肌肉组织密度相仿或稍低,CT值为38~47 HU,密度不均匀、可见斑片状低密度坏死区2例(图1A),密度较均匀3例(图2A);5例瘤体内均未见钙化及脂肪组织。④病灶与周围组织分界:肿块起源于胸壁软组织,与周围肌肉组织分界不清;肿块侵犯邻近椎管1例(图2A);肿块突入胸腔压迫肺组织1例(图2B),压迫心脏及肝脏1例;肿块包绕血管生长2例。⑤骨质破坏:5例均紧邻肋骨、肱骨、肩胛骨及脊柱骨等,有骨质破坏1例,且骨质破坏范围较轻,呈溶骨性骨质破坏,未见瘤骨形成及骨膜反应(图2C、图3)。⑥增强扫描:5例病灶呈不均匀轻-中强化,以周边强化明显,病灶内可见较多增粗、扭曲的供血动脉影,其内坏死区不强化(图1B)。⑦远处转移及胸腔、腹腔积液:3例出现远处转移,其中2例出现肺转移灶(图4A),1例出现胸腔积液及腹腔积液(图4B、C);另1例出现淋巴结转移(图5)。见表1。
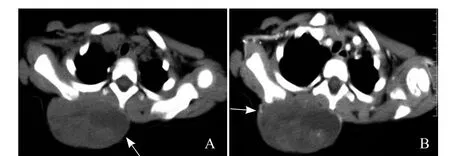
图1 女,1岁7个月,腺泡状横纹肌肉瘤。CT平扫示病灶呈梭形,体积较大,病灶内密度不均匀,可见片状低密度坏死区(箭,A);增强扫描示病灶呈轻-中度强化,周边强化较明显(箭),瘤体中部低密度坏死区不强化,邻近右侧肩胛骨及胸椎棘突未见明确骨质破坏(B)
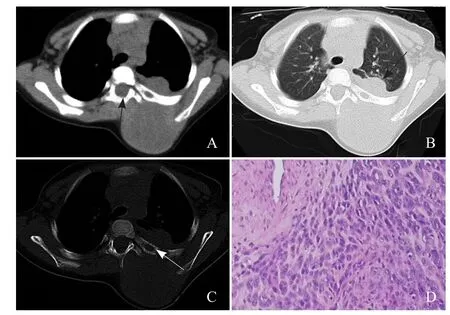
图2 男,1岁6个月,腺泡状横纹肌肉瘤。病灶密度较均匀,可见病灶侵犯椎管,形成椎管内软组织肿块(箭,A);肺窗显示病灶突入胸腔,突向肺内,侵犯肺组织(箭,B);病灶对其紧邻的肋骨包绕,但骨质破坏较轻,呈局部骨质的溶骨性破坏,表现为局部骨质缺损(箭),左侧肩胛骨未见明确骨质破坏(C);病理镜下可见大量不成熟间叶细胞和梭形肿瘤细胞,细胞疏密不均,有围血管现象,部分区域梭形细胞束状或编织状排列,胞质红染、丰富,偶见横纹,核圆形或卵圆形,可见明显核仁,核分裂象多见(HE,×100,D )
2.3 治疗与预后 5例患儿中,3例发现远处转移,仅给予非手术保守治疗,1年内死亡; 2例经手术切除肿瘤及相关治疗后,截至末次随访日期,暂未见转移或复发(存活)。见表1。
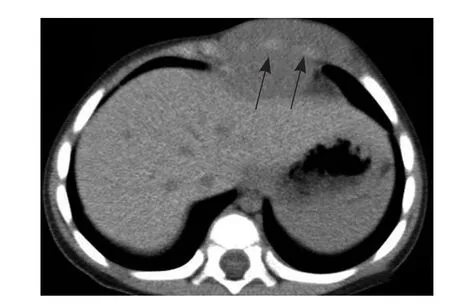
图3 男,1岁3个月,腺泡状横纹肌肉瘤。CT平扫显示瘤体紧密包绕肋软骨生长,未见有明确的骨质破坏(箭),手术及病理证实肋软骨周围见瘤体细胞浸润生长,肋软骨未见破坏

图4 女,7个月,腺泡状横纹肌肉瘤。肺窗显示肺内出现近胸膜下的结节影(箭,A);增强扫描示病灶呈环形强化(箭),右侧胸腔有少量积液(箭头,B);可见腹腔积液(箭,C)
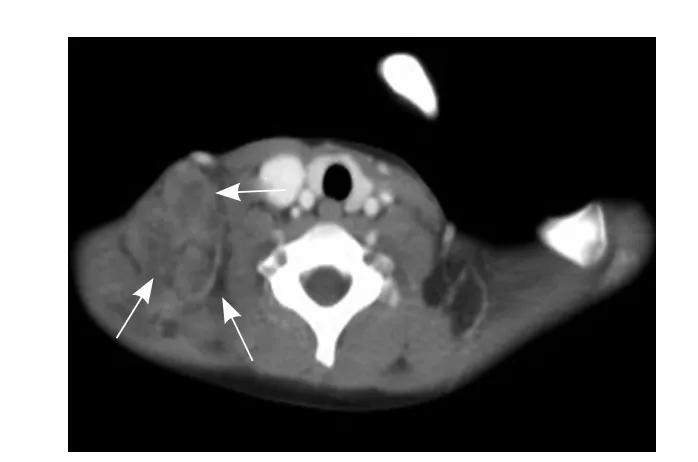
图5 女,6岁,腺泡状横纹肌肉瘤。右侧颈部及锁骨上窝区多发淋巴结转移,增强扫描呈环形强化(箭)
3 讨论
3.1 RMS的临床及病理表现 RMS是一种好发于儿童期及青春期的小圆细胞恶性肿瘤。在新IRS-IV分类方案中,分为预后好(葡萄状型和梭形细胞型)、中(胚胎型)、差(腺泡型和未分化型)3类[6]。Dasgupta等[7]认为不同病理分型的横纹肌肉瘤与发病年龄及好发部位有一定的关系。腺泡型RMS更好发于青少年及年龄较大的儿童,好发部位为四肢和躯干。本组5例胸壁RMS病理结果均为腺泡型RMS,且患儿年龄均较小,与文献[3-5]报道结果相符,提示胸壁RMS的病理类型多为腺泡型RMS,且患儿发病年龄均较小。
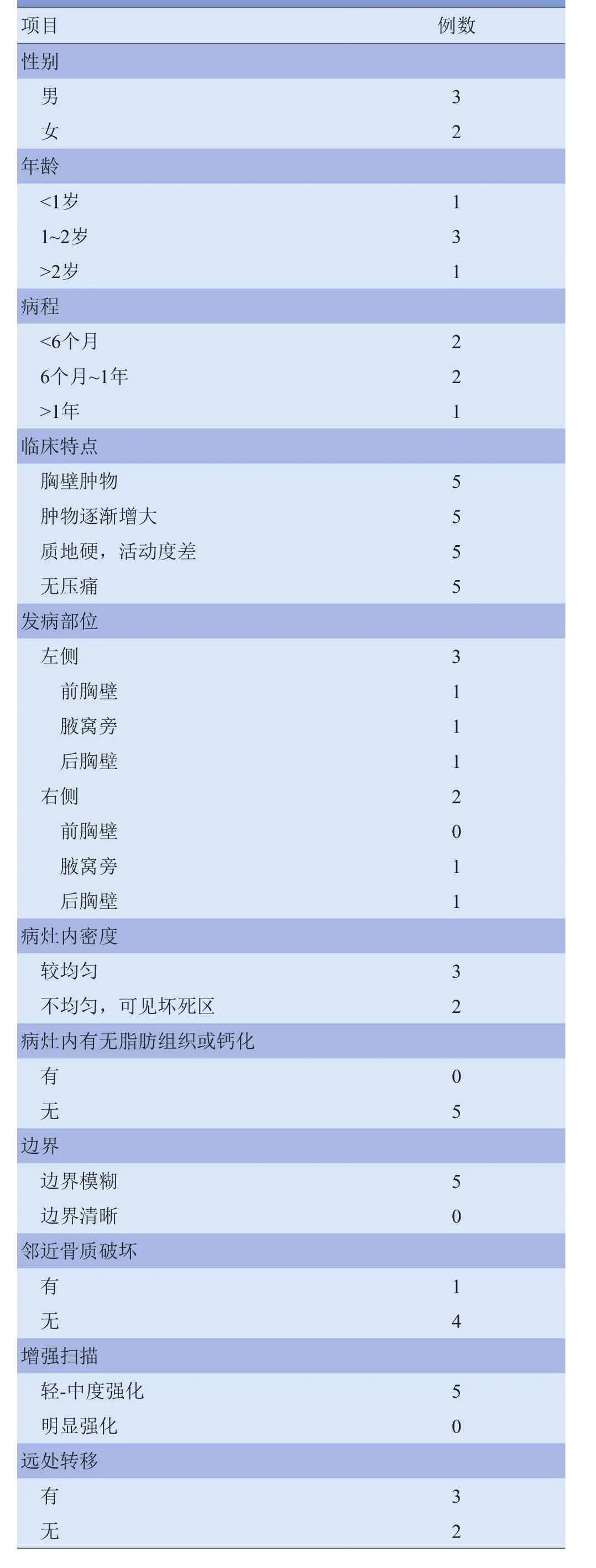
表1 5例胸壁横纹肌肉瘤患儿的临床及CT表现(例)
儿童胸壁RMS早期缺乏明显的临床症状,多为家长或患儿无意中发现胸壁肿物、持续观察肿物逐渐增大而就诊[8]。本组5例均以发现胸壁肿物就诊,肿块逐渐增大,无明显压痛、活动度差,与以上文献报道相符。RMS病灶可发生于腋下、前胸壁、后胸壁,发病部位无明显特异性。同时,病灶可发生于浅肌层或深部肌层,而发生于深部肌层的胸壁RMS更容易发生邻近脏器的侵犯或骨质破坏。本组5例中3例死亡,2例经过手术切除肿瘤及相关治疗后暂未见转移或复发。3例死亡病例中,1例瘤体侵犯邻近椎管、肺组织及有邻近骨质破坏,1例出现区域淋巴结转移,2例出现肺转移,提示胸壁RMS患儿在未出现淋巴结或远处转移的情况下,经过规范、系统的治疗后其预后情况可有明显改善。
3.2 RMS的CT表现 儿童胸壁RMS的影像学表现虽然缺乏明确的特征性,但以下CT表现仍有助于临床作出正确诊断:(1)肿瘤体积相对较大,均表现为源于胸壁外缘的较大或巨大软组织包块,可累及胸壁内缘,本组5例病灶最大径均>5 cm。(2)病灶呈类圆形或椭圆形,边缘可见浅分叶,对周围组织呈浸润性生长,与周围肌肉组织分界均不清楚,其中2例可见累及胸壁内缘,CT难以准确定位病灶起源的具体肌肉组织,本组5例均有此表现。(3)平扫时肿瘤为较均匀等(或)稍低密度或等低较混杂密度,多数瘤体内未见钙化及脂肪组织。本组5例病灶内均未见明显钙化及脂肪组织,与既往文献[1,3-12]报道结果一致。(4)增强表现:增强扫描后病灶均呈不均匀轻-中度强化,较多表现为以周边强化明显,病灶内可见肿瘤血管,囊变坏死区不强化;胸壁RMS的强化表现与其他恶性软组织肿瘤的强化表现相比并无明显特异性。(5)根据对本组病例的观察分析并结合文献报道[3-5],儿童胸壁RMS常侵犯邻近组织,但对邻近骨质结构的侵犯、破坏并不常见,RMS对骨质的破坏更多见于瘤体起源于较深层的肌肉组织时,对相邻骨质结构形成紧密包绕的情况下,才对相邻骨质产生侵犯和破坏,且骨质破坏的程度较轻,呈局部骨质溶骨性破坏为主,RMS这种较轻程度的骨质破坏表现可与其他有着明显骨质破坏为特征的肿瘤相鉴别。(6)转移及合并症:①邵剑波[1]认为儿童胸壁RMS常伴有胸膜增厚、积液,但本组仅1例发现胸腔积液,与文献报道不符,可能与本研究样本数少有关。2例肿块均发生于胸壁外且累及胸壁内,而另外3例均仅局限发生于胸壁外,提示儿童胸壁RMS累及胸壁内、外缘合并胸腔积液的可能性大。②远处转移 RMS中出现肺转移较多见,本组3例远处转移患儿中,肺转移2例,淋巴结转移1例。肺转移灶表现为呈散在分布的结节或团块影,大小不一,较大者边界欠清,增强扫描可见中度强化,同其他恶性肿瘤肺内转移表现相似,并无明显特征。本组1例出现右侧颈部及锁骨上窝区淋巴结转移的患儿表现为该区域的多发淋巴结肿大,部分融合成团,边界不清,直径0.3~1.5 cm,增强扫描可见环形强化,这种淋巴结转移的影像表现也缺乏特异性。③邻近骨质破坏相对少见,本组仅1例有明确骨质破坏表现,且骨质破坏范围较轻,呈溶骨性骨质破坏,未见瘤骨形成,未见骨膜反应。
3.3 鉴别诊断 胸壁RMS应与其他胸壁恶性软组织肿瘤鉴别:①平滑肌肉瘤较易发生坏死及囊变,其内可见斑片状水样低密度坏死区,病灶更易侵犯周边血管,而增强扫描其病灶多呈渐进性强化,延迟期强化较明显。②脂肪肉瘤瘤体内可见有脂肪密度成分,部分分化较差的病灶内部脂肪成分少时难以鉴别,但更易侵犯邻近骨骼,骨质破坏程度相对更明显。③纤维肉瘤平扫时密度低于或接近邻近肌肉密度,也可见坏死、囊变及出血,部分肿瘤内可见斑点状钙化影[13],常伴邻近骨骼骨质破坏。④Askin瘤(发生于胸壁的原始神经外胚层肿瘤):典型影像表现为起源于胸壁软组织的不均匀密度肿物,肿瘤内可见囊变、坏死,多伴有肋骨的侵蚀、破坏及胸腔积液[14]。肋骨的骨质破坏以边缘性破坏多见,部分可见丛状骨膜增生[15]。
总之,儿童胸壁RMS的病理类型多为预后较差的腺泡状RMS,及时发现及作出相应的诊疗措施能改善儿童胸壁RMS的预后。CT检查可明确显示肿瘤所在部位,瘤体的大小、成分(有无钙化、出血、脂肪组织等)、范围、与周围组织的关系以及有无远处转移和骨质破坏,增强扫描更可了解瘤体的血供情况等。当患儿通过CT发现胸壁肿物病灶较大,内无钙化及脂肪组织,病灶与周围组织分界欠清,有侵犯邻近脏器,包绕骨质结构但骨质破坏较轻,增强扫描后轻-中度不均匀强化,以周边强化更明显时,应考虑RMS可能。
[1]邵剑波. 小儿横纹肌肉瘤:影像学表现与评价. 中国医学计算机成像杂志,2009,15(5): 462-467.
[2]Rodeberg D,Paidas C. Childhood rhabdomyosarcoma. Semin Pediatr Surg,2006,15(1): 57-62.
[3]张建,邱晓丽,崔定一. 原发性肩背部横纹肌肉瘤1例. 中国医学影像学杂志,2004,12(6): 473.
[4]Hayes-Jordan A,Stoner JA,Anderson JR,et al. The impact of surgical excision in chest wall rhabdomyosarcoma: a reportfrom the Children's Oncology Group. J Pediatr Surg,2008,43(5): 831-836.
[5]Singh O,Gupta SS,Upadhyaya V,et al. Rhabdomyosarcoma of the posterior chest wall in a newborn: a case report. Cases J,2009,2: 6818.
[6]李佩娟. 小儿肿瘤病理学. 北京: 北京出版社,2001: 132-141.
[7]Dasgupta R,Rodeberg DA. Update on rhabdomyosarcoma. Semin Pediatr Surg,2012,21(1): 68-78.
[8]Leaphart C,Rodeberg D. Pediatric surgical oncology: management of rhabdomyosarcoma. Surg Oncol,2007,16(3): 173-185.
[9]Ognjanovic S,Linabery AM,Charbonneau B,et al. Trends in childhood rhabdomyosarcoma incidence and survival in the United States,1975-2005. Cancer,2009,115(18): 4218-4226.
[10]王建文. 小儿横纹肌肉瘤. 实用儿科临床杂志,2005,20(1): 6-7.
[11]Gladish GW,Sabloff BM,Munden RF,et al. Primary thoracic sarcomas. Radiographics,2002,22(3): 621-637.
[12]闫敏,齐波,沈迎建,等. 胸壁原发恶性肿瘤的CT诊断.实用放射学杂志,2004,20(10): 926-927.
[13]杨广夫,刘军. 软组织病影像诊断学. 西安: 陕西科学技术出版社,2001: 66-88.
[14]张卫东,吴沛宏,崔春燕,等. 八例Askin瘤的影像诊断.中华放射学杂志,2007,41(11): 1173-1175.
[15]张在鹏,邓永清,田志雄,等. 外周性原始神经外胚层瘤的临床影像分析. 实用放射学杂志,2008,24(4): 465-467.
(本文编辑 冯 婕)
PurposePrimary chest wall rhabdomyosarcoma (RMS) is very rare with limited imaging characteristic studies in the literature. This paper analyzes the CT imaging features of chest wall RMS in children to improve the diagnostic accuracy.Materials and MethodsThe imaging data of contrast enhanced CT scan of pathology confirmed chest wall RMS in five children were analyzed.ResultsThe lesion was located in the anterior chest wall in one case,in the posterior chest wall in two cases,and the lateral chest wall in two cases (axillary). The tumors were round or spindle in shape with shallow spiculation. Plain CT showed heterogeneous density with patchy low-density necrotic area in two cases,and homogeneous attenuation in three patients. In all five cases there was no calcification or fatty tissue. The tumor involvement of adjacent spinal canal was seen in one case. Visceral compression was evident including lung parenchyma in one case,heart and liver in one case. Tumor blood vessel growth was seen in two cases. All five lesions were adjacent to the ribs,humerus,scapula and the spine with bone destruction in one case. On contrast enhanced scan,all five cases demonstrated heterogeneous mild to moderate enhancement,more prominent in the periphery. There were enlarged feeding arteries. Necrotic areas did not enhance. In two cases there were pulmonary metastases. Pleural effusion and ascites were identified in one case. There was lymph node metastasis in one case.ConclusionThe CT manifestation of children's chest wall RMS for chest wall include large soft tissue mass,heterogeneous density,no calcification or fatty tissue,partial necrosis,adjacent tissue compression,lymph node or distant metastasis. Combining with clinical manifestations,comprehensive analysis of contrast enhanced CT imaging can improve diagnostic accuracy.
Thoracic neoplasms; Rhabdomyosarcoma; Thoracic wall; Tomography,X-ray computed; Pathology,surgical; Child
10.3969/j.issn.1005-5185.2015.12.015
成官迅
Imaging Diagnostic Center,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China
Address Correspondence to: CHENG Guanxun E-mail: chengguanxun@hotmail.com
R445.3;R734.4
2015-07-28
修回日期:2015-11-22
中国医学影像学杂志2015年第23卷12期:934-937,942
Chinese Journal of Medical Imaging 2015 Volume 23(12): 934-937,942
