罗格列酮对人肝癌细胞HepG2裸鼠移植瘤的影响及机制
2015-12-30张萌,彭利,乔治斌等
罗格列酮对人肝癌细胞HepG2裸鼠移植瘤的影响及机制
张萌彭利乔治斌何宏涛周烨徐卓
(河北医科大学第四医院肝胆外科,河北石家庄050011)
摘要〔〕目的探讨罗格列酮对人肝癌HepG2细胞裸鼠皮下移植瘤的影响和可能机制。方法建立人肝癌裸鼠皮下移植瘤模型,随机分为罗格列酮组及对照组。观察移植瘤生长情况,HE染色观察移植瘤细胞形态,流式细胞术(FCM)分析细胞周期及凋亡情况,Western印迹法检测移植瘤细胞中第10号染色体缺失的磷酸酶张力蛋白同源物基因(PTEN)、磷酸化蛋白激酶B(pAkt)、S期激酶相关蛋白2(Skp2)及细胞周期蛋白激酶抑制剂P27kip1蛋白的表达情况。结果研究结束时,罗格列酮组移植瘤体积与重量均明显小于对照组,体积抑制率为52.13%,重量抑制率为65.63%。罗格列酮组移植瘤细胞G0/G1期比例及凋亡率均显著高于对照组 (P<0.05)。罗格列酮组移植瘤细胞PTEN及P27kip1蛋白的表达量明显高于对照组,pAkt及Skp2蛋白表达量明显低于对照组(P<0.05)。结论罗格列酮对人肝癌HepG2细胞裸鼠移植瘤的生长有抑制作用,可引发移植瘤细胞G0/G1期阻滞并诱导其凋亡,其机制可能与罗格列酮上调PTEN蛋白的表达,抑制PI3K/Akt信号通路,下调Skp2蛋白,导致P27kip1蛋白水平升高有关。
关键词〔〕罗格列酮;肝细胞癌;第10号染色体缺失的磷酸酶张力蛋白同源物基因;磷酸化蛋白激酶B;S期激酶相关蛋白2;细胞周期蛋白激酶抑制剂P27kip1
中图分类号〔〕R735.7;R73-361〔文献标识码〕A〔
基金项目:河北省高校强势特色学科资助项目(2005-52);河北省卫生厅资助课题(06142)
通讯作者:彭利(1972-),男,博士,教授,主任医师,主要从事肝胆肿瘤研究。
第一作者:张萌(1977-),男,博士,副主任医师,主要从事肝胆肿瘤的研究。
最近研究在体外实验中发现噻唑啉二酮类(TZDs)药物可通过激活PPAR-γ发挥抑制肿瘤增殖、促进肿瘤细胞凋亡、抑制肿瘤血管生成等作用〔1〕。而其对肝癌细胞裸鼠移植瘤是否具有类似作用及相关机制的体内研究则未见报道。本实验通过构建人肝癌HepG2细胞裸鼠皮下移植瘤模型,观察TZDs典型药物罗格列酮对移植瘤生长及细胞周期和凋亡的影响,检测PTEN、pAkt、Skp2及P27kip1蛋白表达的变化,探讨罗格列酮对裸鼠皮下移植瘤生长的作用及可能机制。
1材料与方法
1.1 主要材料与试剂人肝癌细胞系HepG2由河北医科大学第四医院科研中心提供。BALB/c-nu/nu裸小鼠,共10只,4周龄,雄性,体重18~22 g,购自北京华阜康生物科技股份有限公司(动物许可证编号:SCXK京2009-0007)。于河北医科大学第四医院实验动物中心〔动物实验室合格证号:(SYXK(冀)2008-0051〕,SPF级层流柜内分笼饲养。罗格列酮(商品名:文迪雅)购自葛兰素史克(天津)有限公司。PTEN兔抗人单克隆抗体、pAkt(pS473)兔抗人单克隆抗体购自美国Epitomics公司,Skp2 p45(H-435)兔抗人多克隆抗体、P27kip1(F-8)鼠抗人单克隆抗体购自美国Santa Cruz公司。
1.2 人肝癌细胞系HepG2细胞的制备及荷瘤裸鼠动物模型的建立用含有10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的RPMI-1640培养基在5%CO2、37℃恒温培养箱中培养人肝癌HepG2细胞。取对数生长期的单层培养细胞,用0.25%胰酶对单层细胞进行消化,充分吹打后,无血清RPMI-1640培养基洗涤2次,1 500 r/min,离心5 min,重悬于生理盐水中,调整细胞浓度为2×1010/L,用1 ml空针以每只0.2 ml(4×106个细胞)于裸小鼠左侧肩胛部皮下注射建立移植瘤模型。
1.3 实验分组及药物干预待移植瘤生长至约100 mm3时,将10只裸鼠随机分为罗格列酮组和对照组(每组5只)。罗格列酮组给予30 mg/kg罗格列酮(生理盐水溶解)每天1次灌胃,对照组给予相应体积生理盐水每天1次灌胃。
1.4 裸鼠体内成瘤观察实验过程中每隔3天用游标卡尺测量肿瘤的最长径(a)和最短径(b),按公式计算裸鼠移植瘤体积:V=a×b2/2,并计算相对移植瘤体积(RTV),RTV=Vt/ V0。V0为分组给药时测量所得肿瘤体积,Vt为每一次测量时的肿瘤体积,绘制肿瘤生长曲线。实验结束后采用断颈法统一处死裸鼠,剥离肿瘤,称重,计算肿瘤生长抑制率,体积抑制率(%)=(对照组平均瘤体积-罗格列酮组平均瘤体积)/对照组平均瘤体积×100%。重量抑制率(%)=(对照组平均瘤重-罗格列酮组平均瘤重)/对照组平均瘤重×100%。
1.5 移植瘤组织HE染色移植瘤标本经10%甲醛固定、浸蜡、包埋后,常规病理切片,行HE染色,光镜观察。
1.6 FCM检测细胞凋亡和细胞周期网搓法制备单细胞悬液,PBS洗涤样品,调整每份样品的细胞数为1×106/ml,PI染色,经流式细胞仪,应用Muticycle AV软件对凋亡及细胞周期进行分析。在二倍体细胞峰前出现一个亚二倍体峰判定为凋亡细胞峰,以凋亡率表示凋亡状态。依据DNA细胞周期拟合分析所得组方图,计算出各时相分布的百分比。
1.7 Western印迹法检测PTEN、pAkt、Skp2及P27kip1蛋白表达冰浴下各移植瘤组织块与细胞裂解液在匀浆器中反复研磨(每100 mg组织加400 μl RIPA裂解液),提取总蛋白。蛋白定量采用考马斯亮蓝方法,根据考马斯亮蓝蛋白测定试剂盒说明书进行。
1.8 统计学方法采用SPSS17.0软件进行独立样本t检验。
2结果
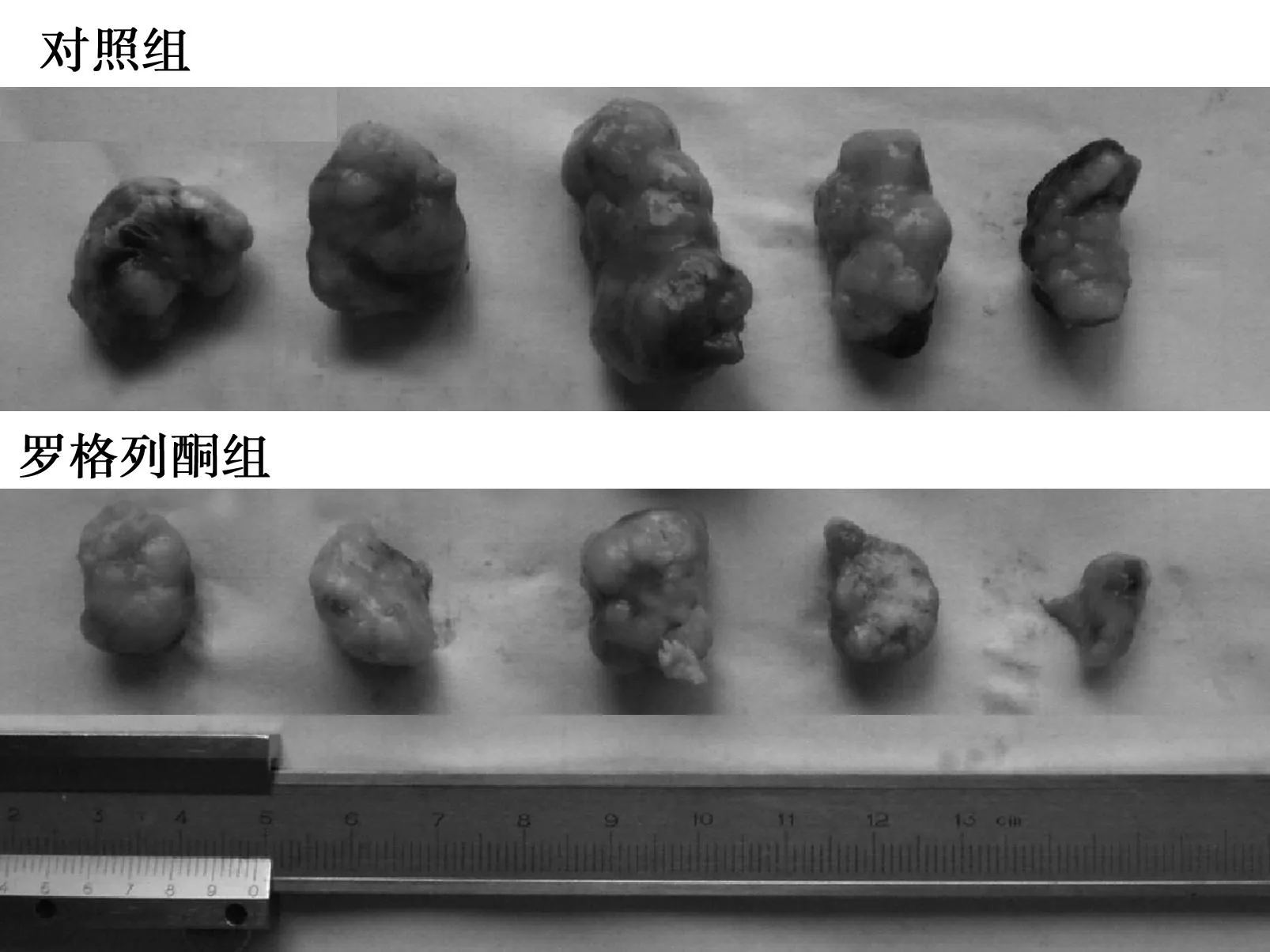
图1 罗格列酮对肝癌HepG2细胞裸鼠移植瘤生长的抑制作用
2.1 罗格列酮对肝癌HepG2细胞裸鼠移植瘤生长的抑制作用接种人肝癌HepG2细胞后,裸鼠皮下注射处2 d后局部水肿消失,5 d后全部成瘤,成瘤率达100%。移植瘤呈圆形或结节形。初期瘤体表面光滑,随着瘤体逐渐增大,药物干预5 w后发现部分裸鼠瘤体表面溃破、结痂。为避免混杂性偏倚,在连续给药5 w、即观察时间共计6 w时终止实验。荷瘤裸鼠生长状态良好,饮食及活动正常,无其他明显不良反应。罗格列酮组的裸鼠RTV低于对照组(P<0.05)(图1、图2)。实验结束时罗格列酮对裸鼠移植瘤的最大体积抑制率为52.13%,重量抑制率为65.63%。见表1。
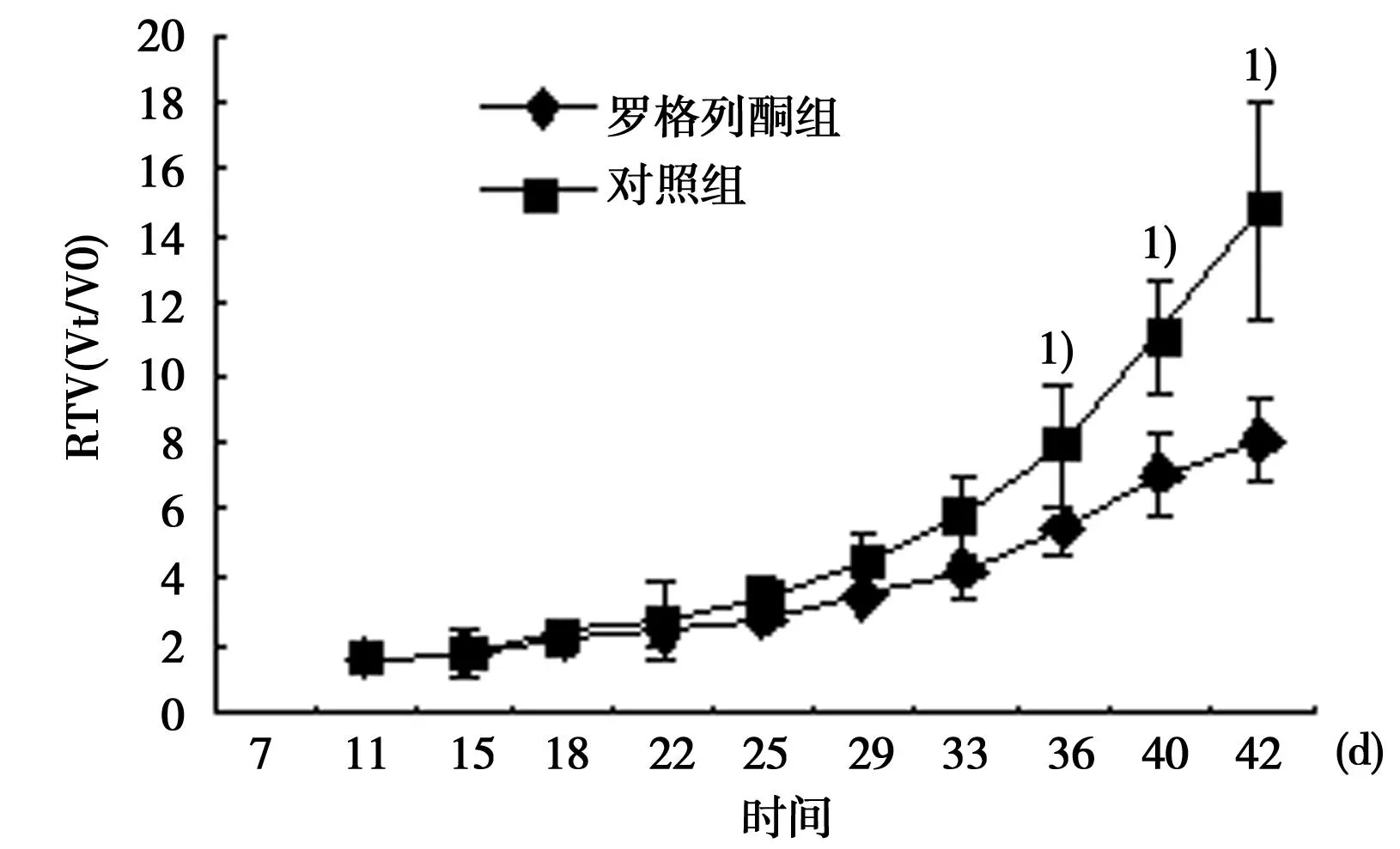
与罗格列酮组比较:1)P<0.05 图2 移植瘤生长曲线

组别RTV(Vt/V0)移植瘤重量(g)抑制率(%)体积重量对照组14.82±5.723.55±1.31--罗格列酮组8.02±1.521)1.22±0.551)52.1365.63
与对照组比较:1)P<0.05;下表同
2.2 裸鼠移植瘤的光镜形态学观察罗格列酮组及对照组移植瘤镜下观察未见明显区别:移植瘤细胞异型性明显,瘤组织少量坏死,局限于中央区域。瘤细胞之间排列紧密,大小不一,形态不规则。细胞核染色质呈粗颗粒状,核仁较大,清晰,偶见瘤巨细胞,核分裂像多见。见图3。
图3 不同组别裸鼠移植瘤光镜下形态观察(HE,×400)
2.3 罗格列酮对裸鼠移植瘤细胞周期和凋亡的影响流式细胞术检测显示,罗格列酮组移植瘤细胞凋亡率高于对照组,罗格列酮组移植瘤G0/G1期细胞比例显著增高,S期细胞比例明显降低(P<0.05),而G2/M期细胞比例无明显变化。见表2。
表2 罗格列酮对移植瘤细胞凋亡和
2.4 裸鼠移植瘤PTEN、pAkt、Skp2及P27kip1蛋白的表达罗格列酮组裸鼠移植瘤组织中pAkt和Skp2蛋白表达量均低于对照组,PTEN和P27kip1蛋白表达量高于对照组(P<0.05) 。见图4、表3。
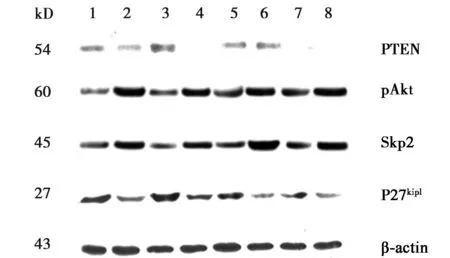
图4 不同组别裸鼠移植瘤中PTEN,pAkt,Skp2 和P27 kip1 蛋白的表达(Western blot)

组别PTEN蛋白pAkt蛋白Skp2蛋白P27kip1蛋白对照组0.20±0.141.55±0.241.49±0.280.39±0.11罗格列酮组0.47±0.221)0.83±0.201)0.65±0.161)0.96±0.251)
与对照组比较:1)P<0.05
3讨论
近年来,PPAR-γ配体的抗肿瘤作用受到越来越多的重视,此类作用与PPAR-γ激活后参与调控多条信号通路有密切关系,但具体的作用机制并不清楚〔2〕。PPAR-γ的合成配体以噻唑烷二酮类药物为主要代表,其中罗格列酮对PPAR-γ的亲和力最大,特异性最强。已有研究证实,罗格列酮可抑制人肝癌MHCC97L、BEL-7404细胞的增殖并诱导其凋亡〔3〕。
前期研究已经证实,PPAR-γ蛋白在人肝细胞癌组织中表达升高,且与肿瘤的恶性生物学行为有一定关系〔4〕,其激动剂罗格列酮可在体外抑制人肝癌细胞的增殖,诱导肝癌细胞凋亡,并使其发生G0/G1期阻滞〔5〕。为了进一步研究罗格列酮的体内抑瘤作用,本实验采用肝癌细胞株移植瘤的方法,于裸鼠皮下接种一定数量的HepG2细胞,成功构建了肝癌荷瘤裸鼠模型。根据文献采用每天1次灌胃法,观察裸鼠移植瘤的变化〔6〕,提示罗格列酮对人肝癌细胞HepG2的裸鼠移植瘤有明显的生长抑制作用。且可诱导人肝癌细胞HepG2的裸鼠移植瘤细胞凋亡,并导致细胞周期发生G0/G1期阻滞,推测这可能是罗格列酮抑制裸鼠移植瘤生长的内在机制。但是光镜下观察并未发现两组存在明显差别,我们认为这符合实体瘤的镜下表现。
Jagan等〔7〕的研究发现,罗格列酮可以上调人结肠癌Caco-2细胞中PTEN的表达,且可被PPAR-γ抑制剂GW9662逆转,证实罗格列酮的该效应是通过激活PPAR-γ实现的。PTEN是迄今发现的唯一具有脂质磷酸酶与蛋白磷酸酶两种活性的抑癌基因,在诱导细胞周期阻滞、促进细胞凋亡以及迁移、分化等诸方面均起重要的作用〔8〕。脂质磷酸酶活性是PTEN抑制肿瘤的主要功能基础,PTEN可通过该活性降解PI3K活化产生的信使PIP3,使其去磷酸化为PIP2,失去对Akt的激活,维持pAkt的低水平,从而抑制PI3K/Akt通路〔9〕。PI3K/Akt信号通路在广泛的人类肿瘤中表达失调,是十分重要的凋亡抑制通路,而作为该通路效应核心的pAkt可以通过多种机制激活Skp2〔10〕。Skp2的激活将加速降解细胞周期抑制蛋白P27kip1,使细胞周期调节失控,导致癌变的发生〔11〕。本实验结果与上述学者的研究结论基本一致,提示罗格列酮促使移植瘤细胞发生G0/G1期阻滞、诱导细胞凋亡的作用机制可能与其上调PTEN的表达水平,抑制PI3K/Akt信号通路,下调Skp2蛋白的表达,最终导致P27kip1蛋白水平升高有关。
另有学者研究发现,PPAR-γ配体可以通过其他信号通路发挥抗肿瘤作用。Shim等〔12〕研究发现吡格列酮及15d-PGJ2可抑制乙型肝炎相关性肝癌细胞的增殖,促进其凋亡,此作用是通过上调肿瘤细胞中凋亡促进蛋白Bax及Bad的表达,降低凋亡抑制蛋白Bcl-2的表达实现的。Bren-Mattison等〔13〕发现PPAR-γ配体可通过抑制非小细胞肺癌细胞中核因子NF-κB的活性,降低环氧合酶-2的表达,诱导细胞凋亡。因此,有关PPAR-γ配体抗肿瘤作用的分子机制及所产生的网络交互作用仍需进行深入研究。
4参考文献
1Okumura T. Mechanisms by which thiazolidinediones induce anti-cancer effects in cancers in digestive organs〔J〕.J Gastroenterol,2010;45(11):1097-102.
2Reka AK,Goswami MT,Krishnapuram R,etal. Molecular cross-regulation between PPAR-γ and other signaling pathways:implications for lung cancer therapy〔J〕.Lung Cancer,2011;72(2):154-9.
3Shen B,Chu ES,Zhao G,etal. PPARgamma inhibits hepatocellular carcinoma metastases in vitro and in mice〔J〕.Br J Cancer,2012;106(9):1486-94.
4张萌,何洪涛,周烨,等. PPAR-γ和PTEN在肝细胞癌组织中的表达及预后价值〔J〕.第三军医大学学报,2011;33(14):1476-9.
5张萌,彭利,苗战军,等. 罗格列酮对肝癌SMMC-7721细胞VEGF蛋白表达的影响〔J〕.肿瘤防治研究,2010;37(3):298-301.
6Leung WK,Bai AHC,Chan VYW,etal. Effect of peroxisome proliferator activated receptor γ ligands on growth and gene expression profiles of gastric cancer cells〔J〕.Gut,2004;53(3):331-8.
7Jagan I,Fatehullah A,Deevi RK,etal. Rescue of glandular dysmorphogenesis in PTEN-deficient colorectal cancer epithelium by PPARγ-targeted therapy〔J〕.Oncogene,2013;32(10):1305-15.
8Song MS,Salmena L,Pandolfi PP. The functions and regulation of the PTEN tumour suppressor〔J〕.Nat Rev Mol Cell Biol,2012;13(5):283-96.
9Hafsi S,Pezzino FM,Candido S,etal. Gene alterations in the PI3K/PTEN/AKT pathway as a mechanism of drug-resistance (review)〔J〕.Int J Oncol,2012;40(3):639-44.
10Katoh M,Igarashi M,Fukuda H,etal. Cancer genetics and genomics of human FOX family genes〔J〕.Cancer Lett,2013;328(2):198-206.
11Luo Y,Xu DQ,Dong HY,etal. Tanshinone ⅡA inhibits hypoxia-induced pulmonary artery smooth muscle cell proliferation via Akt/Skp2/p27-associated pathway〔J〕.PLoS One,2013;8(2):e56774.
12Shim J,Kim BH,Kim YI,etal. The peroxisome proliferator-activated receptor gamma ligands,pioglitazone and 15-deoxy-Delta(12,14)-prostaglandin J(2),have antineoplastic effects against hepatitis B virus-associated hepatocellular carcinoma cells〔J〕.Int J Oncol,2010;36(1):223-31.
13Bren-Mattison Y,Meyer AM,Van Putten V,etal. Antitumorigenic effects of peroxisome proliferator-activated receptor-gamma in non-small-cell lung cancer cells are mediated by suppression of cyclooxygenase-2 via inhibition of nuclear factor-kappaB〔J〕.Mol Pharmacol,2008;73(3):709-17.
〔2013-12-20修回〕
(编辑赵慧玲/曹梦园)
