二氮嗪预处理对Aβ1~42作用神经元NR2B亚基蛋白表达的影响
2015-12-29夏春凤,李艳菊,朱瑾等
二氮嗪预处理对Aβ1~42作用神经元NR2B亚基蛋白表达的影响
夏春凤李艳菊朱瑾杜怡峰马国诏张镛
(山东大学附属省立医院神经内科,山东济南250021)
摘要〔〕目的研究ATP敏感的钾离子通道开放剂二氮嗪(diazoxide)预处理对Aβ1~42作用原代培养神经元N-甲基-D-天冬氨酸(NMDA)受体2B(NR2B)亚基蛋白表达的影响。方法原代培养大鼠皮层海马神经元并进行鉴定,将细胞随机分为对照组、单纯Aβ1~42干预组、二氮嗪预处理1h后Aβ1~42干预组(Aβ1~42+diazoxide)、单纯二氮嗪预处理组,并采用免疫印迹检测不同时间点(24 h、72 h)细胞NR2B亚基蛋白表达水平的变化。结果Aβ1~42(2 μmol/L)作用神经元24 h后,与对照组相比,单纯Aβ1~42干预组和Aβ1~42+diazoxide组的NR2B亚基蛋白表达均无明显改变。Aβ1~42作用神经元72 h后,与对照组比较,单纯Aβ1~42组NR2B亚基蛋白表达量显著升高(P<0.05);而与单纯Aβ1~42干预组相比,Aβ1~42+diazoxide组NR2B亚基蛋白表达明显降低(P<0.05)。结论Aβ1~42作用原代培养神经元72 h,能够显著增加神经细胞NR2B亚基蛋白的表达量;同时,二氮嗪能拮抗Aβ1~42所引起的NR2B亚基蛋白表达量升高,提示二氮嗪可能通过NMDA受体通路影响Aβ1~42的细胞毒性作用。
关键词〔〕二氮嗪;Aβ1~42;NMDA受体;NR2B亚基
中图分类号〔〕R329.21〔
基金项目:国家自然科学基金资助项目(30870874;30600202)
通讯作者:马国诏(1973-),男,副教授,副主任医师,硕士生导师,主要从事研究老年性痴呆和帕金森病发病机制与防治研究。
张镛(1962-),男,教授,主任医师,硕士生导师,主要从事老年性痴呆和脑血管疾病防治研究。
第一作者:夏春凤(1988-),女,硕士,主要从事老年性痴呆发病机制与防治研究。
Effects of ATP sensitive potassium channel opener diazoxide on neural NR2B subunit protein expression induced by Aβ1~42
XIA Chun-Feng, LI Yan-Ju, ZHU Jin,etal.
Department of Neurology, Shandong Provincial Hospital Affiliated to Shandong University, Jinan 250021, Shandong, China
Abstract【】ObjectiveTo study the effects of pretreatment of ATP sensitive potassium channel opener diazoxide on neural NR2B subunit protein expression induced by Aβ1~42.MethodsThe primary neurons were cultured and evaluated, then neurons were randomly divided into control group, Aβ1~42 treatment group, diazoxide pretreatment for 1 h +Aβ1~42 group(Aβ1~42+ diazoxide) and simple diazoxide group, the protein expression level of NR2B subunit was determined by Western blotting for different times(24 h and 72 h).ResultsBeing exposed to Aβ1~42 for 24 h, compared with the control group, the protein expression level of NR2B subunit of both Aβ1~42 group and Aβ1~42+ diazoxide group have no significant difference. However, compared with control group, the protein expression level of NR2B subunit of Aβ1~42 group significantly increases for 72 h(P<0.05); Compared with Aβ1~42 group, the protein expression level of NR2B subunit of Aβ1~42+diazoxide group significantly decreases(P<0.05).ConclusionsAβ1~42 could increase the protein expression level of NR2B subunit in cultured primary neurons for 72 h, and ATP sensitive potassium channel opener diazoxide could inhibit the increasing of protein expression level of NR2B subunit induced by Aβ1-42, it is indicated that diazoxide might affect Aβ1~42-induced cytotoxicity via NMDA receptor pathway.
【Key words】Diazoxide; Aβ1~42; N-methyl-D-aspartate receptor; NR2B subunit
研究证实β-淀粉样蛋白(Aβ)神经细胞毒性机制之一可能与N-甲基-D-天(门)冬氨酸(NMDA)受体活性密切相关〔1〕。NMDA受体是脑内重要的离子型谷氨酸受体,广泛参与神经元的兴奋性突触传递、突触可塑性以及长时程增强等许多生理及病理过程,其中NMDA受体的NR2B亚基对NMDA受体药理和功能特性起决定作用,是一个治疗与NMDA受体相关疾病的潜在靶点〔2〕。中枢神经系统的ATP敏感性钾离子通道(KATP)激活在阿尔茨海默病(AD)中发挥重要的神经保护作用。选择性的KATP通道开放剂二氮嗪(diazoxide)可明显降低Aβ寡聚体聚集和Tau蛋白过磷酸化,且能改善转基因AD鼠模型的认知功能障碍〔3〕;而且二氮嗪预处理可逆转Aβ1~42作用神经元导致的KATP通道亚基过表达和离子流改变,抵抗Aβ1~42的神经细胞毒性,防治神经细胞凋亡〔4~6〕。但是,目前尚未见有关二氮嗪拮抗Aβ细胞毒性与NR2B亚基之间的报道。本研究旨在探讨二氮嗪对Aβ1~42作用于原代培养神经元NR2B亚基蛋白表达的影响,为探索AD新的靶向药物提供基本理论依据。
1材料与方法
1.1材料新生1 d内Wistar大乳鼠,雌雄不限,由山东大学实验动物研究中心提供;Aβ1~42、二氮嗪、多聚赖氨酸均购自美国Sigma公司;胎牛血清、B27 supplement及Neurabasal培养基均购自美国Gibco公司;DMEM高糖培养基购自海克隆公司;兔抗大鼠NMDAR-2B一抗多克隆抗体购自英国Abcam公司;羊抗兔二抗购自中杉公司;羊抗大鼠胆碱乙酰转移酶(ChAT)和相应标记二抗均购自美国Santa Cruz公司;二甲基亚砜购自上海生博医学生物工程科技有限公司。
1.2方法
1.2.1原代培养大脑皮层海马神经元选用新生1 d的Wistar大乳鼠,75%酒精消毒,用显微镊子在无菌操作下分离出大脑皮层及海马置于D-Hank液中,去脑膜,将脑组织剪成碎块,0.125%胰酶37℃消化15 min,用含10%胎牛血清的DMEM培养液终止消化,吸管吹打均匀,200目不锈钢筛网过滤,1 000 r/min离心10 min,加入含10%胎牛血清的DMEM培养液吹打成单细胞悬液,接种于涂有多聚赖氨酸的12孔板(接种密度6×105/ml)及培养皿(接种密度2×106/ml)中,37℃、5%CO2孵箱培养。第二天换含2% B27的Neurabasal培养液,每隔2 d半量换液1次,第7天加药处理。
1.2.2皮层海马胆碱能神经元的鉴定是突触前的胆碱合成标志酶,利用ChAT的抗体作为胆碱能神经的标志物鉴定胆碱能神经元。神经元在爬片的第7天用ChAT免疫细胞化学染色进行鉴定,镜下观察胆碱能阳性神经元胞质内呈棕黄色着色。
1.2.3实验分组及药物处理Aβ1~42人工重组蛋白质0.1 mg,溶10 μl DMSO(DMSO浓度<1‰)中,配成浓度为221 μmol/L,100 μl磷酸盐缓冲液(PBS,pH7.4)稀释,即为原液。将原液置于37℃恒温箱内孵育72 h,进行老化处理,4℃贮存备用,用时混匀。实验分为对照组、单纯Aβ1~42干预组、二氮嗪预处理1 h后Aβ1~42干预组(Aβ1~42+diazoxide组)、单纯二氮嗪预处理组,各组又分为24、72 h两个亚组。细胞培养至第7天,Aβ1~42干预组加入含Aβ1~42(2 μmol/L)的培养液;二氮嗪预处理后Aβ1~42干预组为二氮嗪(50 μmol/L)预处理1 h后加入Aβ1~42(2 μmol/L)共同作用,单纯二氮嗪预处理组为二氮嗪(50 μmol/L)预处理1 h后加等量的PBS和培养液,对照组加等量的PBS和培养液,分别孵育24、72 h。
1.2.4Western印迹检测各组NR2B亚基蛋白的表达Aβ1~42作用神经细胞24 h和72 h后,收集细胞并用PBS洗涤3次,加入适量的RIPA裂解液冰浴中裂解细胞,收集蛋白,BCA法蛋白定量,取60 μg总蛋白上样,行8%SDS-PAGE电泳,然后电转移至PVDF膜上,5%脱脂牛奶封闭后加入一抗(兔抗大鼠NR2B多克隆抗体1∶100)于4℃孵育过夜,用TBST缓冲液洗涤3×10 min,加入辣根过氧化物酶标记的二抗(辣根过氧化物酶标记的山羊抗兔IgG抗体)室温孵育1 h,再用TBST缓冲液洗涤3×10 min,加入发光试剂ECL显色,以β-actin作内参照,用图像分析软件Band Scan进行光密度积分值分析。
2结果
2.1Western印迹检测Aβ1~42与二氮嗪作用神经元24 h后NR2B亚基蛋白的表达单纯Aβ1~42(2 μmol/L)作用神经元24 h后,NR2B亚基蛋白表达(0.66±0.04)与对照组(0.61±0.06)相比没有明显变化(P>0.05);二氮嗪预处理细胞1 h后Aβ1~42共同作用24 h,NR2B亚基蛋白表达(0.58±0.04)较单纯Aβ1~42干预组没有明显改变(P>0.05),单纯二氮嗪预处理组为(0.63±0.09)。见图1。
2.2不同浓度Aβ1~42作用神经细胞72 h后NR2B亚基蛋白表达量改变对照组、2.5、10 μmol/L Aβ1~42组NR2B亚基蛋白表达分别为0.53±0.11,0.98±1.11;1.24±0.13,1.94±0.14。随着Aβ1~42作用浓度的不断增高,NR2B亚基蛋白表达量呈浓度依赖性逐渐升高(P<0.05)。见图2。
2.3Western印迹检测Aβ1~42与二氮嗪作用神经元72 h后NR2B亚基蛋白的表达图3可见,单纯Aβ1~42作用72 h后,NR2B亚基蛋白表达(1.05±0.08)较对照组(0.77±0.09)显著升高(P<0.05);Aβ1~42+diazoxide组NR2B亚基蛋白表达(0.62±0.07)与单纯Aβ1~42干预组明显降低(P<0.05);单纯二氮嗪干预组NR2B亚基蛋白表达(0.57±0.08)较对照组无明显差异(P>0.05)。

1~4分别为对照组、单纯Aβ 1~42干预组、Aβ 1~42+ diazoxide组、单纯二氮嗪预处理组 图1 免疫印迹检测Aβ 1~42及二氮嗪处理细胞 24 h后各组NR2B亚基蛋白表达变化
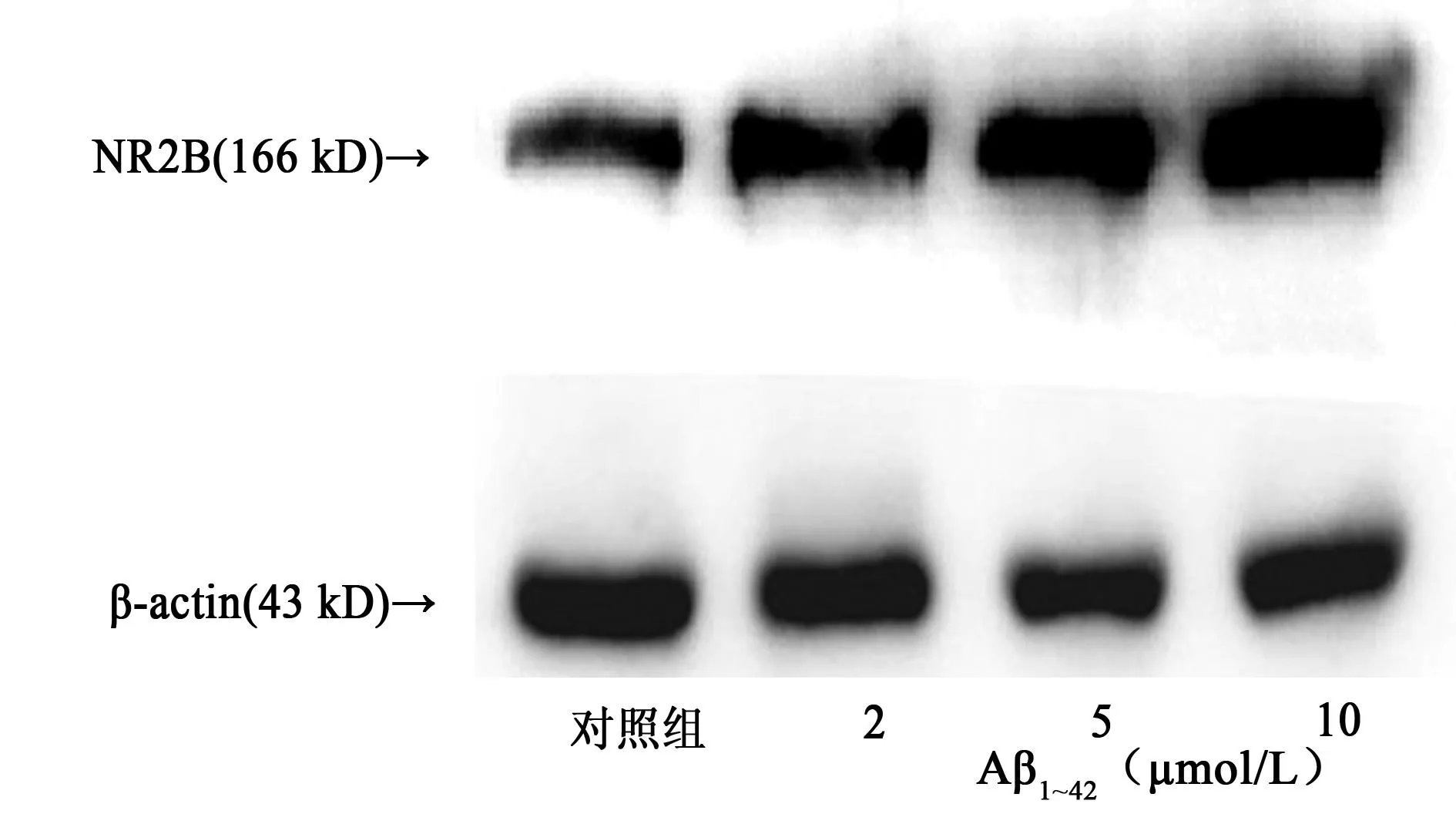
图2 不同浓度Aβ 1~42作用神经元72 h后NR2B 亚基蛋白表达量
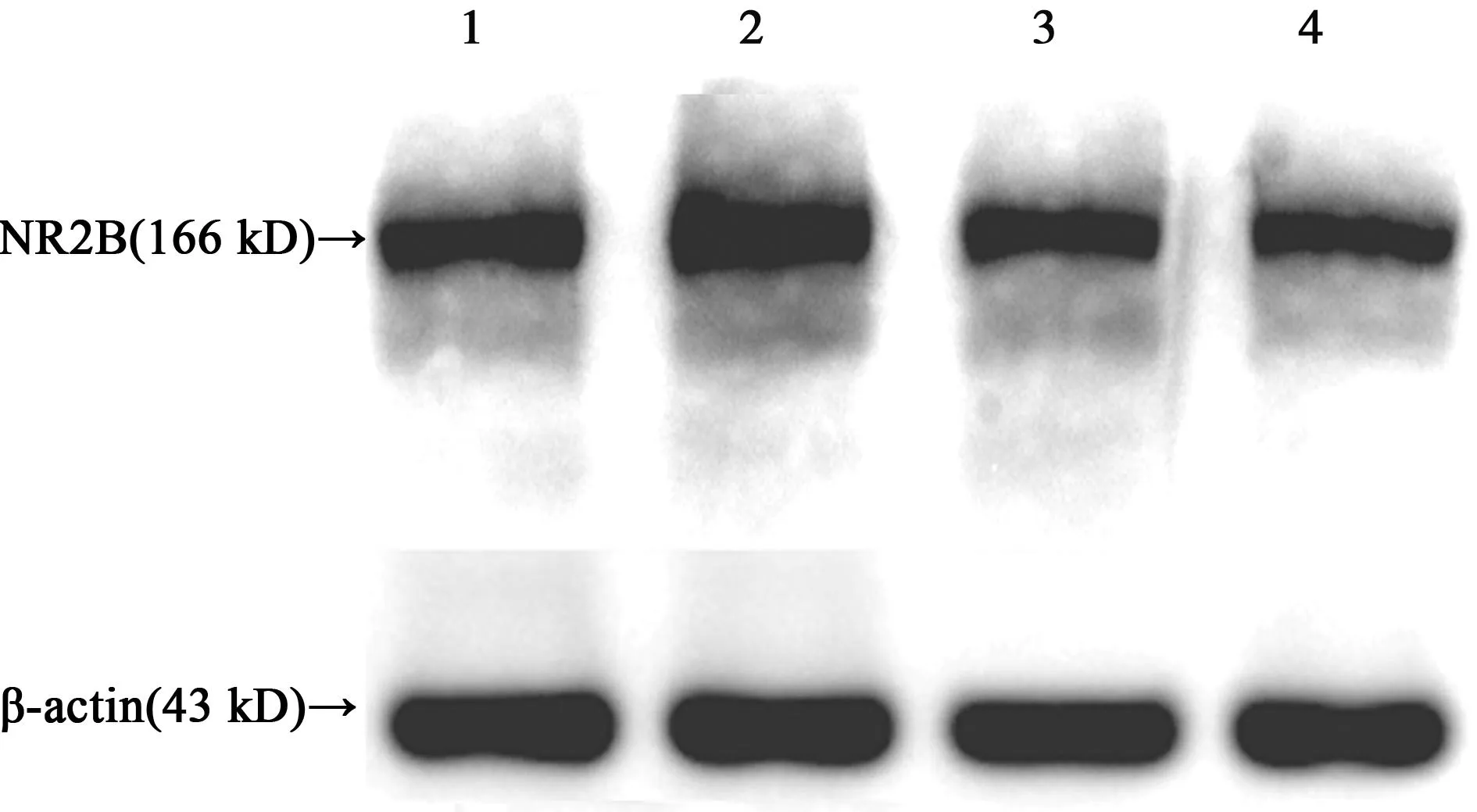
1~4分别为对照组、单纯Aβ 1~42干预组、Aβ 1~42+ diazoxide组、单纯二氮嗪干预组 图3 免疫印迹检测Aβ 1~42及二氮嗪处理细胞72 h 后各组NR2B亚基蛋白表达变化
3讨论
阿尔茨海默病(AD)是痴呆中最常见的一种类型,其临床主要表现为进行性记忆力减退、认知功能障碍和精神行为异常。Aβ级联反应假说认为Aβ沉积在AD发病机制中起着核心作用,线粒体的功能障碍、Tau蛋白的过度磷酸化和神经元的凋亡、突触的降解消失等均与Aβ的生成与聚集有关〔7〕。一些研究表明,AD患者早期的记忆和认知功能的缺失与可溶的Aβ寡聚体诱导的突触功能改变有关。通过毒理学模型观察到Aβ寡聚体可以导致神经元树突棘的广泛损伤,降低突触传递、减弱突触联系并引起海马区神经元的兴奋性中毒〔8〕。目前,Aβ对突触可塑性损伤的具体作用机制尚无定论,研究发现与谷氨酸能系统激活有密切关系。Aβ能降低星形细胞对谷氨酸的再摄取,并影响谷氨酸转运体-1(GLT-1)和谷氨酸-天冬氨酸转运体(GLAST)的活性功能,从而导致突触间隙谷氨酸浓度的异常增高,进而引起了NMDA受体的持续性兴奋〔9〕。Mattson等〔10〕还发现Aβ与NMDA受体间存在直接关系,Aβ能直接增强NMDA受体介导的兴奋毒性作用,并在海马区发现NMDA受体激活后表现胞内Ca2+含量的大幅度增加,并且发生NMDA受体激活易化现象。因此NMDA受体介导的谷氨酸兴奋毒性在Aβ诱导突触可塑性损伤中发挥重要作用。
NMDA受体是典型的异构复合体,由NR1亚单位与NR2亚单位(NR2A-NR2D)构成。NR1是NMDA受体的基本亚基,是实现通道功能所必需的;NR2是调节亚基,辅助NMDA受体实现多元化结构,其中NR2B对NMDA受体的结构和功能有十分重要的作用。离体实验表明NR2B亚基可调节NMDA受体介导的兴奋性突触后电位,影响中枢神经系统的突触可塑性〔11〕,同时含NR2B的NMDA受体离子通道对Ca2+有较高的通透性〔12〕。
本实验研究提示Aβ能够改变NMDA受体复合体的结构和功能,尤其是改变NMDAR1/NMDAR2B型NMDA受体复合体的结构和功能,从而进一步激活NMDA受体,引起胞外Ca2+内流增加,胞内钙超载,参与NMDA介导的细胞兴奋毒性损伤和突触可塑性破坏过程〔13〕。
ATP敏感性钾通道(KATP)广泛分布在中枢神经系统,在生理状态下通道处于关闭状态,当细胞能量代谢发生障碍,细胞内ATP浓度降低和(或)氧化应激损伤时,此通道激活,通过感受细胞内ATP/ADP水平直接将细胞代谢状态与电活动相偶联,对早期的细胞能量代谢障碍可能产生的细胞线粒体等损伤产生保护作用。KATP 通道分为两类:一类是存在于细胞膜上的ATP 敏感性钾离子通道(SarcKATP),另一类是线粒体ATP 敏感性钾离子通道(MitoKATP),其中MitoKATP通道被认为是抗细胞损伤的共同效应器〔14〕。二氮嗪是目前常用的MitoKATP通道特异性开放剂,它对MitoKATP通道的开放作用是SarcKATP通道的2 000倍。研究发现,在AD鼠模型中,二氮嗪预处理能部分改善大鼠的学习记忆能力〔3〕,并能使大鼠大脑皮层和海马部位神经细胞内Bcl-2表达量增加而Caspase-3的表达量降低,可能具有抗细胞凋亡作用〔15〕。另有研究发现,二氮嗪能增强谷氨酸转运体的功能,进而促进星形胶质细胞对谷氨酸的摄取、降低谷氨酸兴奋性毒性〔16〕。Teshima等〔17〕研究报道,二氮嗪预处理可抑制小脑颗粒细胞兴奋性谷氨酸的释放,并认为其可能是通过MitoKATP通道的激活来实现的。
本实验结果提示Aβ能够改变NMDA受体复合体的结构和功能,参与NMDA介导的细胞兴奋毒性损伤和突触可塑性破坏过程〔13〕。进一步研究发现,二氮嗪具有拮抗Aβ1~42升高NR2B亚基蛋白表达的作用,提示二氮嗪可能通过影响NMDA受体复合体结构和功能而拮抗Aβ1~42的细胞毒性作用,但其具体分子信号机制正在研究中。
ATP敏感性钾通道(KATP)可能是脑对各种氧化应激预适应的一个触发器和/或效应器,KATP通道开放剂作为脑保护剂已经成为科研靶点〔18〕,本实验证实KATP开放剂二氮嗪预处理拮抗了Aβ1~42升高NR2B亚基蛋白表达的作用,但是NR2B亚单位结构和功能改变在阿尔茨海默病发病机制和药物防治中具体分子机制仍不清楚,有望为研制新型抗AD药物提供基本理论依据。
4参考文献
1Roselli F,Tirard M,Lu J,etal.Soluble β-Amyloid1-40 induces NMDA-dependent degradation of postsynaptic density-95 at glutamatergic synapses〔J〕.J Neurosci,2005;25(48):11061-70.
2Loftis JM,Janousky A.The N-methyl-D-aspartate receptor subunit NR2B:localization,function properties,regulation,and clinical implication〔J〕.Pharmacol Ther,2003;97(1):55-85.
3Liu D,Pitta M,Lee JH,etal.The KATP channel activator diazoxide ameliorates Aβ and Tau pathologies and improves memory in the 3xTgAD mouse model of Alzheimer’s disease〔J〕.J Alzheimers Dis,2010;22(2):443-57.
4付庆喜,马国诏,车峰远,等.二氮嗪预处理对Aβ1~42作用神经元KATP各亚基表达的影响〔J〕.山东大学学报(医学版),2011;49(9):24-9.
5Zeng XW,Wang T,Jiang LL,etal.Diazoxide and cyclosporin A protect primary cholinergic neurons against beta-amyloid(1-42)-induced cytotoxicity〔J〕.Neuro Res,2013;35(5):529-36.
6Tan SH,Ma GZ,Li YJ,etal.Effects of Aβ1~42on the current of KATP channels in cultured cholinergic neurons〔J〕.Neurol Res,2012;34(7):707-13.
7Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer’s disease:progress and problems on the road to therapeutics〔J〕.Science,2002;297(5580):353-6.
8Lacor PN,Buniel MC,Furlow PW,etal.A beta oligomer-induced aberrations in synapse composition,shape,and density provide a molecular basis for loss of connectivity in Alzheimer’s disease〔J〕.J Neurosci,2007;27(4):796-807.
9Matos M,Augusto E,Oliveira CR,etal.Amyloid-beta peptide decreases glutamate uptake in cultured astrocytes:Involvement of oxidative stress and mitogen-activated protein kinase cascades〔J〕.Neuroscience,2008;156(4):898-910.
10Mattson MP,Cheng B,Davis D,etal.beta-Amyloid peptides destabilize calcium homeostasis and render human cortical neurons vulnerable to excitotoxicity〔J〕.J Neurosci,1992;12(2):376-89.
11Kohr G,Jensen V,Koester HJ,etal.Intracellular domains of NMDA receptor subtypes are determinants for long-term potentiation induction〔J〕.J Neurosci,2003;23(34):10791-9.
12Cais O,Sedlacek M,Horak M,etal.Temperature dependence of NR1/NR2B NMDA receptor channels〔J〕.Neuroscience,2008;151(2):428-38.
13Zempel H,Thies E,Mandelkow E,etal.Abeta oligomers cause localized Ca2+elevation,missorting of endogenous Tau into dendrites,Tau phosphorylation,and destruction of microtubules and spines〔J〕.J Neurosci,2010;30(36):11938-50.
14Dzeja PP,Holmuhamedov EL,Ozcan C,etal.Mitochondria:gateway for cytoprotection〔J〕.Circ Res,2001;89(9):744-6.
15李甲龙,马国诏,张镛,等.二氮嗪对Alzheimer病模型大鼠行为学及相关凋亡因子的影响〔J〕.山东大学学报(医学版),2010;47(7):23-6.
16戴翠萍,曾晓宁,孙秀兰,等.线粒体KATP开放剂二氮嗪促进星形胶质细胞摄取谷氨酸〔J〕.中国临床药理学与治疗学,2006;11(4):398-401.
17Teshima Y,Akao M,Li RA,etal.Mitochondrial ATP-sensitive potassium channel activation protects cerebellar granule neurons from apoptosis induced by oxidative stress〔J〕.Stroke,2003;34(7):1796-802.
18Wickenden AD.K+ channels as therapeutic drug targets〔J〕.Pharmacol Ther,2002;94(1):157-82.
〔2013-12-28修回〕
(编辑徐杰)
