连续性静脉-静脉血液滤过治疗全身炎症反应综合征的作用机制*
2015-12-27王林华赵宏胜高建军许惠芬崔晓莉刘向新
王林华,赵宏胜,高建军,许惠芬,崔晓莉,刘向新,陆 舒
(南通大学附属医院重症医学科,江苏226001)
连续性静脉-静脉血液滤过治疗全身炎症反应综合征的作用机制*
王林华**,赵宏胜,高建军,许惠芬,崔晓莉,刘向新,陆 舒
(南通大学附属医院重症医学科,江苏226001)
目的:探讨连续性静脉-静脉血液滤过技术(CVVH)对全身炎症反应综合征(SIRS)的治疗机制。方法:SIRS患者80例随机分为CVVH治疗组和对照组,分别实行CVVH治疗和常规治疗。监测治疗前后SIRS激活物质内毒素(ET)及与SIRS病程发展密切相关炎症因子及抗炎因子水平;对两组临床指标和预后情况进行分析。结果:(1)CVVH对SIRS患者主要致病因素-内毒素及相关因子降钙素原的清除作用较为显著,内毒素6h时即已清除40%,24h清除率达到80%以上。(2)CVVH组患者血清各炎症因子水平在6小时明显下降,与对照组比较差异有统计学意义(均P<0.01),12h、24h及48h各炎症因子水平持续下降。(3)CVVH组患者体温、心率、呼吸频率和外周血白细胞计数4指标总体改善率达92.50%,对照组的55.00%,两组比较差异有统计学意义(χ2=13.60,P<0.01)。(4)CVVH组MODS的发生率明显低于对照组(χ2=17.64,P<0.01)。发生MODS患者行序贯器官衰竭评分(SOFA评分),CVVH组SOFA评分明显低于对照组(P<0.05)。方法:有效清除患者体内与SIRS激活、级联放大效应以及免疫失衡等环节相关的物质是CVVH治疗SIRS的作用机制,CVVH可以有效阻断SIRS向MODS发展的进程。
全身炎症反应综合征;连续性静脉-静脉血液滤过;内毒素;炎症因子;抗炎因子;多器官功能障碍综合征;酶联免疫吸附试验
1 资料与方法
1.1 一般资料 全身炎症反应综合征80例,男43例,女37例,年龄27~76岁。其中感染因素引起的SIRS 63例,非感染因素引起的SIRS 17例,治疗前患者未发生MODS。按照治疗方法的不同,根据随机原则分为连续性静脉-静脉血液滤过组(CVVH组)和传统抗炎治疗组(对照组)各40例,两组患者分别留取治疗前、治疗后6h、12h、24h和48h患者血清以备检测。两组患者均应用急性生理功能及慢性健康状况评分系统即APACHE-Ⅱ评分系统进行评分,评估危重症患者危险程度,两组分值分别为18.8± 5.5分和18.2±6.4分,两组比较差异无统计学意义(P>0.05)。
1.2 方法 (1)治疗方法:对照组实施常规SIRS治疗,包括选用敏感抗生素,补充各种维生素,根据病情进行相应器官功能支持等。CVVH组在常规治疗基础上实行CVVH治疗,使用血液净化机器为prismaflex,管路及滤器型号为Prismaflex M100 set。治疗参数为:血流量150~180mL/min,前稀释70%,置换液流量2500mL/h,常规使用肝素抗凝,如有出血情况,使用无抗凝治疗。(2)内毒素(Endotoxin,ET)和降钙素原(Procalcitonin,PCT)检测:血清内毒素定量测定采用鲎试剂动态比浊法(厦门鲎试剂厂),检测灵敏度为0.01 EU/mL。血清PCT酶联荧光定量分析(ELFA法)采用VIDAS全自动酶联荧光分析仪及配套试剂(法国梅里埃公司),灵敏度为0.05μg/L。(3)炎症因子和抗炎因子的检测:以ELISA法检测肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、白细胞介素-10(IL-10)和转化生长因子-β(TGF-β)的血清水平变化。所有试剂盒均(上海蓝基生物有限公司),所有操作均按试剂盒说明书进行。(4)相关生理指标监测:常规监测两组患者治疗前和治疗48小时后体温(T)、心率(HR)、呼吸频率(RR)和外周血白细胞计数(WBC)。另外计算两组患者治疗48小时后的APACH II评分及ICU平均住院日和继发MODS数,比较治疗的效果和转归。
1.3 统计学处理 采用SPSS 12.0软件进行统计分析,计量资料以均数±标准差(x¯±s)表示,采用方差(F)分析和u检验进行比较。计数资料以百分率表示,以卡方(χ2)检验进行比较。P<0.05表示差异有统计学意义。
2 结 果
2.1 CVVH对SIRS激活因素的清除作用 CVVH对SIRS患者主要致病因素-内毒素(表1)及相关因子降钙素原(表2)的清除作用较为显著,内毒素6h时即已清除40%,24h清除率达到80%以上。与对照组的传统治疗方法相比,CVVH组对内毒素及降钙素原的清除更加迅捷和有效。
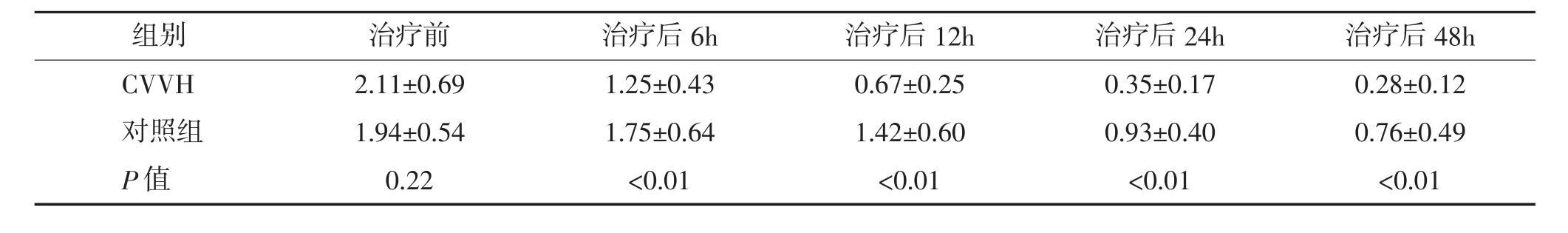
表1 不同治疗手段对血清内毒素(EU/mL)的清除作用(x¯±s)
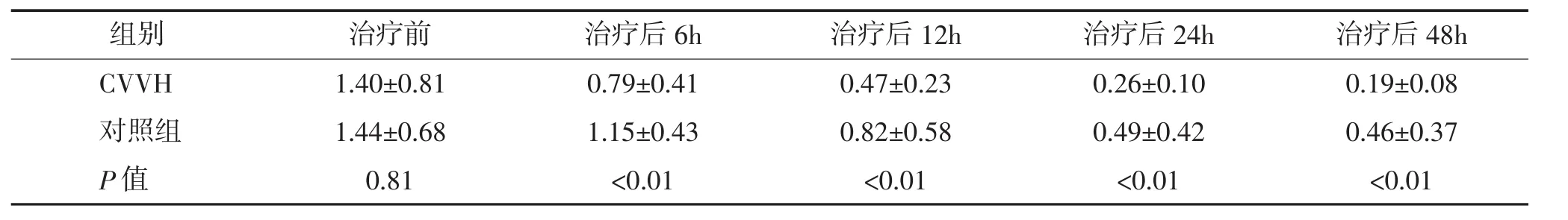
表2 不同治疗手段对血清降钙素原(μg/L)的清除作用(x¯±s)
2.2 CVVH对SIRS患者血清炎症因子的清除作用治疗前两组SIRS患者体内相关炎症因子水平比较差异无统计学意义(均P>0.05)。CVVH组患者血清各炎症因子水平在6小时即出现明显下降,6h时与对照组比较差异有统计学意义(均P<0.01),12h、24h及48h各炎症因子水平持续下降。对照组患者血清炎症因子虽也呈下降趋势,但下降程度与CVVH组相比,差异明显(均P<0.01),见图1。
2.3 CVVH对SIRS患者血清炎症因子的清除作用传统抗炎治疗患者,体内抗炎因子TGF-β和IL-10水平波动较大,在12h内略呈上升趋势,24h后才有下降。而CVVH对SIRS患者血清抗炎因子TGF-β和IL-10起到连续性清除作用。患者体内抗炎因子在各时段持续下降,6h后各时段CVVH组患者血清TGF-β和IL-10水平均明显低于对照组(均P<0.01),见图2。

图1 CVVH组和对照组治疗前后多时段炎症因子的血清水平变化

图2 CVVH组和对照组治疗前后多时段抗炎因子的血清水平变化
2.4 全身炎症反应指标的变化 两种治疗手段治疗SIRS 48小时后,将患者体温、心率、呼吸频率及白细胞计数与治疗前比较,发现CVVH治疗组患者4项指标均较治疗前有明显改善,而对照组患者4项指标的好转情况不明显,两组患者治疗24小时后4项指标的差异均有统计学意义(P<0.01)。CVVH组患者4项指标总体改善(3项或3项以上)率达92.50%,明显优于对照组的55.00%(χ2=13.60,P= 0.0002),见表3。
2.5 CVVH对患者预后及转归的改善 CVVH组行与治疗前比较,*P<0.01;与对照组治疗后比较,#P<0.01CVVH 48h后APACH II评分明显低于对照组(u= 2.22,P=0.0262;u=2.6188,P=0.0088)。CVVH治疗组患者40例发展至MODS阶段仅3例(7.50%),而对照组40例患者发展至MODS阶段20例(50.00%),CVVH组MODS的发生率明显低于对照组(χ2=17.64,P< 0.0001)。发生MODS患者行序贯器官衰竭评分(SOFA评分),CVVH组SOFA评分明显低于对照组(P<0.05),CVVH组患者平均住院日8.2日,与对照组平均14.1日相比,缩短41.8%(u=6.53,P<0.0001;两组患者住院费用比较差异无统计学意义(P>0.05),见表4。

表3 不同治疗手段48小时后全身炎症反应指标的变化(x¯±s)

表3 不同治疗手段患者SIRS预后及转归比较(例,%,x¯±s)
3 讨 论
全身炎症反应综合征(SIRS)这一概念首先由美国胸科医师学会和危重医学会(ACCP/SCCM)1991年提出命名。其SIRS 4条标准符合其中2条或以上即可诊断[3],(1)体温>38℃或<36℃;(2)心率>90次/ min;(3)呼吸频率>20次/min或PaCO2<4.3kPa;(4)外周血白细胞计数>12×106/L或<4×106/L或未成熟中性粒细胞>10%以上。近年来,细胞分子生物学、免疫学及大量临床研究的结果显示,临床上感染、创伤、休克、出血等的危重患者的后期死亡,几乎都经过SIRS-MODS-MOF这一共同过程。因而在SIRS阶段积极治疗,阻止其发展至MODS阶段,是临床治疗SIRS、降低患者死亡率的关键[4-5]。从目前的临床实践来看,大约70%以上的SIRS由感染导致。而创伤、手术等所致SIRS也大都是由肠屏障功能破坏,肠道细菌移位引起,因而细菌内毒素是引起SIRS的主要启动因素和最重要的致病因子[6]。内毒素是革兰氏阴性菌的外膜成分,也是细菌的主要毒性因子,在体内可以激活单核/巨噬细胞和内皮细胞合成和释放大量TNF-α、IL-1、IL-6、IL-8等炎症因子。这些因子进一步刺激机体免疫细胞,继发性产生大量炎症介质和氧自由基等。产生瀑布式级联放大效应,加重炎症反应,对血管张力和渗透性产生影响,导致微循环障碍、休克,进而损伤组织和器官,这即是SIRS发展为MODS过程中的“第一次打击”[7-8]。为了调节体内炎症因子和炎症介质的大量释放和损伤作用,机体产生抗炎因子如TGF-β、IL-10等,以对抗过量的炎症反应。但抗炎因子的释放极易引起免疫功能抑制,使机体对感染的抵抗力下降,易感性增高。这种炎症/抗炎因素交替作用导致的免疫功能紊乱临床上称为代偿性抗炎反应综合征(compensatory anti-inflammatory response syndrome,CARS),是SIRS发展为MODS过程中的“第二次打击”[9-10]。因而目前对SIRS治疗的临床研究主要围绕SIRS启动(内毒素作用)→炎症因子过量释放(瀑布式级联放大效应)→抗炎因子过量释放(CARS)→MODS这一过程的各个环节展开[11-12]。
CVVH技术是连续性血液净化(continuous blood purification,CBP)技术的一种,近年来已广泛应用于临床多种危重疾病的治疗,取得不错的疗效[13]。临床实践和分子细胞学研究表明,CVVH技术可以有效清除体内大量的中分子毒性物质,包括内毒素、炎症因子和抗炎因子等。CVVH既可模拟肾脏对水和溶质的清除模式,持续、大量地清除体内的水及包括内毒素在内的多种溶质,维持机体内环境稳定[14]。也能够通过滤过和吸附作用,清除体内过剩的炎症/抗炎细胞因子,减少对炎症细胞的再刺激,避免了由炎症介质激发的级联式瀑布反应和随后的代偿性抗炎反应[15]。本研究中CVVH组患者血清内毒素6h时即已清除40%,24h清除率达到80%以上。与对照组的传统治疗方法相比,CVVH组对内毒素的清除更加迅捷和有效,这就从源头上消除了SIRS的主要致病因素,为SIRS的治疗奠定基础。降钙素原(PCT)是降钙素的前体蛋白,主要由单核/巨噬细胞产生,是体内最敏感和特异的感染指标,而细菌内毒素是PCT最主要的刺激因子[16]。与对照组相比,CVVH组降钙素原水平的下降也更加明显,且与内毒素下降趋势相符,这也从侧面证明了CVVH技术对机体内毒素的有效清除。
随着体内SIRS主要启动因素-血清内毒素的大幅减少,CVVH本身强大的清除能力,CVVH组患者主要炎症因子和抗炎因子血清水平均呈明显的下降趋势,其下降的速度和幅度均显著高于对照组。这表明CVVH技术对SIRS患者体内炎症因子和抗炎因子均有良好的清除能力,可抑制炎症反应的级联放大和继发的代偿性抗炎反应综合征,达到免疫调节疗效。值得注意的是,传统抗炎治疗往往可以抑制体内炎症因子释放,减轻炎症反应。而对抗炎因子的释放缺乏效果,因而可能加重免疫失衡,易于引发CARS。CVVH技术则可同时清除体内过量的炎症和抗炎因子,这是CVVH相较于传统抗炎治疗的一大优势[17]。
由于CVVH后体内炎症因子和抗炎因子水平的下降,SIRS患者的临床症状和各项指标均有明显改善,体温、心率、呼吸频率和白细胞计数均比治疗前明显下降,且CVVH治疗组的改善效果和改善率均明显优于常规治疗组。在总的预后方面,行CVVH 48h后,CVVH组患者的APACH II和PAPS II评分均明显低于对照组,CVVH治疗组中仅有7.5%的SIRS患者发展至MODS阶段,远远低于对照组的50.0%,CVVH治疗组患者的平均ICU住院日也比对照组降低41.8%。
综上所述,CVVH作为一种治疗手段,可明显清除SIRS患者体内的内毒素、炎症因子和抗炎因子。CVVH有效作用于SIRS发生发展的各个环节,改善SIRS患者的临床症状和各项指标,进而阻断SIRS患者向MODS发展的进程,具有良好的治疗效果。
[1]Gentile LF,Cuenca AG,Efron PA,et al.Persistent inflammation and immunosuppression:a common syndrome and new horizon for surgical intensive care[J].J Trauma Acute Care Surg,2012,72(6):1491-1501.
[2]Afessa B,Green B,Delke I,et al.Systemic inflammatory response syndrome,organ failure,and outcome in critically ill obstetric patients treated in an ICU[J].Chest,2001,120(4):1271-1277.
[3]Bone RC,Balk RA,Cerra FB,et al.Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis The ACCP/SCCM Consensus Conference Committee.American College of Chest Physicians/Society of Critical Care Medicine[J].Chest,1992,101(6):1644-1655.
[4]Yamakawa K,Ogura H,Koh T,et al.Platelet mitochondrial membrane potential correlates with severity in patients with systemic inflammatory response syndrome[J].J Trauma A-cute Care Surg,2013,74(2):411-417.
[5]Scott HF,Donoghue AJ,Gaieski DF,et al.The utility of early lactate testing in undifferentiated pediatric systemic inflammatory response syndrome[J].Acad Emerg Med,2012,19(11):1276-1280.
[6]Koch A,Meesters MI,Scheller B,et al.Systemic endotoxin activity correlates with clot formation:an observational study in patients with early systemic inflammation and sepsis[J]. Crit Care,2013,17(5):R198.
[7]Vlahakos D,Arkadopoulos N,Kostopanagiotou G,et al.Deferoxamine attenuates lipid peroxidation,blocks interleukin-6 production,ameliorates sepsis inflammatory response syndrome,and confers renoprotection af ter acute hepatic ischemia in pigs[J].Artif Organs,2012,36(4):400-408.
[8]Bishehsari F,Sharma A,Stello K,et al.TNF-alpha gene(TNFA)variants increase risk for multi-organ dysfunction syndrome(MODS)in acute pancreatitis[J].Pancreatology,2012,12(2):113-118.
[9]Sitniakowsky LS,Later AF,Van De Watering LM,et al.The effect of RBC transfusions on cytokine gene expression after cardiac surgery in patients developing post-operative multiple organ failure[J].Transfus Med,2011,21(4):236-246.
[10]Matera G,Puccio R,Giancotti A,et al.Impact of interleukin-10,soluble CD25 and interferon-γ on the prognosis and early diagnosis of bacteremic systemic inflammatory response syndrome:a prospective observational study[J].Crit Care,2013,17(2):R64.
[11]Klein KP,Ong DS,Bonten MJ,et al.Classification of sepsis, severe sepsis and septic shock:the impact of minor variations in data capture and definition of SIRS criteria[J].Intensive Care Med,2012,38(5):811-819.
[12]Brunner R,Rinner W,Haberler C,et al.Early treatment with IgM-enriched intravenous immunoglobulin does not mitigate critical illness polyneuropathy and/or myopathy in patients with multiple organ failure and SIRS/sepsis:a prospective,randomized,placebo-controlled,double-blinded trial[J].Crit Care,2013,17(5):R213.
[13]Hongliang T,Rong Z,Xiaojing W,et al.The Effects of Continuous Blood Purification for SIRS/MODS Patients:A Systematic Review and Meta-Analysis of Randomized Controlled trials[J].ISRN Hematol,2012,2012L:986795.
[14]Zhou F,Song Q,Peng Z,et al.Effects of continuous venous-venous hemofiltration on heat stroke patients:a retrospective study[J].J Trauma,2011,71(6):1562-1568.
[15]He C,Zhang L,Shi W,et al.Coupled plasma filtration adsorption combined with continuous veno-venous hemofiltration treatment in patients with severe acute pancreatitis[J]. J Clin Gastroenterol,2013,47(1):62-68.
[16]Su L,Feng L,Song Q,et al.Diagnostic value of dynamics serum sCD163,sTREM-1,PCT,and CRP in differentiating sepsis,severity assessment,and prognostic prediction[J]. Mediators Inflamm,2013,2013:969875.
[17]Lu GP,Wang Y,Lu ZJ,et al.Effect of continuous blood purification on concentrations of plasma va soactive substances and cardiac function in endotoxic shock[J].Pediatr Crit Care Med,2012,13(6):e377-e382.
The study on effective mechanism of continuous venous-venous hemofiltration (CVVH)on patients of systemic inflammatory response syndrome(SIRS)
WANG Linhua,ZHAO Hongsheng,GAO Jianjun,XU Huifeng,CUI Xiaoli,LIU Xiangxin,LU Shu
(ICU,the Affiliated Hospital of Nantong Universtiy,Jiangsu 226001)
Objective:To study the effects and mechanism of CVVH treating systemic inflammatory response syndrome(SIRS).Methods:Eighty patients with SIRS were divided into the CVVH group and the control group randomly,and recevied continuous venous-venous hemofiltration and conventional treatment,respectively.Monitoring clinical indexes (temperature,heart rate,breathing rat and white blood-cell counts)and serum levels of endotoxin(ET),inflammatory cytokines(TNF-α,IL-1,-6 and-8)and anti-inflammatory cytokines(TGF-β and IL-10)before and after treatment.The outcomes of SIRS patients in the two groups were judged by counting the occurrence of MODS and average hospitalization in ICU.Results:After CVVH,serum levels of ET,inflammatory cytokines and anti-inflammatory cytokines were significantly lower than before,the effects in the CVVH group obviously better than in the control(P<0.01).There were improvements of clinical indexes in the CVVH group,and also better than in the control(P<0.01).Only 7.5%SIRS patients with the CVVH developed MODS,that was significant lower than 50.0%in the controls(P<0.0001),and the average hospitalization in ICU of the CVVH group was reduced by 41.8%compared with the control.Conclusions:CVVH could effectively eliminate the those factors associated with activation,cascade the effect and immune disequilibrium of SIRS,and prevent the process of SIRS to MODS.
Systemic inflammatory response syndrome;Continuous venous-venous hemofiltration;Endotoxin;inflammatory cytokine;Anti-inflammatory cytokine;Multiple organ failure;enzyme-linked immunosorbent assay全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)是目前ICU中危重患者死亡的重要原因之一[1-2]。其发病机理是在感染或非感染因素(创伤、手术等)作用下,机体释放大量炎症因子,产生瀑布样级联放大效应,进而导致免疫功能紊乱和不可控制的过度反应症候群。此病极易发展为多器官功能障碍综合征(multiple organ disorder syndrome,MODS)和多器官功能衰竭(multiple organ failure,MOF)进而危及生命。本研究利用连续性静脉-静脉血液滤过 (continuous venous-venous hemofiltration,CVVH)技术治疗SIRS,同时检测CVVH治疗过程中与SIRS激活、级联放大效应、免疫失衡相关系列炎症介质和细胞因子水平以及多项生理指标。我院重症监护病房(ICU)2012年8月—2013年8月收治SIRS患者80例,对其中40例实行CVVH治疗(观察组),另40例给予传统抗炎治疗(对照组),现就临床资料进行对比观察,以分析CVVH治疗SIRS、阻断SIRS向MODS发展过程的作用机制。
R459.5
A
2015-04-12
1006-2440(2015)03-0222-06
南通市2011K应用研究计划(BK2011073)。
**[作者简介]王林华,男,汉族,江苏如东人,生于1977年6月,本科,研究方向:危重病的诊疗。 通信作者:高建军,E-mail:txgaojian jun@163.com。
