微生物法快速检测婴幼儿配方乳粉中叶酸含量
2015-12-27张慧吴环黄伟乾刘冬虹冼燕萍郭新东叶梅万渝平
张慧,吴环,黄伟乾,刘冬虹,冼燕萍,郭新东,叶梅,万渝平
(1.广州质量监督检测研究院,广东广州510110;2.成都市食品药品检验研究院,四川成都610000)
微生物法快速检测婴幼儿配方乳粉中叶酸含量
张慧1,吴环1,黄伟乾1,刘冬虹1,冼燕萍1,郭新东1,叶梅2,万渝平2
(1.广州质量监督检测研究院,广东广州510110;2.成都市食品药品检验研究院,四川成都610000)
建立了一种高效快速检测婴幼儿配方乳粉中叶酸含量的微生物方法。方法通过改进试验用菌的保存和传代,优化样液制备和加样体积,结合八道排枪同时加样操作和96孔酶标板技术进行检测,减少了试验步骤和试验误差。结果表明,方法标准曲线相关系数为0.9992,检出限为2μg/100g,样品平行试验的相对标准偏差(RSD)在7.5%~9.5%之间,加标回收率在93.3%~105%之间,检测周期缩短为2 d。与国标方法等相比较,本方法具有简单快速、灵敏度高、重现性好等特点,可准确快速检测婴幼儿配方乳粉中叶酸含量。
叶酸;微生物法;快速检测
叶酸(Folic acid)属于B族维生素,1941年被分离提纯并定名为叶酸[1]。叶酸是一组化学结构相似,生化特征相近的化合物的统称,由蝶啶、对氨基苯甲酸与1个或多个谷氨酸结合而成[2]。叶酸是维持人体生长发育及新陈代谢的重要水溶性维生素。有研究表明,人群中叶酸缺乏会导致胎儿先天性异常,特别是神经管畸形的发生[3];也会引起细胞性贫血和粒细胞减少,尤其对于处于生长发育旺盛期的婴幼儿,如果缺少足够的叶酸,生长就会受到严重影响[4]。婴幼儿配方乳粉是以婴幼儿生长时期的特殊营养需要而设计的产品,对于强化维生素的含量有严格要求;婴幼儿配方乳粉中叶酸的含量十分微量,一般在20μg/100 g~200μg/100 g之间。因此,快速准确测定婴幼儿配方乳粉中叶酸的含量具有重要的意义。
目前测定叶酸的方法有比色法、薄层层析法、气相色谱-质谱法、高效液相色谱法、微生物法和同位素放射免疫法[5-7]等。测定原料叶酸、纯叶酸制品或药品制剂中的叶酸质量分数一般采用比色法;而生物体、食品中叶酸的测定多采用微生物法、同位素放射免疫法或色谱法、色-质联用法[8]。婴幼儿配方乳粉中叶酸含量的测定可以采用微生物法和仪器法,但可能因奶粉基质干扰的影响,仪器法的灵敏度和回收率都比微生物法低,微生物法的实际应用更为普遍。在第18版的AOAC标准方法中,食物中生物素、泛酸、叶酸、VB12和烟酸的第一分析方法均为微生物法;我国食品安全国家标准中关于婴幼儿食品和乳品中叶酸含量的测定,微生物法是唯一的测定方法,其测定原理为:应用对叶酸具有极强特异性的干酪乳杆菌(Lactobacillus casei)菌种,一定条件下该菌种的生长繁殖速度与溶液中叶酸的含量成一定的对应关系来进行定量检测[8-9]。本试验在传统的国家标准微生物法和商业化的试剂盒法的基础上,通过改进试验用菌的保存和传代,优化样品溶液的制备,结合八道排枪同时加样操作和96孔酶标板技术,简化了试验步骤、缩短了检测周期、减少了残留维生素带来的污染,建立了快速检测婴幼儿配方乳粉中叶酸含量的微生物方法。
1 材料与方法
1.1 材料与仪器
试验菌株:干酪乳杆菌(Lactobacillus casei)ATCC 7469(美国典型培养物保藏中心,产地:美国);培养基:乳酸杆菌肉汤培养基,叶酸酪蛋白培养基,均为BD(碧迪医疗器械(上海)有限公司,产地:美国);标准品:叶酸(99.9%)(USP,上海安谱科学仪器有限公司,产地:美国);抗坏血酸钠(国药集团化学试剂有限公司),配制叶酸酪蛋白培养基时加入0.05%抗坏血酸钠;1.2mLPP管(美国Corning公司);1.2mL冻存管(美国Corning公司)。
试验样品:Standard ReferenceMaterial1849a(SRM 1849a)(National Institute of Standards and Technology,产地:美国,奶粉基质的标准样品,叶酸含量229.3± 6.2 ug/100 g)、市售婴幼儿配方乳粉和市售孕妇奶粉。
仪器:TransferpetteRS-8八道排枪(德国BRAND);HVE-50高压灭菌锅(日本平山公司);GNP-9270隔水式恒温培养箱(上海精宏实验设备有限公司);680酶标仪(美国BIO-RAD公司);通Z323K用型高速离心机(德国HERMLELabortechnik GmbH公司);VORTEX 4 basic涡旋振荡器(德国IKA公司)。
1.2 方法
1.2.1 菌种的制备与保存
将干酪乳杆菌干粉接种到已灭菌乳酸杆菌肉汤,(36±1)℃培养2 h~24 h。将乳酸杆菌肉汤培养物3 000 r/min离心10min,弃去肉汤培养基,加入无菌水如此清洗3次后得到不含有培养基的菌液,吸取一定体积的此菌液加入到已灭菌的含有甘油和抗坏血酸钠的叶酸酪蛋白测定培养基中,调节麦氏单位约为2.0,加入冻存管中,制备成试验用菌悬液,-80℃超低温冻存。每次试验时取出后即可使用。
1.2.2 标准工作液和标准曲线溶液的制备
叶酸标准工作溶液的浓度为0.60 ng/mL,在无菌条件下使用无菌滤器过滤备用。
在无菌条件下,按表1顺序在灭菌小管中对叶酸标准工作液进行稀释,制备相应浓度的标准曲线溶液。
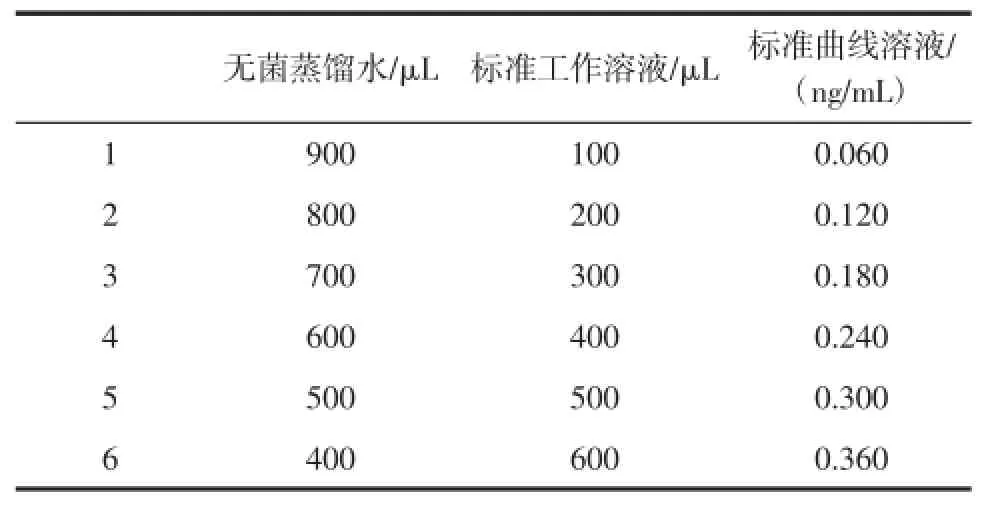
表1 叶酸标准曲线溶液的制备Table 1 Thepreparation of folic acid standard curvesolution
在已灭菌的PP管中每管加入300μL系列标准曲线溶液和300μL含有0.05%浓度试验用菌悬液的无菌叶酸酪蛋白培养基,一式3份,使用涡旋振荡器混合。
1.2.3 样品测定液的制备
称取5 g样品,作20倍稀释,95℃水浴30min,充分溶解后制得待测样品溶液。将待测样品溶液在无菌条件下使用无菌滤器过滤,根据样品标示叶酸的含量进行适当稀释,得到样品工作液。
在无菌条件下,按表2顺序在灭菌小管中对样品工作液进行稀释,制备相应浓度的样品测定溶液。

表2 样品测定液的制备Table 2 The preparation of sam p le determ ination solution
在已灭菌的PP管中每管加入300μL系列样品测定溶液和300μL含有0.05%浓度试验用菌悬液的无菌叶酸酪蛋白培养基,一式3份,使用涡旋振荡器混合。
1.2.4 培养
使用96孔试验盒,将已灭菌的PP管插入试验盒,每列8根管,使用八道排枪按1.2.2和1.2.3加样后(36±1.0)℃培养24 h~28 h。
1.2.5 测定
混合均匀,使用酶标仪630 nm波长进行读数。平行小管相对偏差小于15%的为有效数值。
1.2.6 样品叶酸含量的计算
根据样品每管的吸光值从叶酸标准曲线查得对应的叶酸含量,除以相对样液体积v,得到每管样品溶液中叶酸含量。由所有有效管中测得的数值计算平均值。样品中叶酸含量按下列公式计算:X/(μg/100 g)=×100,式中:m为样品质量,(g);f为样品稀释倍数。
2 结果与讨论
2.1 菌种制备与保存方法的改进
传统的微生物法常存在检测周期长、操作繁琐等问题。GB 5413.16-2010《食品安全国家标准婴幼儿食品和乳品中叶酸(叶酸盐活性)的测定》是传统的微生物法,实验用菌株的保存与传代,每月都要转接一次作为月接种管,每次试验前要从月接种管转接一次作为日接种管,试验时日接种管都要进行菌种的洗涤去除冻存培养基,然后制备成试验用菌液,这样每次试验的耗时较长,步骤繁琐,菌种制备需要2 d,试验操作1 d,培养1 d~1.5 d,整个检测周期耗时4 d~4.5 d。
本试验方法中,试验用菌悬液预先于-80℃超低温冻存在含有甘油和抗坏血酸钠冻存管中,其中甘油作为防冻剂防止冰晶对细胞造成伤害,有效保护了菌种[10]。每次试验时只需要拿出一支添加到培养基中,不仅可以保证菌种被混匀到培养基中,也简化了操作步骤;而冻存管中的抗坏血酸钠在培养和检测中也起到了一定的防止叶酸被氧化的作用。在整个试验中,试验操作1 d,培养1 d,仅需2 d就可以完成检测,大大缩减了检测周期,提高了工作效率。
2.2 样液制备和测定方法的优化
GB 5413.16-2010方法中,样品溶液制备需要经过多步稀释,使用了大量需高温灭菌的玻璃器皿,最终培养的试验体积需要10mL,总体积较大,造成试验操作耗时,而且操作过程中容易存在微量维生素污染的问题,导致实验重复性差。本试验方法中,标准曲线和样品测定液的制备均使用一次性灭菌的1.2mLPP管,在保证检测灵敏度的前提下,最终培养的试验体积只需要600μL(样品测定溶液和培养基各为300μL),由于添加体积的缩小,可以使用八道排枪进行操作,不仅操作简便,而且保证了每个PP管中的添加量一致,提高了试验的准确度;同时,一次性灭菌PP管的使用,避免了残留维生素的污染。
德国拜发公司推出VitaFastR维生素检测试剂盒,试验原理与国标相同,它将96孔酶标板和酶标仪引入到试验中,以ELISA微孔板方法为形式和载体,进行维生素的测定,这种商业化的试剂盒法操作简便,大大缩短检测时间[11-12],但其配套标准溶液的保藏是影响试验结果准确性的关键因素,如果样品溶液只做一个稀释度的检测,会极大地影响检验结果准确性,而且价格昂贵。本试验方法中,在改进菌种制备和保存、样品溶液制备方法的基础上,引入96孔酶标板技术,进一步缩短检测时间,提高工作效率,而且降低了试验成本。
2.3 标准曲线与方法的检出限
以表1的系列叶酸浓度做为横坐标,以吸光度值做为纵坐标,根据四参数方程拟合标准曲线,结果如图1所示。

图1 叶酸标准曲线Fig.1 Folic acid standard curve
标准曲线相关系数达到0.999 2,表明相关性良好。根据样品的处理和回收率情况,计算本方法的检出限为2μg/100 g,表明方法灵敏度高。
2.4 方法回收率和重复性试验
2.4.1 加标回收试验
配制叶酸标准溶液浓度为10 000 ng/mL,以SRM 1849a为试验样品,分别称取4次5 g试验样品,各加入0、0.5、1.0、2.0m L叶酸标准溶液,即加标量分别为0、5 000、10 000、20 000 ng,然后分别定容至100mL,按步骤1.2进行试验,分别做3次重复试验,试验结果如表3所示,回收率为93.3%~105.0%,表明方法回收率高。

表3 加标回收试验结果Tab le3 Theadd ition standard recovery test's result
2.4.2 重复性试验
分别对SRM 1849a和6种不同的配方奶粉进行检测,每种样品做6次平行对照。结果显示,SRM 1849a的RSD值为7.4%,6种奶粉6次平行试验的RSD在7.5%~9.5%之间(表4),说明本方法的重现性良好。

表4 重复性实验结果Table4 Repetitive test’s result
2.5 方法的比较
根据2.1和2.2所述,相比GB 5413.16-2010,本方法具有检测效率高、准确灵敏等特点;相比商业化试剂盒方法,本方法具有检测成本低、重现性好等优点。
试验进一步比较了采用反相离子对色谱法和本方法进行检测的结果,见表5。

表5 反相离子对色谱法与本方法的比较Table 5 The com parison of reversed phase ion pair chromatography andm icrobiologicalm ethod
其中反相离子对色谱法的前处理条件参照GB 5413.16-2010(称取样品10g,加磷酸盐缓冲液(0.05mol/L,临用前按1.0 g/100m L加入抗坏血酸,再用氢氧化钠调到pH7.0)70mL溶解,置于121℃灭菌15min,冷却后滴加几滴(1+1)盐酸溶液使蛋白沉淀,再定容至100mL,过滤后,滤液待测),色谱条件参照GB/T17813-1999《复合预混料中烟酸、叶酸的测定高效液相色谱法》,方法检出限为60μg/kg(即6μg/100 g)。反相离子对色谱法的样品加标量为16.46μg,本方法的样品加标量为5 000 ng。由表5可见,反相离子对色谱法的回收率在80%左右,实验数据呈现出样品中叶酸含量不同,其回收率差异较大,叶酸含量越大,回收率越高;而本方法的回收率在98%左右,不同叶酸含量样品的回收率相差不大,回收稳定性较好。
3 结论
本试验在传统的国家标准微生物法和商业化的试剂盒法的基础上,通过对整个实验过程的优化,将试验用菌悬液预先超低温冻存在含有甘油的冻存管中,同时采用八道排枪进行加样,减少了试验步骤和试验误差;将96孔酶标板试验原理引用到微生物法中,采用酶标仪微孔板方式对维生素进行读数[13],建立了快速检测婴幼儿配方乳粉中叶酸含量的微生物法。与国标等其它方法相比较,本方法具有检测周期短、操作步骤简便、结果准确、重现性高和节约检测成本等优势,适合在常规试验室进行推广应用。
[1]迟晓星,张涛,赵静,等.叶酸的提取及抗氧化性研究[J].现代食品科技,2011,27(10):1234-1237
[2] Samuel J,Stephane R,Bernadette G,etal.One-Carbon Metabolism in Plants:Regulation of Tetra hydro folate Synthesis during germination and SeedlingDevelopment[J].PlantPhysiology,2003,131:1431-1439
[3]谷茜,刘佳琦,何达,等.神经管缺陷发生原因的循证医学研究[J].中国妇幼保健,2011,26(24):3825-3829
[4]王旻,孙宏志,杨秀如,等.婴儿配方食品中叶酸测定[J].中国乳品工业,2002,30(5):120-122
[5]Dansky LV,Andermann E,RosenblattD,etal.Anticonvulsants,folate levelsand pregnancy outcome:A prospective study[J].Ann Neurol,1987,21:76-82
[6] Kohashi M,Inoue K,Sotobayashi H,et al.Microdetermination of folate monoglutamates in serum by liquid chromatography with electrochemical detection[J].JChromatogr,1986,382:303-307
[7] Finglas PM,W igertz K,Vahteristo L,etal.Standardisation of HPLC techniques for the determination of naturally-occurring folates in food[J].Food Chem,1999,64:245-255
[8]石丹,贾云虹,包怡红,等.叶酸检测方法的研究现状及发展趋势[J].中国乳品工业,2009,37(3):42-45
[9]李全霞,崔亚娟,赵寅菲,等.微生物法测定食品中水溶性维生素的原理及进展[J].食品科学,2013,34(13):338-344
[10]Grossowicz N,Waxman S,Schreiber C.Cryoprotected Lactobacillus casei:an approach to standardization of microbiological assay of Folic acid in Serum[J].ClinicalChemistry,1981,27(5):745-747
[11]王旻.试剂盒法测定乳粉中的维生素[J].中国乳品工业,2012, 40(3):57-59
[12]张旺,邹志飞,袁慕云,等.微孔板试剂盒法检测婴幼儿配方奶粉中叶酸质量分数[J].中国乳品工业,2013,41(2):59-64
[13]毛伟贞.维生素的国际标准检测方法研究[J].中国高新技术企业, 2012(5):34-35
Rapid M icrobiologicalM ethods Detecting the Content of Folic Acid in Infant Formula M ilk Powder
ZHANGHui1,WUHuan1,HUANGWei-qian1,LIUDong-hong1,XIANYan-ping1,GUOXin-dong1,YEMei2,WANYu-ping2
(1.Guangzhou Quality Supervision and Testing Institute,Guangzhou 510110,Guangdong,China;2.Chengdu Food and Drug Inspection Institute,Chengdu 610000,Sichuan,China)
A simpleand rapidmethod wasestablished based onmicrobiologicalmethods to determine folic acid in infant formula milk powder.The experimental procedures and test errors were reduced through improved preservation and passage of bacteria,optimization of sample preparation and sample volume with the eight volley and 96-wellmicroplate.Under the optimal conditions,the correlation coefficient of standard curvewas 0.9992,detection limitwas2μg/100 g,the relative standard deviation (RSD)of sample parallel assaywere between 7.5%-9.5%,Themean recoveries for infant formulamilk powderwere between 93.3%-105%,and test cycle was reduced to 2 days.Themethods compared with national standard method were simple,rapid,sensitive and reproducible characteristics so that the content of folic acid in infant formulamilk powder was accurately and rapidly tested.
Folic acid;microbiologicalmethod;Rapid test
10.3969/j.issn.1005-6521.2015.05.017
2015-03-02
广东省质量技术监督局科技项目(2013CS01)
张慧(1985—),女(汉),工程师,本科,研究方向:食品微生物检验。
