双抗体靶向阿霉素纳米药物的研制及其靶向抗骨肉瘤作用
2015-12-27郑亦静张小磊林焱武垚森张琼
郑亦静,张小磊,林焱,武垚森,张琼
(温州医科大学附属第二医院 骨科,浙江 温州 325027)
·论 著·
双抗体靶向阿霉素纳米药物的研制及其靶向抗骨肉瘤作用
郑亦静,张小磊,林焱,武垚森,张琼
(温州医科大学附属第二医院 骨科,浙江 温州 325027)
目的:合成双抗体(抗壳聚糖抗体、抗HER2抗体)-阿霉素-壳聚糖纳米粒,研究其体外肿瘤细胞摄取实验及骨肉瘤裸鼠体内的靶向特性。方法:采用壳聚糖衍生物乙二醇壳聚糖制备双抗体-阿霉素-壳聚糖(Abc-GC-Dox)纳米粒、阿霉素-壳聚糖纳米粒。在体外将药物作用于HER2+裸鼠骨肉瘤细胞系MG-63细胞,研究体外肿瘤细胞摄取实验,并采用免疫荧光的方法对其进行研究;14只骨肉瘤裸鼠随机分为2组,尾静脉注射不同药物,观察裸鼠体内皮下骨肉瘤的靶向分布差异。结果:本实验制得了稳定的双抗体靶向阿霉素纳米粒,包封率为89.73%,载药量为9.96%。通过体内外实验,双抗体纳米靶向药物的靶向聚集浓度明显高于无抗体纳米药物,差异有统计学意义(P<0.05)。结论:本实验成功制备了双抗体靶向阿霉素纳米药物(Abc-GC-Dox),并证明该双抗体纳米粒提高了抗肿瘤药物在骨肉瘤细胞内的靶向分布,明显提高了药物浓度,并降低了药物的不良反应,为临床治疗骨肉瘤提供了一种新的治疗方法。
双抗体联合;阿霉素;乙二醇壳聚糖;纳米粒;靶向治疗;骨肉瘤;裸鼠
近年来,靶向纳米药物治疗已成为肿瘤靶向治疗研究的热点,从20世纪80年代以来,相继出现了生物靶向纳米药物[1]和理化靶向纳米药物[2],如抗体靶向纳米药物、磁性靶向纳米药物等,并在临床上取得了良好的治疗效果[3]。阿霉素(doxorubicin)是一种广谱抗肿瘤抗生素,可抑制肿瘤DNA、RNA和蛋白的合成,对细胞进行杀灭[4]。其抗瘤谱较广,对多种肿瘤均有作用,属细胞周期非特异性药物,对各种生长周期的肿瘤细胞都有杀灭作用,是治疗骨肉瘤的前沿药物。壳聚糖(chitosan)具有良好的生物相容性和生物可降解性[5],近年来逐渐出现在生物医学工程以及药物[6]、基因载体[7]等领域,是良好的纳米载体。HER2蛋白在正常细胞中呈低表达或不表达,但在各类肿瘤细胞中呈高表达,尤其在骨肉瘤中表达率很高,所以HER2蛋白是骨肉瘤治疗的理想靶点。本实验采用抗壳聚糖抗体与抗HER2抗体做成抗体联合体,结合在包埋有阿霉素的乙二醇壳聚糖纳米载体表面,通过生物靶向作用,使抗原抗体特异性结合,将药物靶向输送至骨肉瘤细胞的药物输送体系。此药物靶向体系将成为一种新的药物靶向体系,为骨肉瘤或其他肿瘤的靶向药物输送提供新的方法。
1 材料和方法
1.1 材料
1.1.1 主要试剂:乙二醇壳聚糖、阿霉素、乌头酸酐、乙酸乙酯、1-乙基-(3-二甲基氨基丙基)碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)、透析膜(截留分子量12 000)、抗壳聚糖抗体与抗HER2抗体(Santa Cruz,上海起发生物有限公司)。
1.1.2 实验仪器:倒置共聚焦显微镜(OLYMPUS,日本),自动温控细胞培养箱(Thermo Scientific Form),Olympus OV100小动物显像系统(OLYMPUS,日本)
1.1.3 实验细胞和动物:MG-63细胞(来自于骨肉瘤裸鼠),用于体外细胞摄取实验。14只骨肉瘤裸鼠皆为6~8周龄雌性纯系无胸腺裸鼠,体质量19.44~23.31 g,平均21.31 g,由温州医科大学实验动物中心[SYKZ(浙)2005-0061]提供,用于体内药物的靶向分布检测。将骨肉瘤裸鼠随机分为2组:每组各7只。
1.2 方法
1.2.1 纳米药物的制备:
1.2.1.1 乙二醇壳聚糖(glycol chitosan,GC)纳米粒的制备:取GC溶于蒸馏水中,在恒温磁力搅拌器上以一定转速匀速搅拌3 h,用探头型超声处理器超声2 min(功率60 W),超声时以开5 s,关1 s的脉冲形式进行,处理5次共10 min。后加入不同浓度的三聚磷酸钠(tripolyphosphate,TPP)水溶液10 mL,观察到明显的乳光时立即停止,维持反应30 min,即得到纳米粒子悬浮液。
1.2.1.2 阿霉素包埋的壳聚糖纳米粒(glycol chitosan-doxorubicin,GC-Dox)合成:①顺式乌头酰基Dox的合成(以下步骤需避光进行):13.46 mg乌头酸酐溶于1 mL二氧杂环乙烷中配置成乌头酸酐溶液,Dox(10 mg)溶解于400 μL吡啶中。将乌头酸酐溶液缓慢滴加至Dox溶液中,4 ℃搅拌过夜。5 mL氯仿和5 mL 5%碳酸氢钠溶液洗涤2次,倒掉氯仿,所剩溶液用乙酸乙酯萃取真空干燥,制得顺式乌头酰基Dox。②GC-Dox纳米粒的合成:100 mg GC溶于10 mL蒸馏水,以10 mL甲醇稀释。顺式乌头酰基Dox缓慢加入至GC溶液中,再加入EDC和NHS,室温缓慢搅拌过夜。所得产物以截留分子量12 000透析膜透析,冷冻干燥保存。
1.2.1.3 AbC-GC-Dox纳米粒的制备:制备的GC-Dox纳米粒,在37 ℃水浴条件下,与抗壳聚糖抗体与抗HER2抗体特异性结合,制成AbC-GC-Dox纳米粒。
1.2.2 载药量测定:将初次制备的AbC-GC-Dox纳米粒悬浮液用超滤离心管,4 000 r/min离心分离纳米微粒,在波长480 nm处,以去离子水为空白对照,用紫外可见分光光度计测定上清液中的AbC含量,并按照下列公式计算包封率和载药量。计算公式如下:
载药量=[投药量(MBq)-剩余液体中的药量(MBq)]/纳米微粒质量(g)×100%
包封率=[(投药量(MBq)-剩余液体中的药量(MBq)]/投药量(MBq)×100%
1.2.3 体外释药曲线分析:本实验采用动态透析法测定体外释药曲线:称取不同载药量的含放射性125I纳米粒0.2 g置于透析袋内,分别浸入200 mL PBS缓冲液中,置恒温磁力搅拌仪上37 ℃持续搅拌,分别于0.5、1、2、4、8、24、48 h时吸取20 mL透析液样品,并加入相同体积的PBS缓冲液补足容量。用活度仪分别测定样品的放射性活度,并计算累积药物释放率,绘制累积释放曲线。
1.2.4 体外肿瘤细胞摄取实验:将实验分为2组:GC-Dox纳米粒组作为对照组,AbC-GC-Dox纳米粒组作为实验组。选用HER2+裸鼠骨肉瘤细胞系MG-63细胞作为实验细胞株。使用含10%小牛血清和1%青霉素/链霉素的DMEM培养液培养该细胞。将对照组与实验组药物加入培养板,经过1、3、6 h后收集细胞于免疫荧光显微镜下观测荧光强度。
1.2.5 体内抗肿瘤药物的靶向性研究:用胰酶消化收集MG-63细胞,BPS洗涤并重悬,制成1×107/mL的细胞悬液。6~8周龄雌性纯系无胸腺裸鼠14只,皮下注射0.2 mL,接种前测定裸鼠体质量。动物将在无病原体的条件下饲养。当肿瘤长到0.6~0.7 cm大小的时候(通常接种后7~10 d),将骨肉瘤裸鼠随机分成2组:每组7只。分别给予相应药物,对照组:GC-Dox纳米粒;实验组药物:AbC-GC-Dox纳米粒,由尾静脉注射药物。注射药物后1、6、24 h后,分别将裸鼠在Olympus OV100小动物显像系统进行显像观察。
1.3 统计学处理方法 采用SPSS 19.0统计软件进行统计学分析。计量资料2组间比较采用成组设计资料t检验。P<0.05为差异有统计学意义。
2 结果
2.1 电镜图像 通过本实验制备纳米粒的方法制得的AbC-GC-Dox纳米粒在电镜下观察所得图像见图1。从透射电镜观察其外观为规整的球形,大小稍有差异,分散度较好。

图1 纳米粒的电镜透射照片(×40 000)
2.2 载药量与包埋率 本实验制得的AbC-GC-Dox纳米粒,根据上述实验方法及载药量和包埋率的计算公式,测得本实验的包封率为89.73%,载药量为9.96%。
2.3 累积释放曲线 不同的载药量在8~24 h后的释放趋于平衡,累积释放率为(84.5±1.3)%,载药量越低释效应越轻,达到平衡时间较长(24 h),缓释作用更为明显(见图2)。
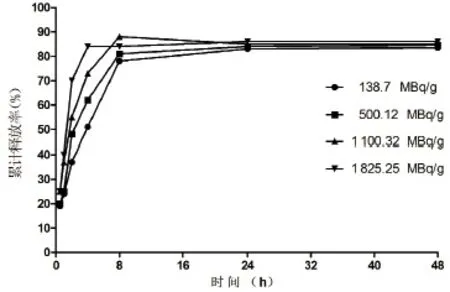
图2 不同载药量纳米粒的累积释放曲线
2.4 体外肿瘤细胞摄取实验与平均摄取量 由体外免疫荧光实验显微镜下观察得知,实验组MG-63细胞摄取纳米粒药物的量随着时间的延长而逐渐增多,且明显强于同一时间点对照组MG-63细胞摄取纳米粒的量(见图3)。进一步通过IPP6.0图片处理软件对图3的图片平均光密度进行分析,结果显示:实验组MG-63细胞摄取平均纳米粒药物的量明显强于同一时间点对照组MG-63细胞平均摄取纳米药物的量(P<0.05)(见图4)。
2.5 纳米粒药物的体内靶向性研究 通过Olympus OV100小动物显像系统对2组裸鼠镜下观察所见:注射药物1、6、24 h后,实验组裸鼠摄取纳米药物的量随着时间的延长而逐渐增多,且明显强于同一时间点对照组裸鼠摄取纳米粒的量(P<0.05)(见图5)。
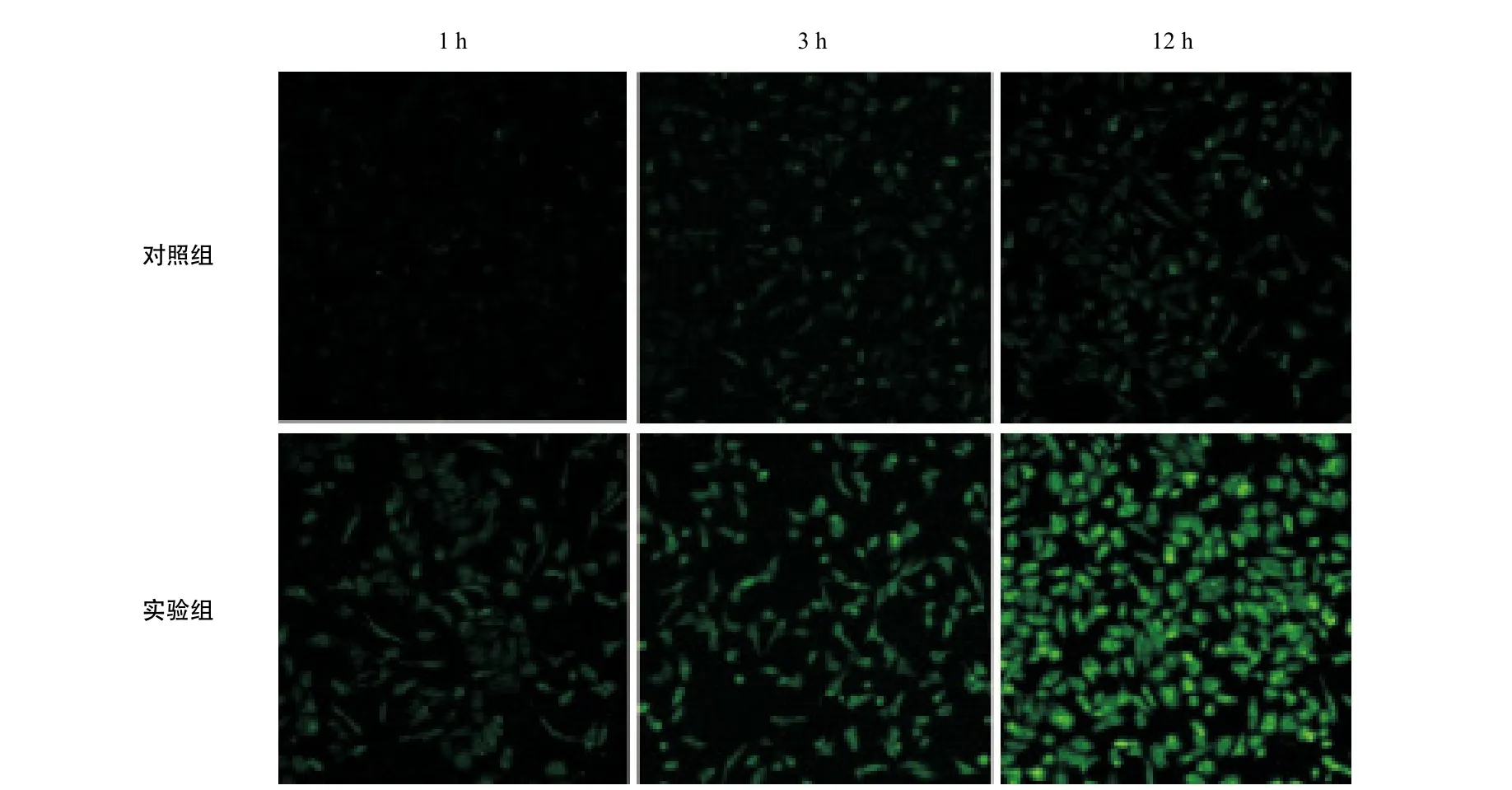
图3 体外肿瘤细胞摄取AbC-GC-Dox纳米粒的免疫荧光图(×200)
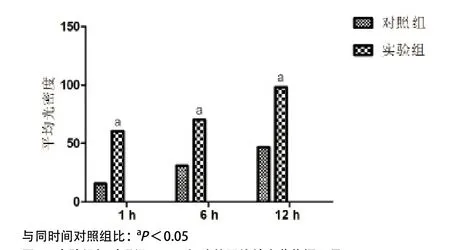
图4 实验组与对照组MG-63细胞的平均纳米药物摄取量
3 讨论
本实验采用的双抗体靶向阿霉素纳米药物,由壳聚糖、双抗体和抗肿瘤药物阿霉素构成。它是以壳聚糖为基质,通过膜透析技术,制备壳聚糖负载阿霉素纳米粒,然后将抗壳聚糖抗体与抗HER2抗体连接于负载阿霉素纳米粒研制而成。此纳米药物是通过抗体联合体靶向输送至骨肉瘤细胞表面,与骨肉瘤细胞表面特异性抗原结合,通过细胞内吞作用,使药物进入骨肉瘤细胞内,达到杀灭肿瘤的治疗作用。此特异性的结合方式,可使药物浓聚于肿瘤靶区,这样既提高了肿瘤靶区的药物浓度,同时也降低了化疗药物的使用量和对正常组织的不良反应[8-9]。到达靶区并被内吞的药物以受控缓释的方式从纳米药物载体中释放,对靶区的细胞予以长期高效的治疗作用。
纳米药物,是以纳米材料作为载体,直径为0.1~100 nm的药物颗粒[10]。载体直径过小不能包埋足量的抗肿瘤药物,过大不能达到靶向治疗的目的。同样药物颗粒的直径也必须是纳米级的,过大不能被载体所包埋。本实验所制得的阿霉素纳米药物的直径为17 nm,具有良好的稳定性,在纳米粒载体中(GC-Dox)Dox包封率为89.73%,载药量为9.96%。
纳米粒是采用乳化聚合的方法制得,将GC溶于水中,并将顺式乌头酰基Dox缓慢加入至GC溶液中,再加入EDC和NHS,即所谓的碳化二亚胺法将抗体联合体与纳米药物连接制成靶向纳米药物。人体生理pH值一般为7.35~7.45,而壳聚糖只溶解于pH值<6.5的溶液,所以我们选择壳聚糖衍生物GC作为纳米粒基质,可溶于pH值范围更广的溶液中。这样所得的溶液具有良好的分散度和稳定性。细胞膜本身带负电荷,容易接近并且吸收带正电荷的物质,所以带正电荷的壳聚糖既具有良好的生物相容性,又具有良好的细胞膜穿透性,且容易被血浆中的溶解酵素降解。再加上抗原抗体结合的特异性,使得实验所制备的AbC-GC-Dox具有分散度好、稳定性好、生物相容性好、细胞穿透性与靶向性强、药物包封率和载药量高、缓释可控及制备方法比较简单等特点。
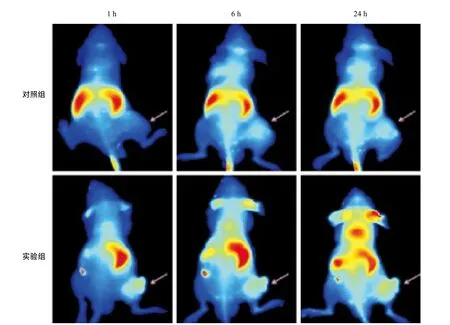
图5 实验组与对照组纳米粒药物的体内靶向性结果(粉色箭头代表皮下肿瘤)
抗体联合体靶向纳米药物在靶向过程中除了需要具备以上特性之外,还需要克服血管内血流对微粒产生的冲击力,当抗原抗体复合物之间的特异性结合力与壳聚糖和细胞膜正负电荷吸引力之和大于毛细血管的线性血流速度时,靶向药物聚集在骨肉瘤靶组织,并被内吞的可能性就增大。本实验采用裸鼠尾静脉注射药物,观察裸鼠体内皮下骨肉瘤的靶向分布差异。通过小动物显像系统观察对照组和实验组,结果表明抗体联合体靶向纳米药物在骨肉瘤靶组织中浓聚效果明显好于未连接抗体联合体的纳米药物,明显提高靶区的阿霉素浓度,并且降低了非靶区的阿霉素浓度,极大减低了化疗过程中的不良反应。
本实验得到了我们预期的结果,这与我们选择的骨肉瘤上的一个特异性的靶点是密不可分的。这就是HER2蛋白,HER2原癌基因编码的HER2蛋白是一种具有酪氨酸激酶活性的跨膜糖蛋白,是人表皮生长因子受体(EGFR)家族成员之一,在细胞传导中发挥重要作用,是细胞增殖、分化和存活的重要调节因子[11]。HER2在正常细胞中低表达或不表达,而在约25%~30%的乳腺癌、卵巢癌和胃癌,以及35%~45%的胰腺癌和高达90%的大肠癌组织中存在HER2的过度表达[12-14]。在骨肉瘤中,该蛋白表达率为60%[15]。因此我们把HER2作为上述肿瘤治疗的特异性靶点,本实验的各项结果验证了我们前期的实验假设,证实了通过抗HER2抗体与HER2蛋白的特异性结合可以大大地提高纳米药物抗肿瘤的靶向特异性,这也是本实验的一个重要创新点。
综上所述,本实验中所使用的抗体联合体靶向纳米药物不仅制备过程简单,而且其具有良好的稳定性、生物相容性、细胞穿透性,最重要的是具有极强的特异性靶向能力。在提高靶向治疗肿瘤的同时,还能降低药物的不良反应。它的这些特性对临床上肿瘤靶向治疗提供了一个新的发展方向,可以进一步推动纳米载体给药系统的发展。
[1] Farokhzad OC, Cheng J, Teply BA, et al. Targeted nanoparticle-aptamer bioconjugates for cancer chemotherapy in vivo [J]. Proc Natl Acad Sci USA, 2006, 103(16): 6315-6320.
[2] Zhang Y, Kohler N, Zhang M. Surface modification of superparamagnetic magnetite nanoparticles and their intracellular uptake[J]. Biomaterials, 2002, 23(7): 1553-1561.
[3] Ambruosi A, Yamamoto H, Kreuter J. Body distribution of polysorbate-80 and doxorubicin-loaded [14C] poly (butyl cyanoacrylate) nanoparticles after i.v. administration in rats [J]. Drug Target, 2005, 13(10): 535-542.
[4] Box VG. The intercalation of DNA double helices with doxorubicin and nogalamycin[J]. Mol Graph Model, 2007, 26(1): 14-19.
[5] 韩涛. 李富荣. 周汉新. 阿霉素纳米粒靶向药物制剂的研究进展[J]. 中国药物与临床, 2004, 4(10): 737-740.
[6] Wang ZH, Wang ZY, Sun CS, et al. Trimethylated chitosanconjugated PLGA nanoparticles for the delivery of drugs to the brain[J]. Biomaterials, 2010, 31(5): 908-915.
[7] Strand SP, Lelu S, Reitan NK, et al. Varum KM. Molecular design of chitosan gene delivery systems with an optimized balance between polyplex stability and polyplex unpacking [J]. Biomaterials, 2010, 31(5): 975-987.
[8] Lee JH, Jung SW, Kim IS. Polymeric nanoparticle composed of fatty acids and poly (ethylene glycol) as a drug carrier[J]. Int J Pharm, 2003, 251(1-2): 23-32.
[9] Moghimi SM, Hunter AC, Murray JC. Long-circulating and target-specific nanoparticles:theory to Particle[J]. Pharmacol Rev, 2001, 53(2): 283-318.
[10] Thrall JH. Nanotechnology and medicine[J]. Radiology, 2004, 230(2): 315-318.
[11] Slamon DJ, Godolphin W, Jones LA, et al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer[J]. Science, 1989, 244(4905): 707-712.
[12] Moasser MM. The oncogene HER2: its signaling and transforming functions and its role in human cancer pathogenesis [J]. Oncogene, 2007, 26(45): 6469-6487.
[13] Verri E, Guglielmini P, Puntoni M, et al. HER2/neu oncoprotein overexpression in epithelial ovarian cancer: evaluation of its prevalence and prognostic significance. Clinical study [J]. Oncology, 2005, 68(2-3): 154-161.
[14] Tsiambas E, Karameris A, Dervenis C, et al. HER2/neu expression and gene alterations in pancreatic ductal adenocarcinoma: a comparative immunohistochemistry and chromogenic in situ hybridization study based on tissue microarrays and computerized image analysis[J]. JOP, 2006, 7(3): 283-294.
[15] Ahmed N, Salsman VS, Yvon E, et al. Immunotherapy for osteosarcoma: genetic modification of T cells overcomes low levels of tumor antigen expression[J]. Mol Ther, 2009, 17 (10): 1779-1787.
(本文编辑:胡苗苗)
Experimental study on the development and targeting effect of nanoparticles of double-antibody complex
and adriamycin loaded
ZHENG Yijing, ZHANG Xiaolei, LIN Yan,WU Yaosen, ZHANG Qiong. Department of Orthopaedics, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective: To synthesize double antibody complex-glycol chitosan doxorubicin nanoparticles (Abc-GC-Dox) and study its targeting effect of osteosarcoma in mice. Methods: Abc-GC-Dox and GC-Dox were prepared by emulsion polymerization method, in vitro immunofluorescence was used to study the intake test of HER2+carried MG-63 cells in Abc-GC-Dox and GC-Dox. Fourteen mice with osteosarcoma were randomly divided into 2 groups. After corresponding treatment, different drugs (Abc-GC-Dox and GC-Dox) were given via tailvein, and the targeting effect was observed. Results: Stable Abc-GC-Dox and the quantity of drug • loading and entrapment were gotten. Compare to GC-Dox, there was a better drug concentration in osteosarcoma in mice, which showed a well targeting effect in vivo. Conclusion: Abc-GC-Dox is successfully developed and the nanoparticles demonstrated targeting aggregating distribution. In future, Abc-GC-Dox can be a potential drug for the clinical treatment of tumors.
double antibody complex; doxorubicin; ethylene glycol chitosan; nanoparticle; targeted therapy; osteosarcoma; nude mice
R730.53
A
10.3969/j.issn.2095-9400.2015.08.001
2015-01-06
浙江省自然科学基金资助项目(Y2110466,Y21104 67);温州市科技局科技计划项目(S20100048)。
郑亦静( 1987-),男,浙江温州人,住院医师,硕士。
林焱,副主任医师,硕士生导师,Email:wzlinyan@ 126.com。
