查尔酮类似物A59促人结肠癌细胞凋亡及其机制
2015-12-27孙余省朱冠保金劲激陶礼钧朱维星方军
孙余省,朱冠保,金劲激,陶礼钧,朱维星,方军
(温州医科大学附属第一医院,浙江 温州 325015,1.创伤外科;2.胃肠外科)
·论 著·
查尔酮类似物A59促人结肠癌细胞凋亡及其机制
孙余省1,朱冠保2,金劲激2,陶礼钧1,朱维星1,方军1
(温州医科大学附属第一医院,浙江 温州 325015,1.创伤外科;2.胃肠外科)
目的:通过对经初步筛选证明具有生物活性的查尔酮类似物A59可能涉及的信号通道进行检测,进一步明确其抗肿瘤活性及作用机制。方法:对于以查尔酮为先导物设计合成类似物,以MTT法检测其对于人结肠癌细胞(HCT-116)的杀伤作用,筛选出具有较好生物活性的化合物A59。通过FCM法检测A59诱导HCT-116细胞凋亡和抑制细胞周期的情况。Western blot法检测HCT-116细胞中A59对ATF4及CHOP表达的影响。利用siRNA技术敲除CHOP后,用免疫荧光和FCM法检测在A59对于细胞凋亡的影响。结果:通过对自行设计合成查尔酮类似物进行筛选,发现A59对于HCT-116具有较强的增殖抑制作用(IC50=7.6 μmol/L)。通过FCM法检测发现A59是通过诱导HCT-116细胞发生凋亡并抑制细胞周期发挥其生物活性。通过Western blot法检测发现A59剂量依赖性激活内质网应激信号通路中的关键蛋白CHOP,并通过siRNA基因沉默技术进一步确证A59是通过刺激CHOP的过表达发挥促进细胞凋亡的作用。结论:查尔酮类似物A59通过激活内质网应激信号通道中的关键蛋白CHOP来发挥对CHT116的增殖抑制作用。
查尔酮类似物;肿瘤药;细胞凋亡; CHOP
结肠癌是常见的恶性肿瘤,其发病率和病死率呈明显上升趋势[1]。虽然手术切除在癌症治疗中发挥着重要作用,但化疗仍然是肿瘤治疗的主要手段之一。目前部分化疗药物的不良反应大且耐受性差局限了其在部分患者中的使用,而一些传统天然药物中的化合物体现出了不良反应小,抗肿瘤能力强的特点[2]。
查尔酮及其衍生物是芳香醛酮发生交叉羟醛缩合的产物,广泛存在于天然药物中,其分子结构柔性大,能与不同的抗体结合,具有毒性低、较好的抗肿瘤、清除氧自由基、抗菌等生物活性[3-7]。但查尔酮虽然有抗癌活性,但活性并不理想。迄今为止虽有多种查尔酮类化合物运用于临床,如利胆药甲氧查尔酮、治疗静脉曲张的橙皮苷甲基查尔酮等,但鲜有成药用于肿瘤的相关治疗[8]。为了发现抗肿瘤效果更佳的查尔酮类似物,本研究以查尔酮为母核设计合成化合物A59,通过MTT法检测A59抗结肠癌的活性,为A59是否能成为治疗结肠癌的新型药物提供实验基础。
1 材料和方法
1.1 材料和试剂 结肠癌细胞株(HCT-116)、HL7702人肝细胞株购自中科院细胞生物学研究所上海细胞库,CLEAVED-PARP抗体、CHOP免疫荧光二抗、辣根过氧化物酶(HRP)标记的抗兔抗体购自美国santa cruz公司,Cleaved-caspase3、GAPDH、CHOP抗体购自美国Cell Signaling Technology公司,Bcl-2、Bad、MDM2、CDC2、Cyclinb1、ATF4抗体购自美国SANTA公司,胎牛血清(无支原体)购自杭州四季青生物工程材料有限公司,RPMI-1640培养基购自美国HyClone公司,青-链霉素(100×)购自吉诺生物医药科技有限公司,0.25%胰蛋白酶(含EDTA)购自美国HyClone公司,0.25%胰蛋白酶(不含EDTA)购自美国Gibco公司,锥虫蓝购自上海生科生物有限公司,MTT试剂盒购自Roche公司。
1.2 HCT-116细胞培养 结肠癌细胞株HCT-116用含有10%无支原体胎牛血清(经56 ℃水浴锅30 min灭活)和1%青-链霉素的RPMI-1640培养基于37 ℃,湿度饱和,含5% CO2的细胞培养箱中培养。
1.3 MTT比色实验 将状态良好的HCT-26细胞铺板,每孔加入不同浓度的H175(0.625、1.25、2.5、5、10、20、40 μmol/L),并设置DMSO阴性对照和查尔酮阳性对照,所有标本重复3孔检测,轻轻混匀以确保每个药都已加入液面以下,48 h后每孔加入10 μL MTT进行反应,4 h后每孔加入200 μL裂解液,使反应产物完全溶解,16 h后置酶标仪上测定每反应孔的A值,波长为570 nm。MTT法检测其对CT26结肠癌细胞的增殖抑制作用,计算出IC50值。
1.4 流式细胞术Annexin V/PI双染法检测细胞凋亡 将处于对数期的HCT-116细胞调整至4×105/mL,进行药物处理,每个培养皿里加入3 μL的不同浓度A59(2.5、5、10 μmol/L),并设置DMSO阴性对照和查尔酮阳性对照,所有标本重复3孔检测,轻轻混匀。加药12 h后收集细胞,用PBS洗2遍后,用不含EDTA的胰酶消化细胞,1 000 r/min离心5 min,弃上清,1 mL PBS重悬细胞,计数,1 000 r/min离心5 min,弃上清用1×Binding Buffer重悬,避光后加1 μL Annexin V染色10 min后,加1 μL PI染色5 min,加400 μL×Binding Buffer进行流式细胞仪检测。
1.5 流式细胞术PI单染法检测细胞周期 将处于对数期的HCT-116细胞进行药物处理,每个培养皿里加入3 μL的不同浓度(2.5、5、10 μmol/L)A59,并设置DMSO阴性对照、查尔酮阳性对照,浓度为10 μmol/L。加药12 h后收集细胞用PBS洗2遍,弃上清,1 mL PBS重悬细胞,用100 g/mL RNase-A和100 g/mL PI各500 μL,37 ℃避光孵育30 min后进行流式细胞仪检测。
1.6 细胞Western blot法检测 收集对数期的HCT-116细胞,用不同浓度(2.5、5、10 μmol/L)A59、DMSO(阴性对照)及查尔酮(阳性对照)进行处理,药物孵育24 h后收集蛋白样品,经SDS-PAGE分析,转至PVDF膜上,5%脱脂牛奶37 ℃封闭1 h,用一抗为凋亡相关蛋白抗体(1∶300 CLEAVED-PARP抗体、1∶1 000 Cleaved-caspase3抗体、1∶300 Bcl-2、Bad抗体)、细胞周期相关蛋白抗体(1∶300 MDM2、CDC2、Cyclinb1抗体)及内质网通路关键蛋白抗体(1∶1 000 CHOP抗体、1∶300 AFT-4、1∶1 000 GAPDH抗体)分别于4 ℃过夜,TBST洗膜后加二抗为抗兔抗体,37 ℃孵育1 h,TBST洗膜后进行曝光。
1.7 HCT-116细胞CHOP基因敲除 通过siRNA靶向设计,美国Ambion公司设计CHOP核苷酸序列5′-GCAG GAAATCGAGCGCCTGAC-3′。经过PCR两步法,人基因组DNA为模板,扩增hU6snRNA启动子序列,外加终结子克隆到PGL3.7载体中,并用增强型绿色荧光蛋白(EGFP)做标记,经过酶切和DNA测序证明其序列的正确性。通过Fugene 6转染法转染到H460细胞中,48 h后,通过显微镜数具有荧光标记的细胞。
1.8 CHOP基因敲除的HCT-116细胞免疫荧光及细胞凋亡检测 将处于对数期的正常HCT-116细胞(NC组)和敲除CHOP基因的HCT-116细胞(CHOP siRNA,siRNA组)调整至4×105/mL,并在正常HCT-116细胞中加入3 μL查尔酮类似物A59(终浓度为20 μmol/ L)处理12 h(NC+A59组),siRNA+A59组处理办法同NC+A59组。于各组中加入一抗为CHOP抗体,二抗为CHOP免疫荧光抗体进行免疫荧光检测;并使用流式细胞术Annexin V/PI双染法对CHOP基因敲除HCT-116细胞进行凋亡检测。
1.9 统计学处理方法 使用SPSS 17.0统计学软件进行统计学分析。采用单因素方差分析各组间的血清抗体OD值的差异。P<0.05为差异有统计学意义。
2 结果
2.1 查尔酮类似物A59的合成及抑制HCT-116细胞增殖 查尔酮类似物A59结构如图1A。MTT结果(见图1B-C)显示:各浓度组的A59均能显著抑制HCT-116细胞,且随着药物浓度增加,对HCT-116细胞抑制效果愈显著,呈剂量依赖性,与阳性对照(查尔酮)比较,差异有统计学意义(P<0.05)。A59对抗结肠癌的IC50为7.6 μmol/L,查尔酮的IC50为13.9 μmol/L;并且A59和查尔酮对正常肝细胞的IC50均大于20 μmol/L,说明其毒性很小。
2.2 A59对HCT-116细胞凋亡的影响 应用不同浓度(5、10 μmol/L)的A59处理HCT-116细胞,均能促进细胞的凋亡,并具有剂量依赖性,与DMSO组比较差异有统计学意义(早期凋亡P=0.0040,晚期凋亡P=0.0028),且促凋亡能力强于阳性对照(查尔酮组)(见图2A),其中以早期凋亡为主(见图2B),具有时间依赖性。为了检测经不同浓度A59处理后的HCT-116细胞中凋亡相关蛋白cleaved-parp、cleavedcaspase3、Bcl-2及Bad的表达水平,分别利用相应抗体进行Western blot法分析,结果(见图2C)提示A59可以剂量依赖性地促进活性PARP以及Caspase3、Bad的表达,同时抑制Bcl-2蛋白的表达。

图1 查尔酮类似物A59的化学结构及对HCT-116增殖的抑制作用
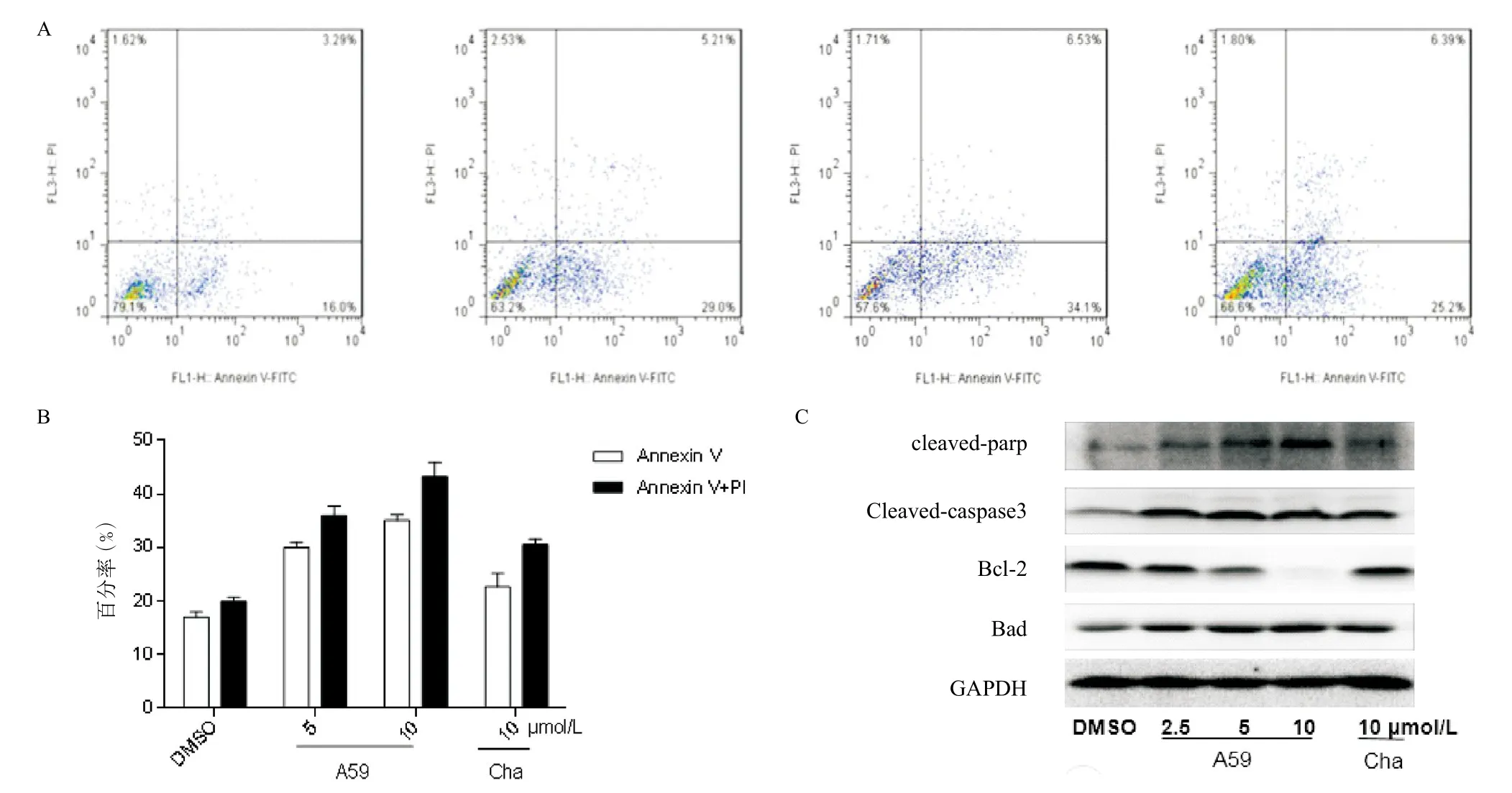
图2 不同浓度A59对HCT-116细胞凋亡的影响
2.3 A59对HCT-116细胞周期的影响 流式细胞术结果(见图3A)显示:HCT-116细胞经A59药物(5、10 μmol/L)处理12 h后,HCT-116细胞增殖阻滞于G2/M期,且具有剂量依赖关系。应用周期相关蛋白抗体进行的Western blot法分析结果(见图3B)提示,A59剂量依赖性地抑制细胞周期蛋白MDM2、CDC2及Cyclinb1。


图3 不同浓度A59对HCT-116细胞周期的影响
2.4 A59对于内质网应激信号通道中关键蛋白的影响 结果(见图4A)显示,A59可引起内质网应激信号通道中关键蛋白ATF-4及CHOP表达转录升高,且随着化合物剂量的上升,ATF-4及CHOP的蛋白表达量明显升高,其中以CHOP蛋白更为显著。用siRNA技术沉默HCT-116细胞中CHOP的表达,之后用不同浓度的A59处理12 h,通过免疫荧光技术进行验证,发现A59可以激活正常HCT-116细胞中CHOP过表达,并在CHOP沉默后无法刺激CHOP过表达,证明成功沉默CHOP(见图4B)。进一步通过流式细胞术Annexin V/PI双染法检测各组细胞凋亡情况(见图4C),发现沉默CHOP后,A59的抗肿瘤作用减弱,说明CHOP在A59介导的细胞凋亡起到了重要的作用。
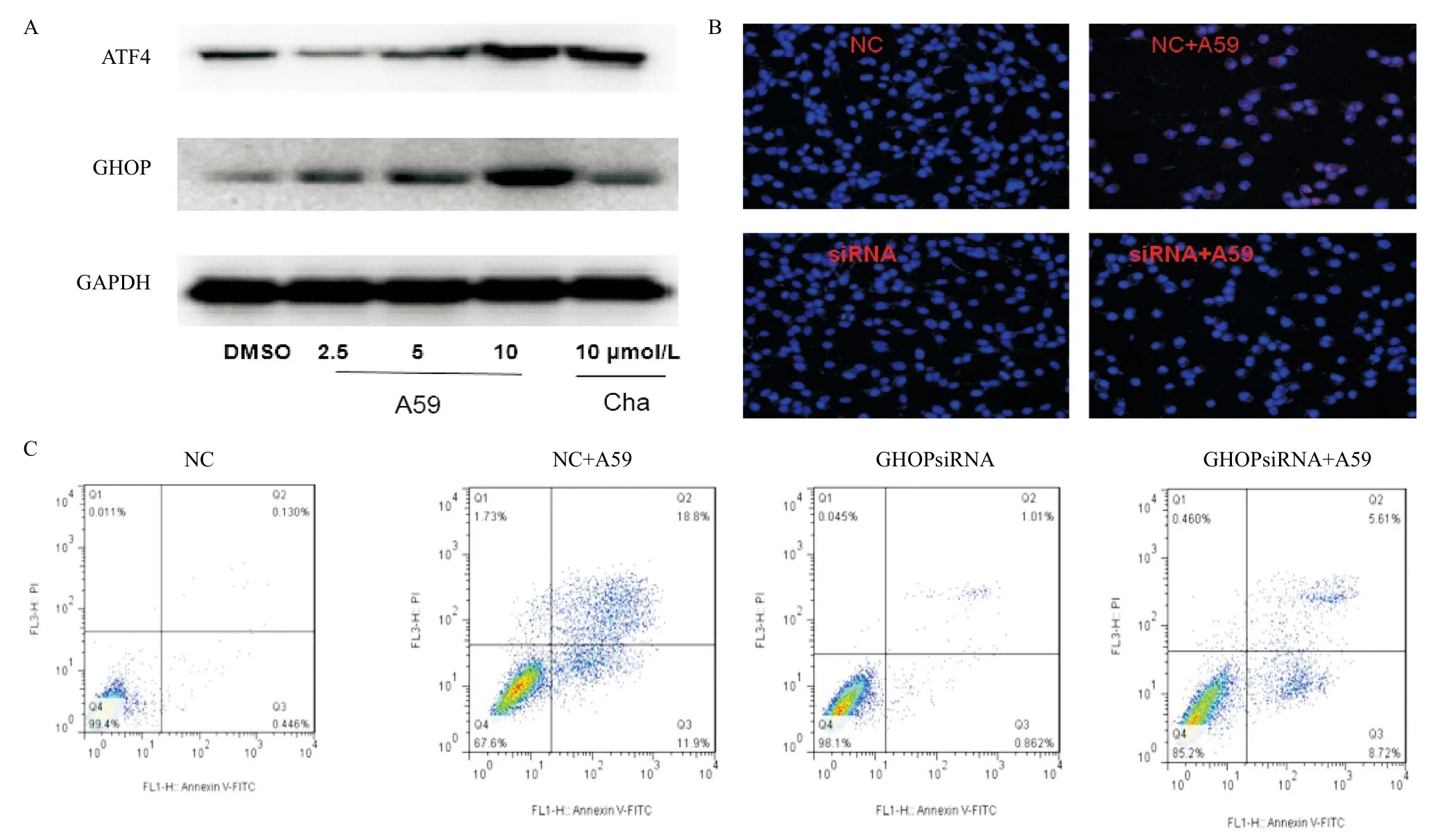
图4 A59对于内质网应激信号通道中关键蛋白的影响
3 讨论
于天然药物及果蔬中广泛存在的查尔酮及其衍生物,除了有抗感染、抗氧化、抗血管等作用外[5-7],亦被发现具有较强的抗肿瘤能力[9]。Syam等[10]研究发现含有硼酸结构的查尔酮类似物抑制乳腺癌细胞株的增殖,Zhou等[11]发现查尔酮类似物有抗前列腺癌活性,亦有研究显示查尔酮类似物对白血病细胞、肝癌细胞、宫颈癌细胞等具有一定的细胞毒性[12-13],但其在结肠癌细胞中的研究非常有限。人结肠癌细胞株HCT-116是以结肠癌患者肿瘤组织为材料所建立的一种恶性结肠癌细胞株,被广泛应用于体内外实验,具有增殖能力强、血清依赖低等优点,故本研究选用HCT-116细胞株在体外进行了查尔酮类似物A59的抗肿瘤能力相关实验。
本实验首先使用不同浓度的A59作用于HCT-116细胞株,发现A59对HCT-116细胞具有明显的生长抑制作用,致细胞生存率下降,且抑制作用强于查尔酮,具有浓度依赖性。并进一步对作用机制进行了研究,使用流式细胞术Annexin V/PI双染法发现A59促进HCT-116细胞凋亡,且凋亡以早期凋亡为主。因为Caspase3是依赖胱天蛋白酶的凋亡途径的重要效应者,PARP被认为是死亡底物及凋亡早期分子标志,而Bcl-2和Bad是目前已知的在凋亡调控过程中功能相互对立的一对调控蛋白[14],因此通过Western blot法检测凋亡相关蛋白,结果提示A59可以剂量依赖性促进活性PARP以及Caspase3、Bad的表达,同时抑制Bcl-2蛋白的表达,已知Bcl-2可抑制凋亡促进细胞存活,故进一步说明了A59促进肿瘤细胞的凋亡。
本实验亦发现A59可抑制HCT-116细胞增殖,使细胞周期阻滞于G2/M期,诱导肿瘤细胞凋亡。已有研究认为肿瘤细胞相较正常细胞多缺失G1/S限制点,致G2/M显得尤为重要,被认为是选择性高、安全性好的药物新靶点[15]。通过Western blot法分析提示A59剂量依赖性抑制细胞周期蛋白MDM2,CDC2及Cyclinb1,而Cyclinb1/CDC2是细胞周期G2/ M限制点的主要调控原件,故进一步明确查尔酮类似物 A59通过阻滞细胞进入G2/M期而抑制HCT-116细胞增殖。
引起凋亡发生的通路有很多,除了经典的死亡受体活化及线粒体损伤传导通路外,研究发现内质网应激反应亦可引起细胞凋亡,被认为是新的细胞凋亡信号传导通路,而CHOP则是内质网应激反应所致凋亡中一个非常重要的介导因素,细胞内CHOP过表达可引起周期阻滞或细胞凋亡[16]。本实验通过CHOP基因敲除对细胞凋亡的影响,发现CHOP介导了A59引起内质网应激时的细胞凋亡过程,亦说明了CHOP在凋亡中发挥了重要作用,而A59通过对CHOP调节抑制肿瘤细胞的生长,被作为肿瘤治疗的特异性靶点。
综上所述,本实验自行设计合成的查尔酮类化合物A59可抑制结肠癌细胞HCT-113细胞生长,阻滞细胞周期进程于G2/M期,诱导细胞凋亡,其机制可能是通过激活内质网应激信号通道中的关键蛋白CHOP而发挥作用。本研究初步揭示了查尔酮类化合物A59抗结肠癌细胞的作用及可能的作用机制,为其进一步开发及临床应用提供理论基础和实验依据。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2] Aggarwal BB, Shishodia S. Molecular targets of dietary agents for prevention and therapy of cancer[J]. Biochem Pharmacol, 2006, 71(10): 1397-1421.
[3] Chen ZH, Zheng CJ, Sun LP, et al. Synthesis of new chalcone derivatives containing a rhodanine-3-acetic acid moiety with potential anti-bacterial activity [J]. Eur J Med Chem, 2010, 45(12): 5739-5743.
[4] Lahsasni SA, Al Korbi FH, Aljaber NA. Synthesis, characterization and evaluation of antioxidant activities of some novel chalcones analogues [J]. Chem Cent J, 2014, 8: 32.
[5] El Sayed Aly MR, Abd El Razek Fodah HH, Saleh SY. Antiobesity, antioxidant and cytotoxicity activities of newly synthesized chalcone derivatives and their metal complexes [J]. Eur J Med Chem, 2014, 76: 517-530.
[6] Kolundzija B, Markovic V, Stanojkovic T, et al. Novel anthraquinone based chalcone analogues containing an imine fragment: synthesis, cytotoxicity and anti-angiogenic activity[J]. Bioorg Med Chem Lett, 2014, 24(1): 65-71.
[7] Bandgar BP, Patil SA, Gacche RN, et al. Synthesis and biological evaluation of nitrogen-containing chalcones as possible anti-inflammatory and antioxidant agents [J]. Bioorg Med Chem Lett, 2010, 20(2): 730-733.
[8] Ducki S. The development of chalcones as promising anticancer agents[J]. IDrugs, 2007, 10(1): 42-46.
[9] 姜集苗, 胡国辉, 左明明, 等. 查儿酮类似物的合成及抗肿瘤活性研究[J]. 化学研究与应用, 2010, 22(11): 1405-1408.
[10] Syam S, Abdelwahab SI, Al-Mamary MA, et al. Synthesis of chalcones with anticancer activities[J]. Molecules, 2012, 17(6): 6179-6195.
[11] Zhou J, Geng G, Batist G, et al. Syntheses and potential antiprostate cancer activities of ionone-based chalcones[J]. Bioorg Med Chem Lett, 2009, 19(4): 1183-1186.
[12] Fang X, Yang B, Cheng Z, et al. Synthesis and antitumor activity of novel nitrogen mustard-linked chalcones[J]. Arch Pharm (Weinheim), 2013, 346(4): 292-299.
[13] Sashidhara KV, Kumar A, Kumar M, et al. Synthesis and in vitro evaluation of novel coumarin-chalcone hybrids as potential anticancer agents [J]. Bioorg Med Chem Lett, 2010, 20(24): 7205-7211.
[14] Rollano Penaloza OM, Lewandowska M, Stetefeld J, et al. Apoptins: selective anticancer agents[J]. Trends Mol Med, 2014, 20(9): 519-528.
[15] Kern MA, Schubert D, Sahi D, et al. Proapoptotic and antiproliferative potential of selective cyclooxygenase-2 inhibitors in human liver tumor cells[J]. Hepatology, 2002, 36(4 Pt 1): 885-894.
[16] Li Y, Guo Y, Tang J, et al. New insights into the roles of CHOP-induced apoptosis in ER stress[J]. Acta Biochim Biophys Sin (Shanghai), 2014, 46(8): 629-40.
(本文编辑:胡苗苗)
Effects and mechanisms of novel chalcone analogue-A59 on inducing colon cancer cells’ apoptosis
SUN Yusheng1, ZHU Guanbao2, JIN Jinji2, TAO Lijun1, ZHU Weixing1, FANG Jun1. 1.Department of Gastroenterological Surgery, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Gastrointestinal Surgery, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To further explore its anti-tumor activity and mechanisms through investigation of the signal path of novel chalcone analogue-A59. Methods: Synthesize the chalcone analogues and further test their cytotoxicity on colon cancer cell line (HCT-116) through MTT method, and pick out the one own better biological activity named A59. The ability of A59 on inducing HCT-116’s apoptosis and inhibiting its cell cycle were assayed using FCM method. The effect of A59 on ATF4 and CHOP expression in HCT-116 were assayed with Western blot. After knockdown CHOP by siRNA technology, the influence of A59 on cell’s apoptosis through immunofluorescence (IF) and FCM was further investigated. Results: A59 showed inhibitory effects on the proliferation of HCT-116 (IC50=7.6 μm). This novel chalcone analogue exerted its biological activity to induce HCT-116’s apoptosis and inhibit its cell cycle through FCM testing, and the Western blot assay indicated that A59 showed a dose-dependent activation of key protein CHOP of endocytoplasmic reticulum stress (ERS) signal path. and the siRNA technology further confirmed A59 induce apoptosis by stimulating the CHOP overexpression. Conclusion: Novel chalcone analogue-A59 shows inhibitory effects on the proliferation of HCT-116 by activating the ERS signal path’s key protein CHOP. Clarifies its mechanisms and shows the significance on the new anti-colon cancer drug research and development.
chalcone analogue; anti-cancer drug; cell apoptosis; CHOP
R730.5
A
10.3969/j.issn.2095-9400.2015.06.007
2015-01-09
孙余省(1970-),男,浙江温州人,副主任医师,硕士。
朱冠保,教授,硕士生导师,Email:zgbwmc@yahoo. com.cn。
