新疆药桑中稀有黄酮桑根酮M的分离鉴定及其抗氧化活性分析
2015-12-26谷少伟左少纯黄先智
向 伟,喻 艳,刘 静,谷少伟,徐 立,*,左少纯,黄先智,蒲 彬
(1.西南大学生物技术学院,重庆 400716;2.新疆维吾尔自治区和田蚕桑科学研究所,新疆 和田 848000)
新疆药桑中稀有黄酮桑根酮M的分离鉴定及其抗氧化活性分析
向 伟1,喻 艳1,刘 静1,谷少伟1,徐 立1,*,左少纯2,黄先智1,蒲 彬2
(1.西南大学生物技术学院,重庆 400716;2.新疆维吾尔自治区和田蚕桑科学研究所,新疆 和田 848000)
经70%乙醇冷浸提取、不同溶剂萃取,在清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基活性跟踪下,通过多次柱层析及薄层层析(thin layer chromatography,TLC),从药桑枝条中分离得到一种稀有黄酮类化合物,经波谱鉴定、结构分析确定其为桑根酮M(sanggenon M)。以人工合成的抗氧化剂二丁基羟基甲苯(butylated hydroxytoluene,BHT)为对照进行抗氧化活性实验,结果表明桑根酮M具有很好的抗氧化活性,其清除DPPH自由基和羟自由基(·OH)的IC50值分别为45.984 mg/L和65.692 mg/L(对照BHT的IC50值分别为64.189、231.556 mg/L),总还原力也明显高于BHT。
药桑枝条;桑根酮M;分离鉴定;黄酮;抗氧化活性
自由基是可以独立存在的,至少包含一个未成对电子的物质,具有高化学反应活性。其在正常细胞代谢中均能产生过量的自由基,能够攻击生物大分子如脂质、蛋白质、核酸等,同衰老及众多疾病的发生密切相关[1-2]。目前各种抗氧化剂的研制已越来越受到人们的重视,而在人工合成抗氧化剂的安全性已受到质疑的情况下,寻找食物源天然抗氧化成分已经成为研究热点[3-4]。
新疆药桑属于黑桑种(Morus nigra L.),作为新疆地区特殊的药食两用桑树品种,其果实桑椹已被开发成多种商品,因其良好的药理活性而深受消费者喜爱[5]。然而目前人们只食用其果实桑椹,大量的药桑枝条却未被充分利用。有研究表明,黑桑茎皮提取物的乙酸乙酯部分具有很好的抗氧化活性[6],本实验以药桑枝条为原料,研究其提取物的抗氧化活性,并与人工合成的抗氧化剂二丁基羟基甲苯(butylated hydroxytoluene,BHT)进行比较,旨在为药桑枝条的开发利用及天然抗氧化成分的发现提供实验基础及理论依据。
1 材料与方法
1.1 材料与试剂
秋季剪伐的新疆药桑枝条,由新疆维吾尔自治区和田蚕桑科学研究所提供。
柱层析硅胶(80~100 目、200~300 目、H硅胶) 青岛海洋化工有限公司;HSGF254薄层层析硅胶板(0.15~0.2 mm) 烟台江友硅胶开发有限公司;Sephadex LH-20 美国Sigma公司;乙醇、石油醚、乙酸乙酯、正丁醇均为工业级 重庆市钛新化工有限公司;氯仿、甲醇、无水乙醇均为分析纯 成都市科龙化工试剂厂;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma-Aldrich公司。
1.2 仪器与设备
DLSB型低温冷却液循环泵、SHZ型循环水真空泵、20 L旋转蒸发仪 巩义市予华仪器有限责任公司;Büchi R-210旋转蒸发仪 瑞士Büchi公司;ARX-600、DRX-500核磁共振仪 德国Bruker公司;Auto Spec 3000质谱仪 英国VG公司;iMark酶标仪 美国Bio-Rad公司;定制层析柱 重庆渝北亚新玻璃厂。
1.3 方法
1.3.1 化合物的分离纯化及结构鉴定
将新疆药桑枝条自然风干,粉碎,用70%乙醇冷浸的方式提取3 次,低温减压条件下浓缩至浸膏状,再分别用石油醚、乙酸乙酯、正丁醇进行萃取并低温减压浓缩。刘静等[7]研究表明,乙酸乙酯萃取部分对DPPH自由基的清除能力最强,故取此部分进行分离。将乙酸乙酯萃取部分用80~100 目硅胶拌样后进行硅胶柱层析,层析柱为定制玻璃柱(25 cm×120 cm),用石油醚进行湿法装柱,柱内填充约55 cm高的80~100 目硅胶。分别用石油醚、乙酸乙酯、甲醇进行洗脱,洗脱部分通过薄层层析(thin layer chromatography,TLC)与DPPH自由基清除活性检测相结合的分析方式,再辅以紫外显色、10%硫酸-乙醇显色等,根据相同或相近合并的原则进行归类合并,得到6 个部分。取活性好的第1部分拌80~100 目硅胶,将层析柱(15 cm×130 cm)湿法填充约90 cm高的200~300 目硅胶,以石油醚-乙酸乙酯进行梯度洗脱,利用如上的合并方法和原则得到9 个部分。利用DPPH自由基显色的薄层自显影技术进行活性测定,将得到活性较好的第7部分以80~100 目硅胶拌样后上H硅胶柱,柱子为定制玻璃层析柱(5 cm×60 cm),采用石油醚湿法装柱,柱内填充约40 cm高的H硅胶,以石油醚-乙酸乙酯进行梯度洗脱,洗脱液采用上述合并方法合并,合并后经凝胶层析(Sephadex LH-20,乙酸乙酯柱)反复纯化,之后通过制备TLC进行分离(层析液为石油醚-乙酸乙酯(3∶1,V/V)),回收板上Rf=0.65左右处的黄色斑点硅胶,用甲醇洗脱并蒸干溶剂,最终得到化合物X。以四甲基硅烷(tetramethylsilane,TMS)为内标,对化合物X进行波谱测定及结构解析。
1.3.2 化合物X清除DPPH自由基活性测定
参考周玮婧等[8]的方法,取不同质量浓度样品液2 mL,与2×10-4mmol/L的DPPH甲醇溶液2 mL混合,37 ℃水浴30 min后于515 nm波长处测定其吸光度,对照组以等体积ddH2O代替样品液,空白以等体积甲醇代替DPPH甲醇溶液。以人工合成抗氧化剂BHT为对照,设置3 个重复,按照下式计算化合物X的DPPH自由基清除率。
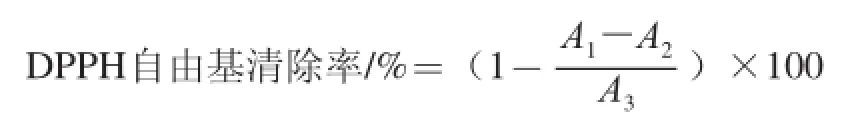
式中:A1为样品组吸光度;A2为空白组吸光度;A3为对照组吸光度。
1.3.3 化合物X清除羟自由基(·OH)活性测定
参考王传宏等[9]的方法,取1.5 mmol/L FeSO4溶液1.5 mL,与6 mmol/L H2O21 mL混合,37 ℃水浴30 min后,加入20 mmol/L水杨酸0.5 mL,同时加不同质量浓度样品液并用70%乙醇补齐至4 mL,再37 ℃水浴30 min,于562 nm波长处测定吸光度,以人工合成抗氧化剂BHT为对照,设置3 个重复。化合物X的·OH清除率按照文献[9]的方法计算。
1.3.4 化合物X总还原力测定
参考刘静等[7]的方法,取100 μL样品液,依次加入pH 6.6的磷酸盐缓冲液和10 g/L的K3Fe(CN)6各1.0 mL,于50 ℃水浴20 min,快速冷却并依次加入10 g/100 mL的三氯乙酸(trichloroacetic acid,TCA)、蒸馏水、1 g/L的氯化铁溶液各1.0 mL,每次添加后均混匀,静置10 min后于700 nm波长处测定其吸光度。以人工合成抗氧化剂BHT为对照,设置3 个重复。
2 结果与分析
2.1 化合物X的理化性质
化合物X为黄绿色黏稠液体,易溶于甲醇、乙酸乙酯,在GF-254硅胶板上用石油醚-乙酸乙酯(3∶1,V/V)进行TLC分析,在Rf=0.75左右有一圆形斑点,该斑点在自然光下呈黄色,在254 nm及364 nm波长处显暗斑,用10%硫酸-乙醇溶液喷洒,高温烘烤后显红褐色,盐酸-镁粉反应呈橙色。由以上结果初步判断化合物X可能为黄酮类化合物。
2.2 化合物X的光谱数据及结构解析
通过电子轰击质谱(electron impact mass spectrometry,EI-MS)得到化合物X的相对分子质量为436,结合其核磁共振(nuclear magnetic resonance,NMR)谱可推断出化合物X的分子式为C25H24O7,结合其理化性质及1H-NMR、13C-NMR、DEPT谱进行结构解析:δH1.51(3H,s,H-17)、1.63(3H,s,H-18)、6.35(1H,d,6,H-14)、5.58(1H,d,6,H-15)信号为一组二甲基苯并吡喃环,其中前两个为端甲基信号,后两个1H、d峰提示为双键所在位置,且此环为二元取代。δH1.42(3H,s,H-12)、1.42(3H,s,H-13)、2.75(1H,dd,6、12,H-9)、3.11(1H,dd,6、12,H-9)、5.20(1H,m,H-10)为一组二甲基烯丙基信号,其中前两个为两个端甲基信号。δH5.74(1H,s,H-6)为黄酮A环质子信号。δH6.47(1H,d,6,H-3’)、6.59(1H,d,12,H-5’)、7.28(1H,s,H-6’)为黄酮B环上3 个H信号。其波谱数据与文献[10-11]的报道基本一致,故最终确定其为桑根酮M(sanggenon M),其波谱数据归属和结构分别如表1和图1所示。

表1 桑根酮M的13C-NMR和1H-NMR谱数据Table 113C-NMR and1H-NMR spectral data of sanggenon M

图1 桑根酮M的结构式Fig.1 Structure of sanggenon M
2.3 桑根酮M的DPPH自由基清除活性
DPPH自由基清除实验被普遍用于物质的抗氧化活性测试中[12],由图2可知,桑根酮M清除DPPH自由基的能力较对照BHT更强,通过统计学软件SPSS 19.0求出其IC50为45.984 mg/L(对照BHT的IC50为64.189 mg/L)。
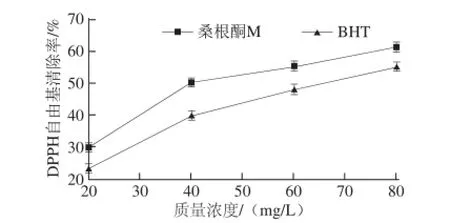
图2 桑根酮M清除DPPH自由基的能力Fig.2 DPPH radical scavenging capacity of sanggenon M
2.4 桑根酮M的·OH清除活性
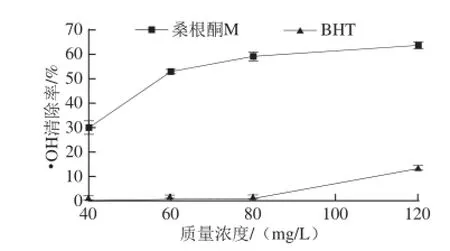
图3 桑根酮M清除·OH的能力Fig.3 Hydroxyl radical scavenging capacity of sanggenon M
·OH是机体内主要的自由基并同众多疾病的发生有关[13-15],如图3所示,桑根酮M对·OH的清除能力显著高于对照BHT,但在60 mg/L(此时的·OH清除率为50%左右)以后,其清除能力随质量浓度的增大变化明显减缓,通过统计学软件SPSS 19.0求出桑根酮M清除·OH的IC50为65.692 mg/L(对照BHT的IC50为231.556 mg/L)。
2.5 桑根酮M的总还原力
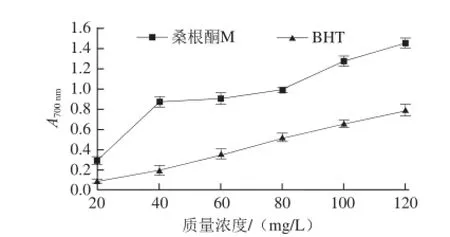
图4 桑根酮M的还原力Fig.4 Reducing power of sanggenonM
还原力是化合物抗氧化能力的重要指标,由图4可知,桑根酮M的总还原力明显强于对照BHT。在20~40 mg/L时,其总还原力随着质量浓度的增大急剧增加,其后有一平缓期,然后再随着质量浓度的增大而有较大变化,这一变化过程的原因还有待进一步分析研究。
3 讨 论
前人对桑根酮类物质的研究主要集中在抗炎[16-18]、降血糖[19]、抗肿瘤[20]等活性方面,所分离得到桑根酮类物质的部位均是桑根[10,18,21-22],本研究从药桑枝条中分离得到该物质,并对其抗氧化活性进行了研究。桑根酮M清除DPPH自由基的能力强于人工合成抗氧化剂BHT,清除·OH能力及总还原能力显著强于后者,这种来源于药食两用桑树材料的化合物在天然抗氧化食品添加剂及保健品领域具有一定的应用前景。新疆的自然环境恶劣,该地区植物具有很强的抗旱能力,有研究报道[23-24]抗氧化能力同植株对严重干旱的耐受能力有一定关系,这可能是该物质存在于药桑这一桑种植物枝条中的原因之一。基于桑树的生理特性,特别是在新疆干旱沙漠地区的生态环境的栽培管理特点决定了药桑根的宝贵性,而桑枝条每年都可剪伐,资源丰富且目前未被利用,因此,在药桑枝条中发现该物质具有重要的现实意义。关于该物质更多的生物活性还有待进一步研究。
[1] YOUNG I S, WOODSIDE J V. Antioxidants in health and disease[J]. Journal of Clinical Pathology, 2001, 54(3): 176-186.
[2] JAZAYERI A. The importance of antioxidants with the marine origin in inhibit free radicals[J]. Life Science Journal-Acta Zhengzhou University Overseas Edition, 2012, 9(2): 1128-1132.
[3] NACZK M, SHAHIDI F. Phenolics in cereals, fruits and vegetables: occurrence, extraction and analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 41(5): 1523-1542.
[4] NETZEL M, NETZEL G, TIAN Q G, et al. Native Australian fruits: a novel source of antioxidants for food[J]. Innovative Food Science & Emerging Technologies, 2007, 8(3): 339-346.
[5] 卢红, 丁天龙, 吴曙光, 等. 新疆药桑的药用价值及在维吾尔医药中的应用[J]. 蚕业科学, 2011, 37(6): 1098-1101.
[6] WANG Lei, YANG Yan, LIU Chao, et al. Three new compounds from Morus nigra L.[J]. Journal of Asian Natural Products Research, 2010, 12(6): 431-437.
[7] 刘静, 刘超, 王传宏, 等. 新疆药桑枝条醇提物不同溶剂萃取组分的抗氧化活性物质含量及抗氧化活性测试[J]. 蚕业科学, 2013, 39(5): 978-983.
[8] 周玮婧, 隋勇, 孙智达, 等. 荔枝皮原花青素与VC、VE的协同抗氧化研究[J]. 食品科学, 2012, 33(3): 5-8.
[9] 王传宏, 刘超, 刘静, 等. 新疆药用植物黑桑的抗氧化性[J]. 林业科学, 2014, 50(8): 53-59.
[10] HANO Y, ITOH M, KOYAMA N, et al. Constituents of the Chinese crude drug Sāng-Bái-Pí (Morus root bark). V: structures of three new flavanones, sanggenons L, M, and N[J]. Heterocycles, 1984, 22(8): 1791-1800.
[11] NOMURA T, FUKAI T, HANO Y. Constituents of the Chinese crude drug “Sang-Bai-Pi” (Morus root bark)[J]. Planta Medica, 1983, 47(1): 30-34.
[12] DAWIDOWICZ A L, WIANOWSKA D, OLSZOWY M. On practical problems in estimation of antioxidant activity of compounds by DPPH center dot method (problems in estimation of antioxidant activity)[J]. Food Chemistry, 2012, 131(3): 1037-1043.
[13] MAURIZI C P. Alzheimer’s disease: roles for mitochondrial damage, the hydroxyl radical, and cerebrospinal fluid deficiency of melatonin[J]. Medical Hypotheses, 2001, 57(2): 156-160.
[14] PANDEY M, BORAH A, VARGHESE M, et al. Striatal dopamine level contributes to hydroxyl radical generation and subsequent neurodegeneration in the striatum in 3-nitropropionic acid-induced Huntington’s disease in rats[J]. Neurochemistry International, 2009, 55(6): 431-437.
[15] PENNATHUR S, WAGNER J D, LEEUWENBURGH C, et al. A hydroxyl radical-like species oxidizes cynomolgus monkey artery wall proteins in early diabetic vascular disease[J]. Journal of Clinical Investigation, 2001, 107(7): 853-860.
[16] CHEON B S, KIM Y H, SON K S, et al. Effects of prenylated flavonoids and biflavonoids on lipopolysaccharide-induced nitric oxide production from the mouse macrophage cell line RAW 264.7[J]. Planta Medica, 2000, 66(7): 596-600.
[17] DAT N T, PHUNG T, LE T, et al. Sanggenon C and O inhibit NO production, iNOS expression and NF-κB activation in LPS-induced RAW264.7 cells[J]. Immunopharmacology and Immunotoxicology, 2012, 34(1): 84-88.
[18] ZELOVA H, HANAKOVA Z, CERMAKOVA Z, et al. Evaluation of anti-inflammatory activity of prenylated substances isolated from Morus alba and Morus nigra[J]. Journal of Natural Products, 2014, 77(6): 1297-1303.
[19] CUI L, NA M K, OH M, et al. Protein tyrosine phosphatase 1B inhibitors from Morus root bark[J]. Bioorganic & Medicinal Chemistry Letters, 2006, 16(5): 1426-1429.
[20] HUANG Hongbiao, LIU Ningning, ZHAO Kai, et al. Sanggenon C decreases tumor cell viability associated with proteasome inhibition[J]. Frontiers in Bioscience, 2011, 3: 1315-1325.
[21] SHI Y Q, FUKAI T, NOMURA T. Structure of sanggenon O, a dielsalder type adduct derived from a chalcone and a dehydroprenylated sanggenon-type flavanone from Morus cathayana[J]. Heterocycles, 2001, 54(2): 639-646.
[22] HANO Y, NOMURA T. Constituents of the Chinese crude drug“Sang-Bai-Pi” (Morus root barks). IV: structures of four new flavonoids, sanggenon H, I, J and K[J]. Heterocycles, 1983, 20(6): 1071-1076.
[23] LIU Changcheng, LIU Yuguo, GUO Ke, et al. Effect of drought on pigments, osmotic adjustment and antioxidant enzymes in six woody plant species in karst habitats of Southwestern China[J]. Environmental and Experimental Botany, 2011, 71(2): 174-183.
[24] WANG Shuncai, LIANG Dong, LI Chao, et al. Influence of drought stress on the cellular ultrastructure and antioxidant system in leaves of drought-tolerant and drought-sensitive apple rootstocks[J]. Plant Physiology and Biochemistry, 2012, 51: 81-89.
Separation, Identification and Antioxidant Activity of Rare Flavonoid Sanggenon M in Black Mulberry Grown in Xinjiang
XIANG Wei1, YU Yan1, LIU Jing1, GU Shaowei1, XU Li1,*, ZUO Shaochun2, HUANG Xianzhi1, PU Bin2
(1. College of Biotechnology, Southwest University, Chongqing 400716, China; 2. Hetian Sericultural Research Institute of Xinjiang Uygur Autonomous Region, Hetian 848000, China)
A rare flavonoid compound was obtained from black mulberry branches through extraction with 70% cold ethanol, fractionation by organic solvent extraction, column chromatography and thin-layer chromatography (TLC). The flavonoid was identified as sanggenon M by spectroscopic and structural analysis. Antioxidant activity of sanggenon M was evaluated in comparison with that of the synthetic antioxidant butylated hydroxytoluene (BHT). The IC50of sanggenon M for scavenging DPPH radical and hydroxyl radicals were 45.984 and 65.692 mg/L, respectively, compared to 64.189 and 231.556 mg/L for BHT. The total reducing power of sanggenon M was obviously higher than that of the control.
black mulberry branch; sanggenon M; separation and identification; flavonoid; antioxidant activity
Q946.8;O629.9
A
1002-6630(2015)21-0037-04
10.7506/spkx1002-6630-201521008
2015-01-13
国家现代农业(蚕桑)产业技术体系建设专项(CARS-22-ZJ0503);中央高校基本科研业务费专项资金项目(XDJK2015C131);重庆市研究生科研创新项目(CYS2015069)
向伟(1989—),男,硕士研究生,主要从事植物化学、桑树病害等方面研究。E-mail:xiangwel@foxmail.com
*通信作者:徐立(1976—),男,副教授,博士,主要从事植物化学研究。E-mail:mulberry@swu.edu.cn
