关于大学化学基础课教材中几个问题的讨论
2015-12-26郭新华
郭新华
(高等教育出版社 北京 100029)
关于大学化学基础课教材中几个问题的讨论
郭新华
(高等教育出版社 北京 100029)
针对现已出版的大学化学基础课教材中存在的一些问题,遴选7个具体的实例,提出解决的方法与建议。
大学化学 诱导效应 银氨溶液 苯胺 自发反应 熵判据 价层电子对 赫斯定律
随着我国高等教育教学改革的不断深化,如何提高本科教育教学质量,大力提升人才的培养水平,成为了教育从业人员需要重点思考并解决的问题。教材作为教学环节中不可或缺的关键元素,承担着固化教学成果、传递知识、体现教育理念等诸多职责。笔者从自身工作的角度出发,在“如何更好地编写大学化学基础课教材”这一命题下,结合7个具体的实例加以具体阐述。
1.烷基的诱导效应
在《有机化学》教材中,普遍认为烷基的诱导效应小于氢原子,具有给电子的诱导效应。但是,由于碳元素的电负性大于氢元素,因此烷基的电负性一定大于氢元素,故此烷基的诱导效应要大于氢元素,烷基具有吸电子的诱导效应。
2.银氨溶液的组成
在《有机化学》教材中,普遍认为银氨溶液的有效成分是[Ag(NH3)2] OH。实际上,这是不正确的。银氨溶液的制备方法是将浓氨水逐渐滴加到AgNO3溶液中,中间有沉淀生成,继续滴加浓氨水至沉淀溶解完全,所得混合溶液即为银氨溶液。制备银氨溶液的反应方程式为
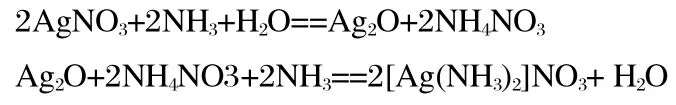
由制备的反应方程式可知银氨溶液的有效成分是[Ag(NH3)2]NO3,而并非是[Ag(NH3)2]OH。
3.苯胺的分子结构
在《有机化学》教材中,认为苯胺分子中的N原子为sp3杂化,苯胺的结构为
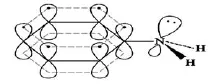
N原子的孤对电子与苯环的π键形成了一个7原子8电子的共轭π键。由于大π键只能由参与成键的原子的p轨道重叠,而N的sp3杂化轨道与苯环的大π键只能产生少部分重叠,形成类似于σ-π的超共轭效应。因此上述苯胺的结构和N原子的杂化方式不能解释氨基(—NH2)为强邻对位定位基及苯胺与苯酚都能与溴水生成三溴取代物沉淀。无机化学和结构化学中认为,苯胺分子中的N原子为sp2杂化,苯胺的结构为
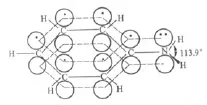
由于形成了一个7原子8电子的大π键,使N原子的给电子共轭效应比吸电子的诱导效应大得多,因此—NH2为强邻对位定位基,并且苯胺和苯酚相似,分子中都存在一个7原子8电子的大π键,均不与溴水生成三溴取代物。
4.自发反应的定义
国内多数教材中对自发反应均定义为不需借助于外力就能进行的反应,并未指明外力是什么,这就导致一些师生产生了误解。例如,会错误地认为碳酸钙在高温下的分解和高温高压下石墨转化为金刚石的反应均为非自发反应,得出这一结论的理由是碳酸钙的分解为吸热反应,该反应需要环境提供热才能进行,而石墨转换为金刚石需要环境提供体积功。实际上,自发反应定义中的外力是指非体积功(如电功和机械功等),但自发反应并不排除体系与环境之间热和体积功的交换。因此,自发反应的定义应改为不需要环境提供非体积功就能进行的化学反应。
5.封闭体系的熵判据
借助于卡诺循环和卡诺定理,推导出热力学第二定律的数学表达式:
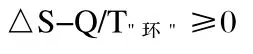
上式适用于封闭体系的任意过程。
对于隔离体系,上式可改写为
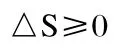
这就是熵判据,仅适用于隔离体系。由于真正的隔离体系并不存在,因此熵判据并无实际意义。
国内教材的通常处理方法是,把封闭体系和环境组成一个新的隔离体系,用总熵变作为过程发生可能性的判据,总熵变等于体系的熵变与环境的熵变之和。总熵变判据为
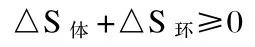
上述处理方法对于部分学生来讲是费解的,为什么要把封闭体系设计成一个实际上并不存在的隔离体系呢?笔者认为,对于封闭体系其实并不需要采用上述处理方法。由热力学第二定律的数学表达式可得封闭体系的判据为
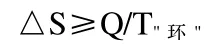
只要比较过程的熵变与过程的热温商的相对大小,就能判断出封闭体系内过程发生的可能性。
6.确定中心原子的价层电子对的经验规则的局限性
在利用价层电子对互斥理论判断以共价键形成的多原子分子或多原子离子的空间构型时,首先要确定中心原子的价层电子对的数量。为了能在不了解分子的结构时,仅根据分子式或离子化学式就能快速、准确地判断出中心原子的价层电子对的数量,科学家总结出一个经验公式和相关的经验规则。确定中心原子的价层电子对数量的经验公式为

利用上式确定中心原子的价层电子对时,可采用下列经验规则:
(1)O原子和S原子为配位原子时不提供电子;
(2)其他原子为配位原子时只提供1个电子;
(3)对于多原子离子,把离子的电荷数看作是中心原子的电荷数;
(4)中心原子有成单电子时,看作是一对电子。
实际上,上述判断多原子分子和多原子离子的经验规则是有局限性的。只有当中心原子与配位原子之间形成大π键和配位键时,上述经验规则才适用。例如,用上述经验规则判断S8分子中S原子的价层电子对为3对,S原子采取sp2杂化;而S原子有4对价层电子对,S原子采取sp3杂化。产生上述错误的原因,是由于S原子之间只形成σ键。
7.关于赫斯定律的应用
有些教材认为,赫斯定律的应用价值不大,对其只进行了简单的介绍。实际上,赫斯定律具有很大的应用价值。在《无机化学》教材中,利用赫斯定律不仅可以根据已知反应的摩尔焓变计算出给定的化学反应的摩尔焓变,还可以根据反应物与生成物的键能、标准摩尔生成焓和标准摩尔燃烧焓计算出反应的摩尔焓变。
将赫斯定律加以推广,如果把几个化学反应乘以系数后相加得到一个总反应,该总反应的摩尔焓变(ΔrHm)等于几个化学反应的摩尔焓变(ΔrHm,i)与系数(ai)乘积的代数和,即
