二氧化碳在深部盐水层中溶解封存规律的研究进展*
2015-12-26于立松张卫东吴双亮任韶然
于立松,张卫东†,吴双亮,王 洁,任韶然,张 亮
(1. 中国石油大学,青岛266580;2. 海工英派尔工程有限公司,青岛 266061)
二氧化碳在深部盐水层中溶解封存规律的研究进展*
于立松1,张卫东1†,吴双亮1,王 洁2,任韶然1,张 亮1
(1. 中国石油大学,青岛266580;2. 海工英派尔工程有限公司,青岛 266061)
将二氧化碳埋存到深部盐水层中是目前缓解温室效应的可行性对策之一,在评价储层理论埋存量时,溶解封存量在总埋存量中占有很大的比例。本文通过对相关文献的调研,计算对比了Duan&Sun模型模拟数据与前人实验数据的误差,根据前人实验与本文模拟数据分析了二氧化碳在盐水层中溶解的动力过程和热力过程,二氧化碳通过扩散作用溶解到盐水中,引起盐水层密度的变化,计算系统瑞利数满足对流运动发生的基本条件后,系统产生对流,这有利于二氧化碳的溶解。分析了温度、压力和矿化度对二氧化碳溶解的影响。在前几百年内溶解缓慢易导致泄漏,低温高压、低矿化度下二氧化碳溶解度较高,小二氧化碳水滴更有利于二氧化碳封存。
二氧化碳;封存;盐水层;溶解度
0 引 言
碳捕获与封存(CCS)技术是减少温室效应的方法之一。以CCS技术埋存的CO2是从发电厂或其它大型CO2释放处捕获的,经过提纯净化、压缩处理后注入到地层深处。一般来说,当注入深度超过800 m时,CO2将处于超临界状态,将更有利于CO2的封存[1]。
CO2在盐水中主要有四种封存方式,分别是构造封存、残余气封存、溶解封存和矿物封存,不论哪种封存,最后都将转化为溶解封存和矿物封存两种永久封存形态,其中矿物封存所占的总封存量很小[2-6]。本文主要探讨CO2的溶解封存机理,研究在地热条件下有多少CO2被溶解及CO2饱和盐水所发生的变化。
1 CO2在盐水中溶解的动力过程
在实际的CCS工程中,CO2埋存在地表800 m以下。在挪威北海油田,将近1×106t/a的CO2被注入到深部盐水层,CO2来自Sleipner Vest气田生产线,注入到Utsira砂岩储层中。Statoil的Sleipner油田在1996年开始将CO2注入到埋存带,与3年后的3D地震勘测结果吻合,在北海水下800 m,由CO2检测器和数值模拟都证实了CO2在向上运移后聚集在盖层的下方[7-9]。
在向上运移的过程中,CO2羽中的CO2将不断溶解到盐水中,溶解有CO2的盐水密度便会增加,在重力的作用下产生对流,溶解了CO2的盐水在水层中的下沉过程将持续几百年至上百万年,其分布形式像粗细不等的手指一样(图1)[16]。以这种方式封存的CO2很安全,但若CO2的溶解过程缓慢,在短期内(最初的几百年)的泄露风险会很高,因为CO2在溶解之前是以自由态存在的。
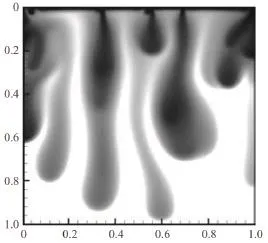
图1 CO2羽体分布图[16](图中纵、横轴是规范化的长度,单位为km的绝对值)Fig. 1 Distribution map of CO2
1.1 分子在盐水层中的扩散
分子的扩散运动在地下水系统中是一个与时间有关的不稳定过程,可用菲克第二定律表示(式(1))。分子扩散的原因是由于存在浓度梯度,分子的扩散可以导致熵增加[10-12]。

CO2在盐水中溶解速度的快慢与CO2气泡形态有很大的关系,尤其是在残余气封存中,小CO2气泡比CO2簇更有利于溶解在盐水中。
CO2的溶解速度公式如下[13]:
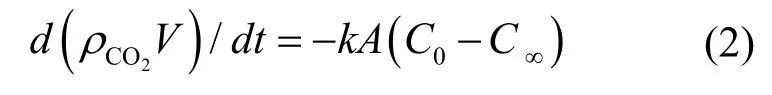
上式中:V为SC-CO2(超临界态的CO2)液滴的体积,m3;A为SC-CO2液滴的表面积,m2;k为传质系数;0C为液滴表面浓度,kg/m3;∞C为盐水层无穷远处浓度或初始浓度,kg/m3。
传质系数k可由下式计算:

1.2 CO2在盐水层中的对流运动
CO2溶解在盐水中会使盐水的密度增大,并在CO2扩散作用下,高密度盐水层的厚度会越来越大,达到一定程度后,盐水内部的压力平衡就会被打破而发生类似于“指进现象”的对流,高密度盐水向下流动,被向上流动的未饱和CO2低密度盐水慢慢稀释,而低密度盐水也会获得接触更多CO2的机会,因此由于密度差引起的盐水对流加速了CO2气体在水中的溶解进程[13]。
盐水能否发生对流现象用瑞利数来表示[14,15]:

其中:K为渗透率,mD;ρΔ为密度差(高CO2浓度与低CO2浓度的密度差),kg/m3;H为水藏深度,m;D为扩散系数,10−9m2/s;φ为孔隙度,小数。
瑞利数是能否发生盐水对流的临界条件,若大于瑞利数便会发生盐水对流,若小于瑞利数则不会发生盐水对流。
在CO2封存条件下,由于CO2溶解在盐水中,可引起盐水密度增大1%,基于Garcia(2001)[21]提出的公式,Özgür(2006)[28]总结了由于CO2浓度增大而使盐水密度增大的公式:

其中:ρCO2,brine为溶解CO2的盐水密度,kg/m3;ρbrine为原始盐水密度,kg/m3;YCO2为CO2溶解的质量分数,%;Vm,brine为盐水中CO2的表观摩尔体积,cm3/mol;M为CO2的摩尔质量,kg/mol。
2 CO2在盐水层中溶解的热力过程
CO2注入盐水层后会发生一系列的化学反应,由于水的催化作用,CO2由超临界状态变为液态,气态CO2变为液态CO2与超临界CO2变为液态CO2类似[16-20]。CO2与地层水发生的化学反应分两类,一类为水相组分(离子或分子)之间的化学反应,另一类是岩石矿物的沉淀/溶解反应。
Adamczyk等[17]在标准大气压下研究了水相组分的反应(如表1),发现CO2与水反应生成H2CO3的速度(b的正反应速度)很慢,H2CO3脱水的速度也很慢,脱水速度为Kde=18 s−1。反应c中H2CO3去H+的解离速度为Koff=107s−1,其酸度系数pKa为3.45,而HCO3−与H+结合生成H2CO3的速度为Kon=Koff/Ka,Ka为H2CO3的电离常数(pKa=−logKa)。在50.66 MPa下d的反应速度常数K为5.13×10−11s−1。

表1 碳酸的形成与电离[17]Table 1 Formation and dissociation of carbonic acid
增大压力、降低温度或降低矿化度均可以提高CO2的溶解度,根据夏勒特原理,CO2的浓度增加,反应b向右移动,更多的CO2溶解在水相中,故随着压力的增加,反应c的酸度系数pKa值下降。
当温度在25℃~70℃之间、压力在0.5 MPa~2 MPa之间、矿化度在5×103~105ppm NaCl之间时,所测得的pH值处于2.6~5.16之间[16]。在碎屑岩和碳酸盐岩油气田所测得的pH值在5~5.8之间。油田数据和试验数据不符可能是由于复杂的地球化学缓冲反应造成的。当pH值再次升高时,CO2变为固相,即为矿物反应。
这些矿物反应既有利也有弊,分析如下:
(1)反应可能造成岩石大量溶解,形成很多渗透通道,在碳酸盐层更易发生这种情况。注入的CO2会优先通过这些通道,这些通道又叫做“蚯蚓洞”,若盖层岩石渗透率增大则使泄露风险增大。
(2)主岩大量溶解可破坏岩石的完整性,导致井眼不稳甚至陆地沉降。
(3)地球化学反应生成的矿物质可降低岩石的渗透率,堵塞孔喉,从而导致一系列CO2注入问题,使得CO2无法正常注入和扩散,降低地层的存储能力,甚至产生局部高压,增加泄露危险。
(4)岩石的溶解可增大储层渗透率,提高注入效率,使CCS工程更加经济。
果胶是由α-1,4糖苷键连接的半乳糖醛酸与鼠李糖、阿拉伯糖和半乳糖等中性糖聚合而成的杂多糖,因此,探索提高果胶产量和质量的新方法和新资源,满足我国果胶市场供给是当务之急[29]。由表3可见,目前果胶的提取方法有酸提醇沉法、草酸铵法、碱萃微生物法[30]、酶法、碱法[31]、逆流萃取法、盐析法、离子交换法、树脂萃取法、微波法、超声波法、高压脉冲电场法及复合法等[32-33]。
(5)矿物封存是最安全的CO2封存方式,可将CO2封存数万亿年。
2.1 压力对CO2溶解度的影响
图2显示了CO2的溶解度与压力的关系。图中曲线是在模拟条件温度323 K、NaCl 1 mol/kg下使用Duan&Sun模型计算所得[22,23]。当压力从0.1 MPa增大到10 MPa时,CO2溶解度增大的速度很快,再继续增大压力时,其溶解度增大速度相对比较平缓。图中黑色四方体是由Nighswander等(1989)[24]、Li等(2004)[25]和Kiepe等(2002)[26]的实验测得的3组数据,与理论值相近。
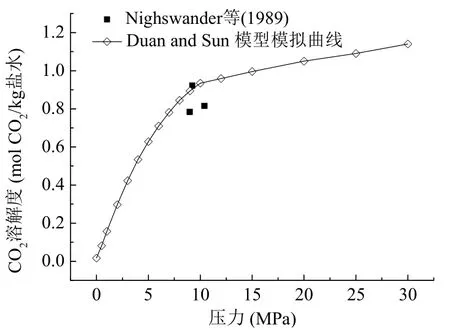
图2 CO2溶解度与压力关系图Fig. 2 CO2solubility increases with pressure increase
2.2 温度对CO2溶解度的影响
图3显示了CO2的溶解度随温度的升高而降低。曲线是模拟条件为压力10 MPa,NaCl为1 mol/kg时使用Duan等模型计算得到的。图中其它散点是前人的实验数据点[16-20,23],部分实验数据条件与曲线模拟条件并不完全相同。
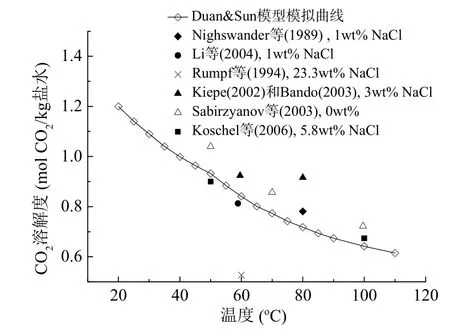
图3 高压下CO2溶解度与温度关系图Fig. 3 CO2solubility versus temperature at high pressures
CO2的溶解度随着矿化度的升高而降低。图4中的曲线是在温度323 K、压力为10 MPa条件下,利用Duan等模型计算所得含盐组分与溶解度的关系,其它散点是前人的实验数据点[13,16-20,23],部分数据点与曲线差别较大是因为其温度与压力条件与曲线模拟条件并不完全相同。

图4 CO2溶解度与矿化度关系图Fig. 4 CO2solubility versus salinity
不同的矿化物对CO2溶解度的影响不同,Yasunishi等[27]对NaCl、KCl、Na2SO4,MgSO4、MgCl2、K2SO4、BaCl2等进行了一系列实验研究。研究表明,在相同浓度下,KCl溶液比NaCl溶液可以溶解更多的CO2,CaCl2和MgCl2溶液溶解CO2的量相差不大。相同浓度下,一价化合物NaCl和KCl能比二价化合物CaCl2和MgCl2溶解更多的CO2。
在温度为298 K~523 K、压力为3.40 MPa~72.41 MPa时,Enick等[13]做了大量实验,根据研究结果,他们得出了在矿化物影响下CO2饱和度的经验公式:
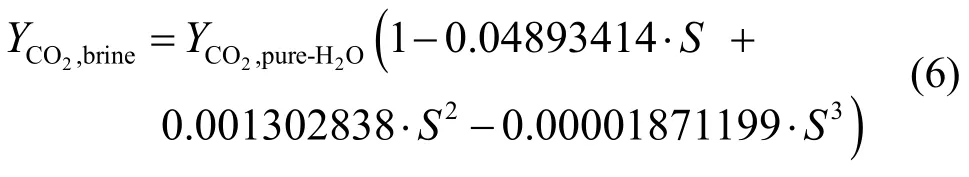
其中,YCO2,brine为CO2在盐水中的溶解度,scf CO2/STB H2O;YCO2,pure-H2O为CO2在纯水中的溶解度,scf CO2/STB H2O;S为盐水矿化度,mol/kg H2O。
2.4 CO2溶解度的理论计算
Duan&Sun模型可以考虑不同矿物离子(如Na+、K+、Ca2+、Mg2+、Cl−、SO42−)[23]对CO2溶解度的影响,使用温度范围为0℃~260℃,压力为 0 MPa~200 MPa,矿化度为0~4 mol NaCl/kgH2O,它主要以液相化学势和气相化学势平衡得到的,经化简和整理得:


上式中,系数ai如表2所示。当压力低于100 MPa,温度在273 K~340 K之间时,将表2中系数代入公式(8)可变为:

CO2在气相中的摩尔分数2COy可由下式求得[22]:



上式中,系数ci可由表3获得。

表2 系数ai的取值[23]Table 2 Values of coefficient ai

表3 系数ci的取值[22]Table 3 Values of coefficient ci
3 结 论
(1)Duan&Sun模型对CO2在盐水中溶解度的计算结果与实际实验数据拟合效果较好,并且该模型可以考虑不同矿物离子对CO2溶解度的影响。
(2)CO2在盐水中的扩散、对流运动有利于CO2的溶解,高渗透力和低孔隙度可以增大瑞利数、易使盐水发生对流现象、可以提高CO2的溶解度,选择CO2的埋存层时应考虑这一点。
(3)溶解度是决定溶解量的关键参数,在低温、高压及低矿化度环境下CO2在盐水中的溶解度较高。
(4)溶解封存的优点是封存CO2的潜力很大,并且在长时间内是安全的;缺点是溶解速度缓慢,短期内CO2是自由态,在浮力的作用下容易泄露。
[1] IPCC. Intergovernmental Panel on Climate Change (IPCC) Special Report-Carbon Dioxide Capture and Storage[R]. 2005.
[2] 罗金铃,高冉,黄文辉,等. 中国二氧化碳减排及利用技术发展趋势[J]. 资源与产业,2011,13(1): 133-136.
[3] 王建秀,吴远斌,于海鹏. 二氧化碳封存技术研究进展[J]. 地下空间与工程学报,2013. 9(1): 81-86.
[4] 景凤江,宋春华. 二氧化碳技术在我国海上气田的应用与思考[J]. 油气藏评价与开发,2011,1(5): 20-22.
[5] 叶斌,叶为民. 地下盐水层封存CO2的研究现状及展望[J]. 科技资讯,2012,(36): 66-68.
[6] 任韶然,张莉,张亮. CO2地质埋存: 国外示范工程及其对中国的启示[J]. 中国石油大学学报(自然科学版),2010,1(34): 94-96.
[7] De Silva P N K,Ranjith P G. A study of methodologies for CO2storage capacity estimation of saline aquifers[J]. Fuel,2012,93: 13-27
[8] Li Y K,Nghiem L X. Phase equilibria of oil,gas and water/brine mixtures from a cubic equation of state and Henry’s Law[J]. The Canadian Journal of Chemical Engineering,1986,64: 486-496.
[9] Harvey A H,Prausnitz J M. Thermodynamics of high-pressure aqueous systems containing gases and salts[J]. American Institute of Chemical Engineers Journal,1989,35(4): 635-644.
[10] 张建,董明国. 海洋封存二氧化碳最佳注入深度与液滴大小[J]. 武汉大学学报(工学版),2012,(6): 828-831.
[11] 杨永智,沈平平,宋新民,等. 盐水层温室气体地质埋存机理及潜力计算方法评价[J]. 科学环境与技术,2009,39(4): 745-747.
[12] 董晓军,于小龙. 相对渗透率模型及应用分析[J]. 内蒙古石油化工,2009,17: 118-119.
[13] Enick,R.M.,Klara,S.M. CO2solubility in water and brine under reservoir conditions[J],Chem. Eng.,1990,90: 22-23.
[14] Horton C W,Rogers F T. Convection Currents in a Porous Medium[J]. Journal of Applied Physics,1945,16(6): 367-370.
[15] Katto Y,Masuoka T. Criterion for the Onset of Convective Flow in a Fluid in a Porous Medium[J]. International Journal of Heat and Mass Transfer,1967. 10(3): 297-309
[16] Riaz A,Hesse M,Tchelepi H A,et al. Onset of convection in a gravitationally unstable diffusive boundary layer in porous media[J]. Journal of Fluid Mechanics,2006,548: 87-111.
[17] Adamczyk K,Premont-Schwarz M,Pines D,et al. Real-time observation of carbonic acid formation in aqueous solution[J]. Science,2009,326: 1690-1694.
[18] Spycher N,Pruess K,King J E. CO2-H2O mixtures in the geological sequestration of CO2. I. Assessment and calculation of mutual solubilities from 12 to 100oC and up to 600 bar[J]. Geochemical et Cosmochimica Acta,2003,67(16): 3015-3031.
[19] Takenouchi S,Kennedy G C. The solubility of carbon dioxide in NaCl solutions at high temperatures and pressures[J]. American Journal of Science,1965,263: 445-454.
[20] Portier S,Rochelle S. Modelling CO2solubility in pure water and NaCl-type waters from 0~300℃ and from1 to 300 bar: Application to the utsira formation at sleipner[J]. Chemical Geology,2005,217: 187-199.
[21] Garcia J E. Density of Aqueous Solutions of CO2[EB/OL]. http://escholarship.org/uc/item/6dn022hb,2001-10-10/2011-04-02.
[22] Duan Z,Sun R. An Improved Model Calculating CO2Solubility in Pure Water and Aqueous NaCl Solutions from 273 to 533 K and from 0 to 2000 bar[J]. Chemical Geology,2003,193: 257-271
[23] Duan Z,Sun R,Zhu C,et al. An Improved Model for the Calculation of CO2Solubility in Aqueous Solutions Containing Na+,K+,Ca2+,Mg2+,C−,and SO42−[J]. Marine Chemistry,2006,98: 131-139.
[24] Nighswander J A,Kaiogerakis N,Mehrotra A K. Solubilities of carbon dioxide in water and 1wt.% NaCl solution atperssures up to 10 MPa and temperatures from 80 to 200[J]. Journal of Chemical and Engineering Data,1989,34(3): 355-360.
[25] Li Z,Dong M,Li S,et al. Densities and solubilities forbinary systems of carbon dioxide plus water and carbon dioxideplus brine at 59 8C and pressures to 29 MPa[J]. J. Chem. Eng. 2004,49: 1026-1031.
[26] Kiepe J,Horstmann S,Fischer K,et al. Experimental determination and prediction of gas solubility data for CO2+H2O mixtures containing NaCl or KCl at temperatures between 313 and 393 K and pressures up to 10 MPa[J]. Ind. Eng. Chem,2002,41: 4393-4398.
[27] Yasunishi A,Yoshida F. Solubility of carbon dioxide inaqueous electrolyte solutions[J]. Chem. Eng.,1979,24: 11-15.
[28] Özgür E. Assessment of diffusive and convective mechanisms during carbon dioxide sequestration into deep saline aquifers[D]. Ankara:Middle East Technical University,2006.
Research on Dissolved Sequestration of CO2in Deep Saline Aquifers
YU Li-song1,ZHANG Wei-dong1,WU Shuang-liang1,WANG Jie2,REN Shao-ran1,ZHANG Liang1
(1. China University of Petroleum,Qingdao 266580,China;2. COOEC-ENPAL,Qingdao 266061,China)
At present,storing CO2into the deep saline aquifers is one of the feasible ways to mitigate the greenhouse effect,when evaluate the reservoir’s theory sequestration,the amount of dissolved sequestration account for a large proportion of the total sequestration. This paper studies the kinetics and thermodynamics of CO2dissolution into saline aquifers by the data of previous experiments and simulation using Model Duan&Sun. The diffusion of CO2into underlying formation waters will increase the density of saline water,we can know whether convection is happening by judging with Rayleigh number,and which is conducive to the dissolution of CO2. This paper also studies the effect of temperature,pressure and salinity on dissolution. The process of dissolution is slowly in the first few hundred years,at which leakage is easy to happen. Low temperature,high pressure and low brine salinity is more conducive to the dissolution of CO2. Small droplets are more benefit for CO2sequestration.
carbon dioxide;sequestration;saline aquifers;solubility
TK09
A
10.3969/j.issn.2095-560X.2015.01.012
2095-560X(2015)01-0075-06
于立松(1990-),男,硕士研究生,主要从事岩石力学与工程、非常规气工程研究。
张卫东(1965-),男,教授,主要从事岩石力学与工程研究,天然气水合物、煤层气等非常规气工程研究。
吴双亮(1988-),男,硕士研究生,主要从事岩石力学与工程、非常规气工程研究。
2014-11-07
2014-12-15
山东省自然科学基金项目(ZR2011EEM027);中国石油大学自主创新项目(27R1202007A)
† 通信作者:张卫东,E-mail:wdzhang@upc.edu.cn
