党参内生菌转化人参根总皂苷为稀有人参皂苷F2和C-K的研究
2015-12-26崔磊金英今尹成日
崔磊, 金英今, 尹成日,*
( 1.延边大学理学院 化学系; 2.延边大学分析测试中心: 吉林 延吉 133002 )
党参内生菌转化人参根总皂苷为稀有人参皂苷F2和C-K的研究
崔磊1, 金英今2, 尹成日1,2*
( 1.延边大学理学院 化学系; 2.延边大学分析测试中心: 吉林 延吉 133002 )
利用组织分离法从党参中分离得到32种内生菌,其中菌株D19转化人参主皂苷为稀有皂苷的活性最强.在最佳发酵条件(水培养基,pH 5.0)下,稀有人参皂苷F2、C-K和Rh1的最高产率分别为30%、17%和8%.根据单体皂苷转化实验确定了稀有人参皂苷的来源和人参皂苷Rb1的转化路径,并通过16S rDNA序列分析,鉴定内生菌D19为藤黄色杆菌属(Dyella).
党参; 稀有人参皂苷; 内生菌; 生物转化
人参(PanaxginsengC.A.Mey)为五加科人参属植物的根,其成分有人参皂苷、多糖、黄酮类化合物、挥发性油等[1],其中人参皂苷为人参属植物的主要活性成分,具有抗肿瘤、抗衰老、软化血管、保肝等作用[2-3].研究表明[4],由于稀有人参皂苷(Rh1、Rh2、F2、C-K等)具有尺寸小、生物利用度高、细胞膜渗透性强等特点,因此比人参主皂苷(Rb1、Rb2、Rc、Rd、Rg1等)具有更好的药理活性.然而,稀有人参皂苷在天然人参属植物中的含量极少,因此将人参主皂苷转化为稀有人参皂苷的研究具有重要的意义[5].近些年,以人参主皂苷为原料进行生物转化的研究取得了许多有意义的成果[6-8],其方法主要有化学法(酸水解、碱水解、Smith降解)和生物法(酶或微生物),其中生物转化法具有特异性高、成本低、反应条件温和、选择性高、环境友好的优点[9-10],被认为是获取稀有人参皂苷的最有效的方法.
植物内生菌(endophytes)是指存活于健康植物组织内部,而又不引发宿主植物表现出明显感染症状的微生物类群,主要包括真菌、细菌和放线菌[11].近年来,内生菌在生物转化上的应用已引起了人们的广泛关注,并已经应用于一些天然化合物的生物合成,如黄烷、四氢呋喃木酚素和黄芪皂苷[12-14].本文首次从含有三萜类成分的党参中分离得到具有人参皂苷生物转化活性的内生菌,并探讨了其转化率及转化路径.
1 材料与方法
1.1 试剂
人参皂苷从成都思科华生物技术有限公司购买,党参从延吉市参茸市场购买,薄层层析板Silica gel 60-F254从德国Merck公司购买,R2A琼脂培养基从Sigma公司购买.化学试剂均为分析纯.
1.2 仪器
实验仪器有:立式电热压力蒸汽灭菌器(LDZX-30KB,上海申安医疗器械);生物安全柜(BSC-1300ⅡA/B3); pH计(雷磁PHS-3C型); PCR仪(TC-512,英国Techne公司);光学显微镜(BX61, 上海比目仪器公司);电子天平(JA5003型,上海良平仪器仪表有限公司);高速离心机(MCD-2000 HSIANGTAI);液相色谱仪(LC-6A,日本岛津);振荡培养箱(HZQ-C,哈尔滨市东联电子技术开发有限公司);高效液相色谱仪(Agilent 1100,美国Agilent公司).
1.3 培养基
马铃薯琼脂培养基(PDA培养基):去皮马铃薯200~300 g,葡萄糖20 g,琼脂粉15 g,去离子水1 L.将去皮马铃薯切成小块,加1 L水煮沸,沸腾30 min后,用纱布过滤,补足1 L水,加入葡萄糖和琼脂粉,搅拌溶解后,分装灭菌.
液体培养基(LL培养基):NH4Cl 0.5 g,K2HPO41.0 g, KH2PO40.5 g, MgSO40.25 g, 酵母粉1.0 g, 蒸馏水1 L, pH 7.0.
1.4 党参内生菌的分离筛选
参照Surette等[15]描述的方法,将新鲜无损的党参在48 h内进行内生菌分离.消毒前,将党参在流动的自来水下充分冲洗,然后按以下顺序进行表面消毒: 70%(体积分数)乙醇1 min, 5%(体积分数)次氯酸钠5~10 min, 70%(体积分数)乙醇1 min,无菌水1 min,洗涤4次.消毒后的样本用干燥无菌滤纸擦干,然后用无菌手术刀去除外部组织,切成0.5 cm×0.5 cm小段,按压在PDA琼脂平板、R2A琼脂平板和LB琼脂平板上,于30 ℃恒温培养箱中培养5~7 d.
在培养期间,基于菌落的形态学特征和外貌形态,分离不同菌落,经反复多次得到单一菌株.利用七叶苷显色原理[8],把单一菌株涂在由七叶苷(Esuclin)修饰的R2A琼脂(E-R2A)培养基上培养,观察培养基的颜色变化(变黑),筛选出产β-葡萄糖苷酶的菌株.七叶苷修饰的R2A琼脂培养基成分为: R2A琼脂15.2 g,七叶苷1.0 g,柠檬酸铁0.5 g.
1.5 人参根总皂苷的微生物转化
在1.5 mL离心管内加入270 μL无菌液体培养基和30 μL 20 mg/mL的人参根总皂苷,然后接种300 μL产β-葡萄糖苷酶的菌株培养液;培养7 d后,加入600 μL饱和正丁醇液终止反应,高速离心后取上清液进行TLC和HPLC分析,筛选出具有人参皂苷生物转化活性的菌株.
1.6 人参根总皂苷发酵条件的优化
为了得到较高产量的稀有人参皂苷,对生物转化条件进行优化.选取6种不同的培养基:水、R2A、PDB、LB、NB、LL, pH值7.0,以20 mg/mL的人参根总皂苷为底物,30 ℃空气振荡浴中培养7 d后,加入等体积饱和正丁醇终止反应,离心后用于TLC分析,以此确定活性菌株的最适培养基.在最优培养基条件下,对生物转化的pH条件进行优化,起始pH值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0, 后续处理同上.
在最适培养基和pH值条件下,利用高效菌株D19对人参根总皂苷进行微生物转化,并用HPLC分析人参皂苷含量的变化.
1.7 内生菌D19对单体皂苷的生物转化
分别以灭菌后的1 mg/mL单体人参皂苷Rb1、Rb2、Rc、Rd和Rg1为底物,于内生菌D19的菌悬液中进行微生物转化实验;在30 ℃,160 r/min空气浴恒温振荡器中发酵7 d,每隔一定时间用饱和正丁醇终止反应,然后进行TLC和HPLC分析.
1.8 内生菌D19的DNA提取、PCR扩增及克隆测序
在光学显微镜下观察内生菌D19的微观形态.采用氯化苄法提取内生菌D19基因组总DNA,先用引物27F(5′-AGA GTT TGA TCC TGG CTC AG -3′)和1492R(5′-GGT TAC CTT GTT ACG ACT T-3′)进行PCR扩增[16].PCR反应体系(20 μL)为: dNTPs 2 μL, 10×PCR缓冲液(Mg2+) 2 μL,引物各2 μL, DNA模板2 μL,超纯水10 μL.PCR扩增程序为:首先在95 ℃预变性3 min; 然后在95 ℃变性30 s, 在56 ℃退火30 s, 在72 ℃延伸90 s,进行30个循环;最后在72 ℃延伸7 min.PCR产物切胶回收,将目的片段与载体pMD -18T连接后转入感受态细胞(JM109),在LB平板(含氨苄)上进行蓝白斑筛选;挑取白斑在液体培养基中进行摇菌,然后用M13引物(T载体上的测序引物)进行菌液PCR,最后送上海生工生物工程技术服务有限公司进行测序.
将测得的基因序列通过Blast程序与GenBank中核酸数据库进行对比分析(http://www.ncbi.nlm.nih.gov/blast),其中相似的序列进行多重匹配排列分析(clustalx 1.83),然后用Mega 4.0[17]分析软件中的Neighbor Joining方法构建系统发育树.
1.9 TLC法测定人参皂苷
TLC展开剂为氯仿-甲醇-水(体积比为10∶5∶1),展开后用10%硫酸乙醇溶液显色,并与标准品Rf值比对,以此初步判断样品中是否有稀有人参皂苷的生成.
1.10 HPLC法测定人参皂苷
高效液相色谱仪HP 1100, UV检测器,色谱柱采用BDS HYPERSIL C18 (250 mm×4.6 mm),检测波长为203 nm,流速为1.0 mL/min,柱温25 ℃,流动相为水(A)-乙腈(B)溶液,梯度洗脱,条件如表1.

表1 高效液相色谱梯度洗脱条件
2 结果与讨论
2.1 党参内生菌的分离筛选
从党参中共分离得到32种内生菌,筛选出15种产β-葡萄糖苷酶的内生菌,其中内生菌D19显示出较好的人参皂苷生物转化活性.由图1可以看出,菌株D19菌体呈油状(黄色)、有隆起,为细菌形态特征.

图1 内生菌D19在PDA培养基上的生长特性
2.2 发酵条件对人参根总皂苷生物转化的影响
通过人参皂苷活性筛选实验,发现内生菌D19能够有效地将人参根总皂苷转化为稀有人参皂苷F2、C-K和Rh1.为了得到较高产率的稀有人参皂苷,探讨培养基、pH值对内生菌D19转化人参根总皂苷的影响,确定最佳生物反应条件.
由图2可知,当水为培养基时内生菌D19能有效地将人参根总皂苷中的主皂苷转化为稀有人参皂苷F2和C-K,而培养基为R2A和PDB时,仍有较多未转化的人参主皂苷Rb1,因此本文选择水为最适培养基.
由图3可知,在最适培养基中,菌株在整个pH值范围内对主皂苷Rb1、Rb2和Rc均有较好的转化能力,在3.0~7.0 pH值范围内都能产生稀有人参皂苷F2和C-K,其中pH值为5.0时转化效果最好,因此本文选择pH 5.0为最适pH值.

图2 内生菌D19在不同培养基中转化人参根总皂苷的TLC图 (1为水; 2为R2A; 3为PDB; 4为LB; 5为NB; 6为LL; S1、S2为标准品)
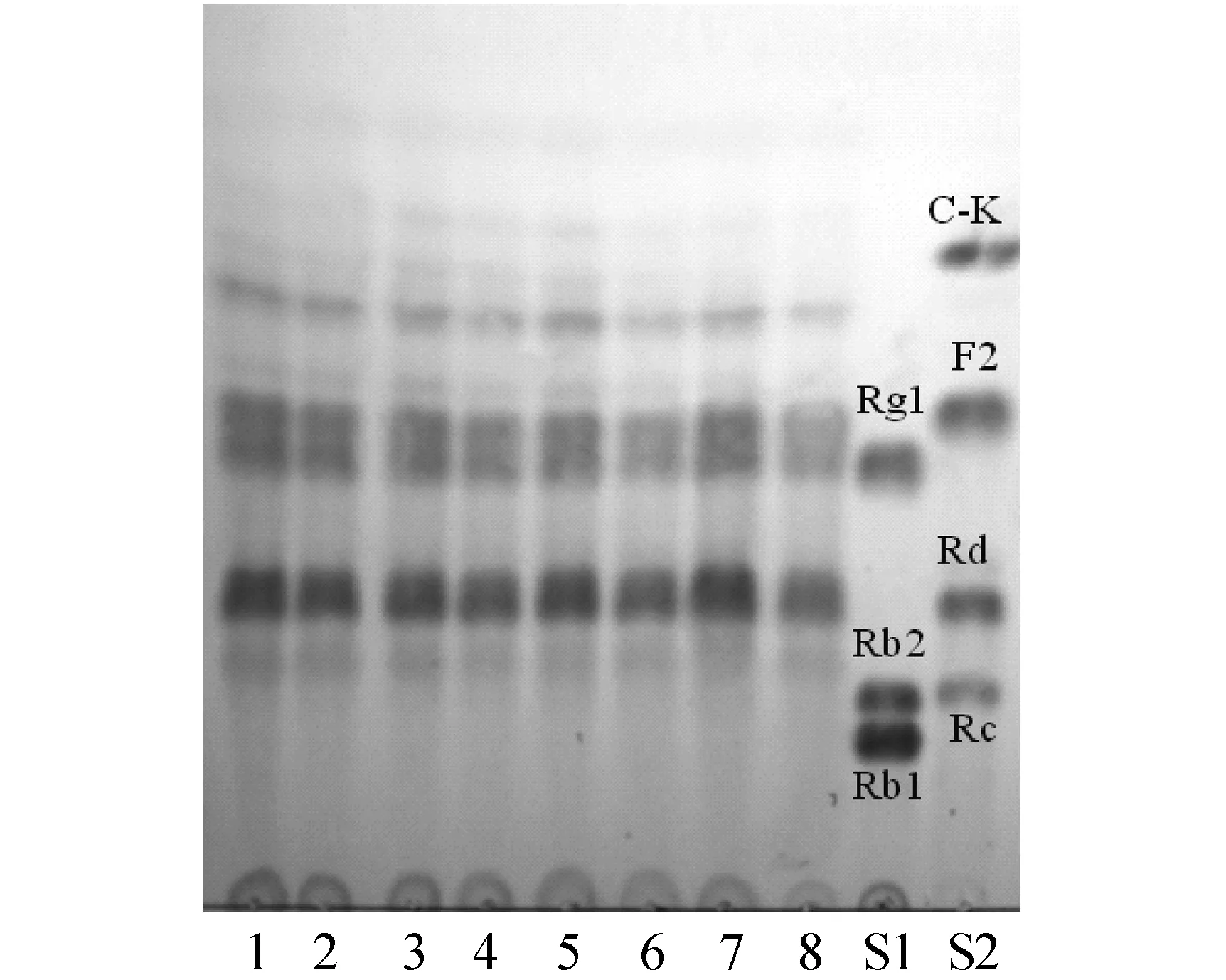
图3 内生菌D19在不同pH条件下转化人参根总皂苷的TLC图 (1为3.0; 2为4.0; 3为5.0; 4为6.0; 5为7.0; 6为8.0; 7为9.0; 8为10.0; S1、S2为标准品)
2.3 内生菌D19对人参根总皂苷的微生物转化
在100 mL锥形瓶中加入60 mL水和0.9 g人参根总皂苷粉末,pH值为5.0,经高压蒸气灭菌锅灭菌后,进行生物转化实验.发酵10 d后对发酵液进行HPLC分析(图4).通过发酵前后人参皂苷含量的变化可知,发酵后Rb2、Rd、Rg1和Re的含量明显减少,Rb1几乎完全转化,且稀有人参皂苷F2、C-K和Rh1的含量均有不同程度的增加.HPLC分析结果显示,最佳生物反应条件下稀有人参皂苷F2、C-K和Rh1的最高产率分别为30%、17%和8%.

图4 内生菌D19发酵人参根总皂苷的HPLC谱图
2.4 内生菌D19对单体皂苷的生物转化
为了探明稀有人参皂苷Rh1、F2和C-K的来源,利用内生菌D19分别对人参皂苷Rb1、Rb2、Rc、Rd和Rg1进行转化实验.
利用内生菌D19对人参二醇类皂苷Rb1、Rb2、Rc和Rd进行转化,通过转化前后的TLC对比可知(图5),内生菌D19能够将人参皂苷Rb1和Rd转化为稀有人参皂苷C-K,还能将人参皂苷Rb1、Rc和Rd转化为稀有人参皂苷F2,并在人参皂苷Rb2的转化中,生成稀有人参皂苷C-Y,因此可以确定稀有人参皂苷F2和C-K是由Rb1、Rb2、Rc和Rd等人参二醇类皂苷转化产生.

图5 内生菌D19转化二醇类单体皂苷的TLC图 (底物:1为Rb1; 2为Rb2; 3为Rc; 4为Rd; S为标准品)
利用内生菌D19对人参三醇类皂苷Rg1进行转化,通过转化前后的TLC对比可知(图6),内生菌D19能够将人参皂苷Rg1转化为稀有人参皂苷Rh1和F1,因此可以确定稀有人参皂苷Rh1是由Rg1等人参三醇类皂苷转化产生.

图6 内生菌D19转化三醇类单体皂苷Rg1的TLC图 (D19为Rg1的内生菌转化产物; S为标准品)
2.5 内生菌D19对单体皂苷Rb1的转化路径
以人参皂苷Rb1为例,探讨内生菌D19对单体皂苷的转化路径.微生物转化实验过程中,每隔一定时间取样,进行HPLC分析,并利用人参皂苷峰面积变化与发酵时间的关系作图(图7).从图7可以看出:反应开始后,底物人参皂苷Rb1的含量急剧下降,直到3 h后被完全水解;人参皂苷Rd的含量随Rb1的减少而逐渐增多,4 h后随F2的急剧上升而迅速下降,直至完全消失;人参皂苷F2的含量在Rd产生后逐渐增加,在Rd趋于消失时达到最大值,后随C-K的产生而逐渐下降;人参皂苷C-K在24 h后生成,含量随F2的下降而增加,直到反应结束.因此,可以推测内生菌D19对单体皂苷Rb1的转化路径为Rb1→Rd→F2→C-K(图8).
2.6 内生菌D19的鉴定
由图9可以看出,内生菌D19为大小均匀、规则的杆形细菌.内生菌D19通过16S rDNA提取,PCR扩增,质粒重组等一系列操作后,得到的凝胶电泳图(图10)中显示DNA的片段大小约为1 600 bp.通过与GenBank中核酸数据进行对比分析,找到与内生菌D19相似的物种基因,然后利用Clustal X进行多重序列分析,使用Mega 4.0软件进行邻接法聚类分析,最终得到内生菌D19的系统发育树(图11).以上分析表明,内生菌D19归属于藤黄色杆菌属(Dyella),与DyellaginsengsoilstrainLA-4相似性达到97%.

图7 内生菌D19转化人参皂苷Rb1过程中峰面积的变化与发酵时间的关系图

图8 内生菌D19转化人参皂苷Rb1的转化路径

图9 内生菌D19在光学显微镜下的微观形态
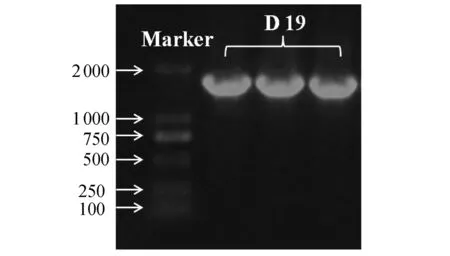
图10 内生菌D19重组质粒DNA的凝胶电泳图

图11 内生菌D19的无根系统发育树
3 结论
从党参中分离得到能够将人参根总皂苷中的Rb1、Rb2、Rc、Rd和Rg1等转化为稀有人参皂苷F2、C-K和Rh1的内生菌D19,在最佳转化条件(水为培养基、pH 5.0)下F2、C-K和 Rh1的最高产率分别为30%、17%和8%.单体皂苷的转化结果表明,稀有人参皂苷F2和C-K是由Rb1、Rb2、Rc和Rd等人参二醇类皂苷转化,而稀有人参皂苷Rh1是由Rg1等人参三醇类皂苷转化产生.菌株D19对人参皂苷Rb1的转化路径为Rb1→Rd→F2→C-K.通过16S rDNA序列分析,鉴定内生菌D19为藤黄色杆菌属(Dyella).
[1] Jia L, Zhao Y. Current evaluation of the millennium phytomedicine-ginseng (I): etymology, pharmacognosy, phytochemistry, market and regulations[J]. Current Medicinal Chemistry, 2009,16(19):2475-2484.
[2] Wang L, Liu Q M, Sung B H, et al. Bioconversion of ginsenosides Rb1, Rb2, Rc and Rd by novel β-glucosidase hydrolyzing outer 3-O glycoside fromSphingomonassp. 2F2: Cloning, expression, and enzyme characterization[J]. Journal of Biotechnology, 2011,156(2):125-133.
[3] Chen Y, Xu Y, Zhu Y, et al. Anti-cancer effects of ginsenoside compound k on pediatric acute myeloid leukemia cells[J]. Cancer Cell International, 2013,13(1):24.
[4] Xu Q F, Fang X L, Chen D F. Pharmacokinetics and bioavailability of ginsenoside Rb1 and Rg1 from Panax notoginseng in rats[J]. Journal of Ethnopharmacology, 2003,84(2/3):187-192.
[5] Shin K C, Oh D K. Characterization of a novel recombinant β-glucosidase from Sphingopyxis alaskensis that specifically hydrolyzes the outer glucoseat the C-3 position in protopanaxadiol-type ginsenosides[J]. Journal of Biotechnology, 2014,172:30-37.
[6] 白龙律,臧蕴霞,尹成日.微生物转化人参皂苷Rb1为Rg3的研究[J].延边大学学报:自然科学版,2009,35(2):141-144.
[7] 崔磊,金护定,尹成日.人参总皂苷的发酵及其产物的抗癌活性研究[J].延边大学学报:自然科学版,2014,40(4):314-319.
[8] Wu L P, Jin Y, Yin C R, et al. Co-transformation of Panax major ginsenosides Rb1 and Rg1 to minor ginsenosides C-K and F1 byCladosporiumcladosporioides[J]. Journal of Industrial Microbiology Biotechnology, 2012,39(4):521-527.
[9] Yang X B, Hou J, Liu D, et al. Biotransformation of isoimperatorin byCunninghamellablakesleanaAS 3.970[J]. Journal of Molecular Catalysis B: Enzymatic, 2013,88:1-6.
[10] Lü X, Liu D, Hou J, et al. Biotransformation of imperatorin byPenicilliumjanthinellum. Anti-osteoporosis activities of its metabolites[J]. Food Chemistry, 2013,138(4):2260-2266.
[11] 李端,郭利伟,郭伟云,等.抗肿瘤药用植物及其内生菌活性代谢产物的研究[J].安徽农业科学,2009,37(16):7508-7509.
[12] Agusta A, Maehara S, Ohashi K, et al. Stereoselective oxidation at C-4 of flavans by the endophytic fungusDiaporthesp. isolated from a tea plant[J]. Chemical Pharmaceutical Bulletin, 2005,53(12):1565-1569.
[13] Verza M, Arakawa N S, Lopes N P, et al. Biotransformation of a tetrahydrofuran lignin by the endophytic fungusPhomopsissp.[J]. Journal of the Brazilian Chemistry Society, 2009,20(1):195-200.
[14] Yao M L, Liu J Z, Jin S, et al. A novel biotransformation of astragalosides to astragaloside IV with the deacetylation of fungal endophytePenicilliumcanescens[J]. Process Biochemistry, 2014,49(5):807-812.
[15] Surette M A, Sturz A V, Lada R R, et al. Bacterial endophytes in processing carrots (Daucus carota L.var.sativus): their localization, population density, biodiversity and their effects on plant growth[J]. Plant Soil, 2003,253(2):381-390.
[16] Kim O S, Cho Y J, Lee K, et al. Introducing EzTaxon-e: a prokaryotic 16S rRNA gene sequence database with phylotypes that represent uncultured species[J]. International Journal of Systematic and Evolutionary Microbiology, 2012,62(3):716-721.
[17] Tamura K, Dudley J, Nei M, et al. MEGA 4: molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007,24(8):1596-1599.
Study on biotransformation of ginseng root saponins to minor ginsenosides F2 and C-K by endophyte from Codonopsis pilosula
CUI Lei1, JIN Yingjin2, YIN Chengri1,2*
( 1.DepartmentofChemistry,CollegeofScience; 2.AnalyticalandTestingCenter:YanbianUniversity,Yanji133002,China)
A total of 32 kinds of endophytes formCodonopsispilosulawere isolated through the method of organizational separation. Among these endophytes, strains D19 showed the strongest activities to convert major ginsenosides to minor ginsenosides. When in the medium of H2O, pH of 5.0, the maximum yield of minor ginsenosides F2, C-K and Rh1 reached to 30%, 17% and 8%, respectively. The source of minor ginsenosides and the transformation pathway of ginsenoside Rb1 were confirmed according to the saponin monomer conversion experiments. Phylogenetic analysis based on 16S rDNA sequences indicated that the strain D19 belongs to the genusDyella.
Codonopsispilosula; minor ginsenosides; endophytes; biotransformation
2014-12-07 *通信作者: 尹成日(1963—),男,博士,教授,研究方向为天然产物生物转化.
吉林省自然科学基金资助项目(2015—2017);国家自然科学基金资助项目(20862017)
1004-4353(2015)01-0079-06
Q815
A
