影响麦芽溶解度的关键制麦参数及参数优化*
2015-12-25许举飞康健谷方红王德良
许举飞,康健,谷方红,王德良
1(新疆大学生命科学与技术学院,新疆 乌鲁木齐,830046)
2(中国食品发酵工业研究院,北京,100015)
麦芽是啤酒的主要原料[1]。它是由大麦制麦而得,制麦工艺包括浸麦、发芽、凋萎和干燥4个重要阶段,麦芽制作成功的标志是胚乳细胞壁被彻底破坏;胚乳内的蛋白质网被分解;大麦蛋白质的溶解性得到增强并形成大量水解酶以使这些变化能持续进行;麦芽获得在糖化过程中使淀粉迅速分解的潜力。麦芽溶解度即是衡量细胞壁溶解的好坏的指标。好的制麦工艺要求是所制成麦芽的各项理化指标适宜,麦芽溶解情况良好,麦芽有适当的颜色和香味,糖化过程中的浸出物和可发酵成分含量高,适于酿造优质啤酒[2]。成品啤酒的质量优劣与原料麦芽的质量好坏有着直接的关系,麦芽质量不良会增加麦汁和啤酒的过滤困难[3],进而会增加啤酒的涩味,同时影响啤酒的非生物稳定性[4]。麦芽质量对啤酒酿造有着重要作用,而制麦工艺与麦芽质量有着密切关系[5]。
麦芽溶解度是麦芽质量的一个重要指标[6],一些酿造过程中出现的问题往往是由于麦芽溶解不良造成的,麦芽溶解度反映了制麦过程中胚乳细胞壁中β-葡聚糖和蛋白质的溶解程度[7]。溶解不良的麦芽,麦芽中营养成分比例失衡,麦汁浸出率低,可发酵性不佳,成品酒的发酵度和酒精度低,引起碳水化合物“冷浑浊”,可溶性氮水平低,麦芽汁黏稠,富含β-葡聚糖,会造成麦芽汁流动缓慢,给啤酒过滤带来困难。麦芽溶解过度也是不可取的。另外麦芽的均一性程度[8]是高质量麦芽的重要指标。严格控制从大麦到麦芽的工艺管理,降低麦芽质量低劣对啤酒生产的影响[9]。麦芽粉质疏松易碎且细腻表示溶解良好,坚硬不易咬断难展开且呈胶状为溶解不良[10]。麦芽溶解不良或者质量不均一,需要外来酶的添加才能弥补麦芽溶解不均一带来的问题[11],增加了啤酒生产成本。麦芽含酶量不足,胚乳溶解较差,造成发酵后期降糖慢且残糖高,生产出的啤酒缺陷明显[12]。因此提高麦芽溶解度,有利于麦汁中的酶和可溶性成分的数量和组成,对提高啤酒质量是至关重要的[13]。
目前测定细胞壁溶解好坏的方法可采用β-葡聚糖分析方法,如Megazyme试剂盒测定麦芽中的β-葡聚糖含量间接来评价胚乳细胞壁的降解程度,或采用荧光染色法确定细胞壁溶解程度,即通过可与β-葡聚糖专一性结合的Calcofluor荧光增白剂,未被溶解的细胞壁会被着色,呈现明亮的蓝色荧光,已溶解的部分呈现浅蓝色,对麦粒纵切面进行染色计算即可获得麦芽溶解度[14],该方法比较真实地反映了麦芽的溶解情况,且相对简单直观。但前者相对繁琐,且测出的β-葡聚糖包括部分降解的小分子和没有降解的大分子。为了更加直观的观察麦芽的溶解情况,还进行了麦芽胚乳纵切面的微观结构观察,本文针对影响该指标的关键制麦参数即浸麦度、发芽温度、凋萎温度、干燥温度,以进口大麦为原料,进行了单因素试验,在此基础上还采用响应面设计得到提高麦芽溶解度的最佳制麦工艺。
1 材料与方法
1.1 材料与设备
进口大麦,中国食品发酵工业研究院。
Calcofluor荧光 增 白剂[15],Sigma 公司;10%KOH。
粘土块,Daubrew咨询公司;Carlsberg种子固定系统,Daubrew咨询公司,包括一个多槽模、压力机和大麦磨光机;麦芽溶解度测定仪系统,丹麦Carlsberg公司。JFC-1600型离子束溅射仪,日本电子公司;JSM-6700F型冷场发射扫描电子显微镜(JEOL),日本电子公司。
1.2 实验方法
1.2.1 麦芽溶解度的测定方法
利用Carlsberg种子固定系统可得到2份每份50颗半粒的部分。使用上模和下模将50颗麦粒放在下模之中。借助压力机可以使50颗麦粒固定,从而使每颗种子的一半被埋在粘土中。用盘式粉碎机将这些麦粒磨去一半。用荧光染料(Calcofluor)溶液浸染此半粒谷物2 min,用70% 乙醇冲洗,用滤纸沾除残留的乙醇。把麦芽半粒组放在麦芽溶解度测定仪上,打开紫外灯。没有溶解的胚乳呈现蓝色荧光(通常靠近麦粒的顶部),而过度溶解的胚乳呈暗蓝色。溶解后的胚乳的面积占整个胚乳面积的百分比被定义为一颗麦粒的百分溶解度。一个样品的百分溶解度为100颗麦粒溶解的平均溶解度。
1.2.2 计算公式
按麦芽溶解程度增加的分组序列,判定每一麦粒属于哪一组。
0% <0<5%,5% <1<25%,25% <2<50%,50% <3 <75%,75% <4 <95%,95% <5 <100%。
一个麦芽样品的溶解度计算方法:M=(0×《0》+0.125×《1》+0.375×《2》+0.625×《3》+0.875×《4》×1《5》),式中:《0》,《1》,《2》,《3》,《4》,《5》表示每一麦芽溶解度组中的麦粒颗数。
1.2.3 麦芽胚乳微观结构观察
1.2.3.1 麦芽的准备
用切片刀沿着麦芽的纵切面,上下纵切面相平行,以有麦沟那一大面积的纵切面为观察面,厚度<1.0 mm,越薄越好。
1.2.3.2 喷金
把切好的麦芽样品一个挨着一个依次排列整齐,放在预先贴有两面胶的喷金圆盘上,在离子束溅射仪进行喷金,大约10 min左右。喷金的目的为了使样品导电,这样使样品能有更好的观察效果。
1.2.3.3 进样及检测
按排气钮,抽真空,待真空度≤5.14×104Pa,开始进样,一般样品达到真空度所需时间一般为30 min,由于本样品厚度较厚,气体较多,达到要求的真空度约需2 h,对于真空泵也有损耗,所以进样之前需对样品要进行脱真空处理。
1.2.3.4 拍照及数据输出
本实验采用麦芽纵切面×1000进行观察,对每一种麦芽纵切面表面的形貌进行观察,在对样品进行拍照时,选取纵切面的两个半球的淀粉颗粒多的地方(纵切面中轴线附近),每个样品拍照两次,两个半球各拍照一次。出样,先关掉电子枪,再关掉加速电压,关机,测试数据谱图采用刻盘形式。
1.2.4 单因素试验设计
1.2.4.1 微型制麦工艺
浸麦:浸三断二,温度14~16℃,总浸麦时间20 h左右,浸麦度42~46%左右。
发芽:发芽温度控制在14~16℃,最高绿麦芽水分45~47%。
干燥:50℃,15 h;60℃,1 h;70℃,1 h;80~83℃,5 h。
1.2.4.2 浸麦度对麦芽溶解度的影响
测定浸麦度分别为42%、44%、46%、48%、50%下的麦芽溶解度。
1.2.4.3 发芽温度对麦芽溶解度的影响
测定12、14、16、18、20 ℃发芽温度下的麦芽溶解度。
1.2.4.4 凋萎温度对麦芽溶解度的影响
测定不同凋萎温度44、46、48、50、52 ℃下的麦芽溶解度。
1.2.4.5 干燥温度对麦芽溶解度的影响
测定74、76、78、80、82 ℃下的麦芽溶解度。
1.2.4.6 响应面优化试验设计
选取浸麦度(A)、发芽温度(B)、凋萎温度(C)、干燥温度(D),利用软件Design Expert 8.0.6进行4因素3水平的Box-Behnken试验,以麦芽溶解度为响应值,优化提高麦芽溶解度条件。试验的因素水平设计见表1。
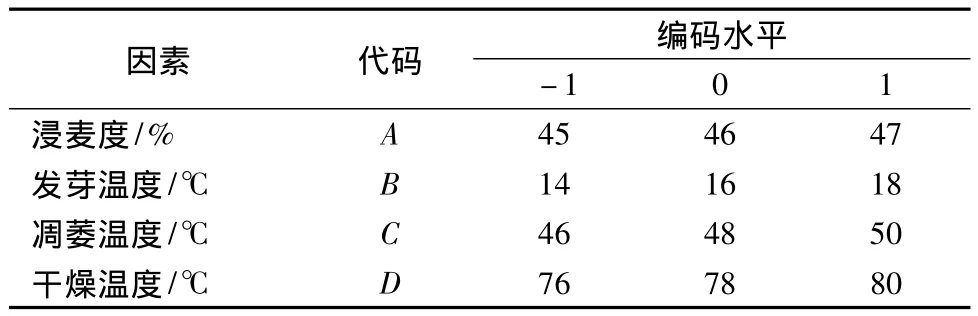
表1 Box-Behnken分析因素与水平Table 1 Factors and levels of Box-Behnken design
1.2.4.7 数据处理
采用SPSS 20.0统计分析和Excel软件对数据进行分析,试验结果为3次试验的平均值。
2 结果与分析
2.1 麦芽胚乳微观结构
麦芽胚乳纵切面微观结构谱图按照细胞溶解度大小依次排列如图1所示,麦芽溶解度依次为80%、90%、99%。
麦芽细胞溶解度主要体现在淀粉颗粒、蛋白质等物质的分解,随着细胞溶解度的提高,麦芽淀粉颗粒细小、均匀,而且间隔(主要是蛋白质)少,直到分解完全。由图1可知,当麦芽的细胞溶解度在80%~90% 时,淀粉颗粒分解不完全,大小不均一,大的颗粒中夹杂部分小颗粒,而且间隔(蛋白质)分解情况不良好,当细胞溶解度>90% 时,细胞的淀粉颗粒逐渐趋于均匀化且开始变小,细胞间隔逐渐变薄,说明蛋白质溶解情况变好,当细胞溶解度达到99% 以上时,蛋白质分解趋向完全,且淀粉颗粒均匀度很好。

图1 麦芽胚乳微观结构谱图Fig.1 The microstructure spectrogram of malt endosperm
冷场发射扫描电子显微镜所需的真空度很高,麦芽样品处理有一定的难度,厚度达不到要求,进样前应该对样品进行抽真空,对样品的扫描拍照可以进行×200、×500、×1 000、×1 500、×2 000等倍数的放大,观察麦芽溶解情况。
2.2 浸麦度对麦芽溶解度的影响
由图2所示,当浸麦度由42%增加至46%时,麦芽溶解度呈现增加的趋势(P<0.05),当浸麦度为46%时,麦芽溶解度达到最大值,此后随着浸麦度的增大,麦芽溶解度开始缓慢降低,这说明更高的浸麦度,并不一定使麦芽溶解度提高。可能是当浸麦度达到一定量时,大麦不再吸收水分,浸麦时间截止,大麦细胞结构承受程度达到最大,此时,我们应该终止浸麦,进入发芽阶段。而且,浸麦时间过长会造成制麦时间延长和水资源的严重浪费。选取浸麦度46%浸麦较为适宜。
2.3 发芽温度对麦芽溶解度的影响

图2 浸麦度对麦芽溶解度的影响Fig.2 The effect of barley steeping degree on malt solubility
由图3所示,当发芽温度从12℃增加至16℃时,随着发芽温度的增大,麦芽溶解度随之增大,当发芽温度达到16℃时,麦芽溶解度达到最大值,显著高于其它发芽温度下的麦芽溶解度(P<0.05),当发芽温度大于16℃时,麦芽溶解度显著降低(P<0.05)。当发芽温度增加到20℃时,麦芽溶解度大于在发芽温度12℃下的麦芽溶解度。周如镜[16]研究表明,在整个发芽过程中采用15~20℃的发芽温度,基本能满足麦芽生产对成品麦芽各项指标的要求。由于发芽温度过高,造成发芽时间在第3天时,呈现叶芽生长过长的现象,造成麦芽质量下降,为了避免此现象,选取发芽温度16℃较为适宜。

图3 发芽温度对麦芽溶解度的影响Fig.3 The effect ofbarley germination temperature on malt solubility
2.4 凋萎温度对麦芽溶解度的影响
由图4所示,当凋萎温度从44℃增加至46℃时,随着凋萎温度的增大,麦芽溶解度增加缓慢,变化幅度不明显,凋萎温度达到48℃时,麦芽溶解度达到最大值,高于其它凋萎温度下的麦芽溶解度(P<0.05),当凋萎温度大于48℃时,麦芽溶解度开始呈现降低趋势。选取凋萎温度48℃较为适宜。

图4 凋萎温度对麦芽溶解度的影响Fig.4 The effect of barley searing temperature on malt solubility
2.5 干燥温度对麦芽溶解度的影响
由图5所示,当干燥温度从74℃增加至78℃时,随着干燥温度的增大,麦芽溶解度随之增大,当干燥温度达到78℃时,麦芽溶解度达到最大值,显著高于其他干燥温度下的麦芽溶解度(P<0.05),当干燥温度高于78℃时,麦芽溶解度开始呈现缓慢降低趋势。当干燥温度增加到78℃时,麦芽溶解度大于在干燥温度74℃下的麦芽溶解度。由于干燥温度过高,造成麦芽中β-葡聚糖酶失活,78℃是β-葡聚糖酶最佳适宜温度[17]。管敦仪[18]和 Kunze[19]等的研究表明,β-葡聚糖酶活力的提高可能促进了 α-淀粉酶和蛋白酶的形成和释放,麦芽溶解度增大。若干燥温度过高造成麦芽中β-葡聚糖、淀粉、蛋白质等降解不足,造成麦芽质量下降,为了避免此现象,选取干燥温度78℃较为适宜。这和Karababa[20]等关于干燥工艺对微型制麦质量参数的影响(凋萎温度50℃,干燥温度85℃)的研究有所不同。
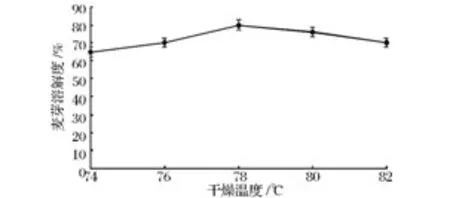
图5 干燥温度对麦芽溶解度的影响Fig.5 The effect of barley drying temperature on malt solubility
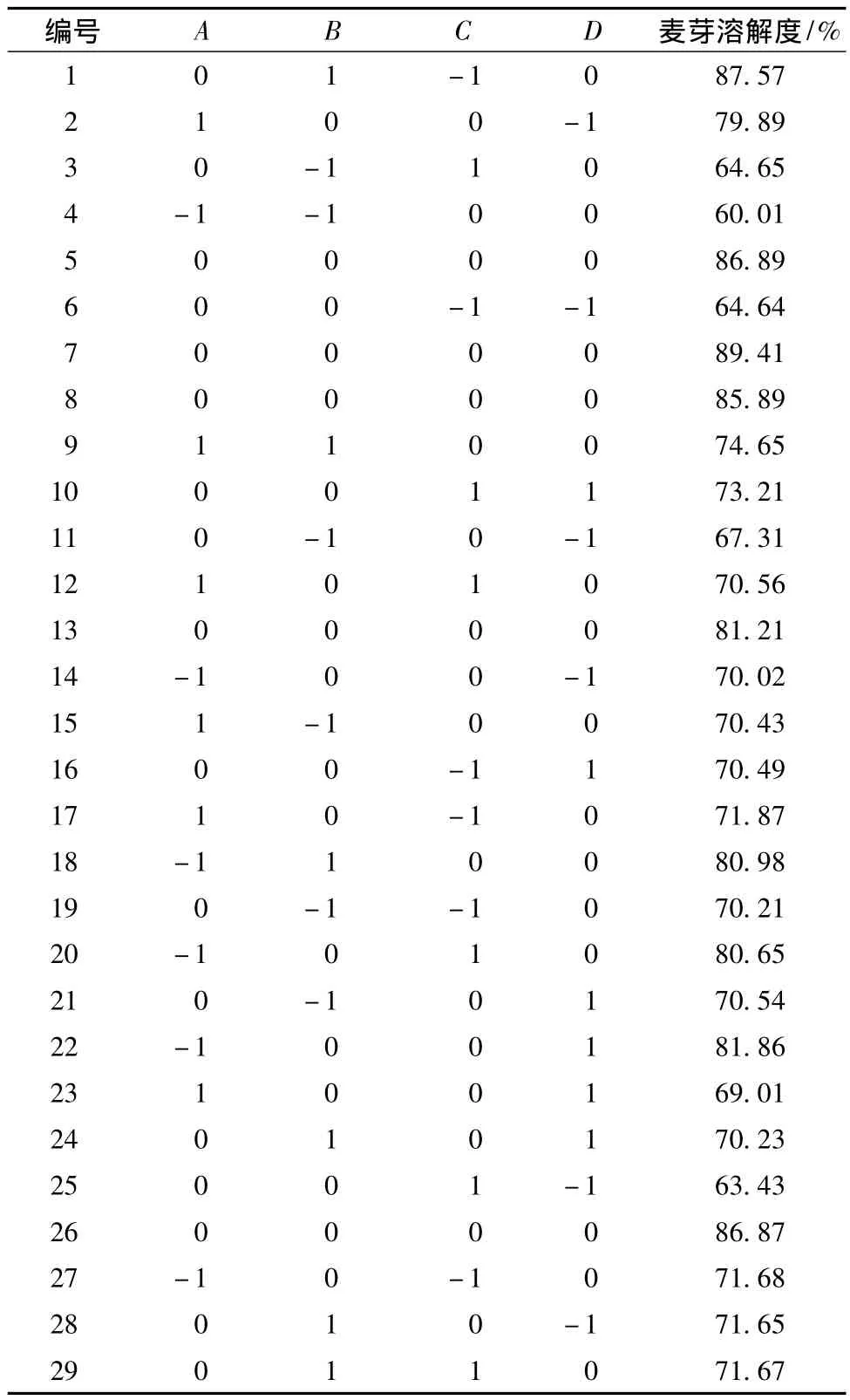
表2 Box-Behnken试验设计及相应结果Table 2 Experimental design and results of Box-Behnken design
2.6 试验结果与模型建立
根据表1,进行浸麦度、发芽温度、凋萎温度、干燥温度共4因素3水平与麦芽溶解度之间的响应面优化试验,其试验方案和结果见表2。
利用Design Expert 8.0.6软件对表2数据进行二次多元回归拟合,得到以麦芽溶解度对编码自变量A、B、C和D的二次多项回归方程:麦芽溶解度/%=86.05-0.73A+4.47B-1.02C+1.53D-4.79A2-7.51B2-7.42C2-8.46D2-4.19AB-2.57AC-5.68AD-2.59BC-1.16BD+0.98CD。方差分析及显著性检验结果见表3,可知,该回归方程模型显著(P=0.008 2<0.05),失拟项 P=0.109 5>0.05,失拟性检验结果不显著。这一结果说明该模型与数据拟合程度较高,试验误差小,可用该模型分析和预测麦芽溶解度的结果。对模型回归方程系数的显著性试验表明,一次项 B,交互 AD,二次项 A2、B2、C2、D2影响显著。

表3 麦芽溶解度回归方程方差分析Table 3 Regression coefficient and analysis of the model
2.7 响应面分析
根据回归方程,利用Design Expert 8.0.6软件作不同因素的响应面分析图,并结合方差分析表,浸麦度、发芽温度、凋萎温度、干燥温度4个因素及其交互作用对麦芽溶解度的影响结果可通过图6~11直接反映出来。由图6~11可知,4个因素影响大小为 B(发芽温度)>D(干燥温度)>C(凋萎温度)>A(浸麦度)。

图6 浸麦度、发芽温度及其交互作用的影响Fig.6 The interaction effect of barley steeping degree and germination temperature on malt solubility

图7 浸麦度、凋萎温度及其交互作用的影响Fig.7 The interaction effect of barley steeping degree and searing temperature on malt solubility

图8 浸麦度、干燥温度及其交互作用的影响Fig.8 The interaction effect of barley steeping degree and drying temperature on malt solubility
2.8 最佳工艺条件的验证
由Design Expert 8.0.6软件得到麦芽溶解度的最佳制麦工艺条件为浸麦度为45.88%,发芽温度为16.36℃,凋萎温度为48.00℃,干燥温度为78.04℃,在此条件下,麦芽溶解度为86.96%。为了方便实际操作,将浸麦度修正为46%,发芽温度为16℃,凋萎温度为48℃,干燥温度为78℃,在该条件下重复3次试验,得到麦芽溶解度为87%,与预测值86.96% 接近,说明采用响应面得到的优化工艺结果可靠,具有一定的实用价值。与响应面优化实验前的麦芽溶解度81%相比,制麦工艺优化后,麦芽溶解度提高了7.41%。

图9 发芽温度、凋萎温度及其交互作用的影响Fig.9 The interaction effect of barley germination temperature and searing temperature on malt solubility

图10 发芽温度、干燥温度及其交互作用的影响Fig.10 The interaction effect of barley germination temperature and drying temperature on malt solubility

图11 凋萎温度、干燥温度及其交互作用的影响Fig.11 The interaction effect of barley searing temperature and drying temperature on malt solubility
3 结论
经过麦芽胚乳微观结构观察,试验表明,当麦芽的细胞溶解度在80~90% 时,淀粉颗粒分解不完全,大小不均一,大的颗粒中夹杂部分小颗粒,而且间隔(蛋白质)分解情况不良好,当细胞溶解度>90%时,细胞的淀粉颗粒逐渐趋于均匀化且开始变小,细胞间隔逐渐变薄,说明蛋白质溶解情况变好,当细胞溶解度达到99%以上时,蛋白质分解趋向完全,且淀粉颗粒均匀度很好。
响应面分析结果表明,麦芽溶解度和各因素之间的关系为:发芽温度主效应显著,各因素对麦芽溶解度影响程度的大小顺序为:B(发芽温度)>D(干燥温度)>C(凋萎温度)>A(浸麦度)。制麦工艺条件为:浸麦度为46%,发芽温度为16℃,凋萎温度为48℃,干燥温度为78℃,实际麦芽溶解度为87%。与优化前的麦芽溶解度81%相比,制麦工艺优化后,麦芽溶解度提高了7.41%。
[1] 吴迪,邱然,于春丽,等.制麦过程中麦芽抗氧化性的研究[J].食品工业科技,2012,33(10):131-134.
[2] John G Smart,Bryce K Lukes,Erica Tie,et al.Relationships among wort β-glucan,malting conditions and malt analysis[J].American Society of Brewing Chemists,Inc.,1993,51(4):88-93.
[3] 张伟.啤酒大麦制麦工艺的探讨[J].啤酒科技,2003(3):20-23.
[4] 冉秀芬.提高啤酒质量应严把原料关[J].啤酒科技,2001(6):54-56.
[5] 徐斌.麦汁制造过程的工艺设计及其原理解析[J].啤酒科技,2008(12):11-19.
[6] 丛培江.麦芽生产中麦芽溶解度的工艺控制[J].啤酒科技,2001(6):116-118.
[7] 王雅君.一个预测麦芽溶解度的新方法[J].啤酒科技,2008(5):28-30.
[8] 徐斌.对麦芽制造过程的控制与对麦芽质量鉴别的若干理念[C].美国纽约:国际酿酒大会,2010-8.
[9] 吕晓岩.麦芽缺陷对啤酒酿造的影响[J].酿酒科技,2010(7):56-58.
[10] Henry R J.Factors influencing the rate of modification of barleys during malting[J].Journal of Cereal Science,1989,10(1):51-59.
[11] 王家林,韩华.酶制剂在啤酒酿造中的应用[J].酿酒科技,2009(11):76-79.
[12] 邵法都.用低发芽率的麦芽酿酒[J].酿酒科技,1996(1):44-46.
[13] Mark R Schmitt,Allen D Budde U S.Malting extremely small quantities of barley[J].American Society of Brewing Chemists,Inc.,2011(7):191-199.
[14] 詹晓辉.评价麦芽溶解度的指标相关性研究[D].广州:华南理工大学,2006:15-21.
[15] Sigma公司.Fluka-18909卡尔科弗卢尔荧光增白剂说明书[M].sigma-aldrich.com.
[16] 周如镜.国产大麦制麦对麦芽过滤速度的影响[J].啤酒科技,2005(2):46-47.
[17] 韩鹏,贠建民.不同干燥工艺条件下β-葡聚糖酶活性与麦芽品质关系的研究[J].食品科学,2009,30(1):42-44.
[18] 管敦仪.啤酒工业手册[M].北京:中国轻工业出版社,1998:74.
[19] Kunze W.啤酒工艺实用技术[M].湖北啤酒学校翻译组译.北京:中国轻工业出版社,1998:118-156.
[20] Karababa E,Schwarz P B,Horsley R D.Effect of kiln schedule on micromalt quality parameters[J].American Society of Brewing Chemists,Inc.,1993,51(4):163-167.
