IL-15对体外培养的DC致敏的T淋巴细胞的作用研究
2015-12-25刘焕义徐红玉苏晓妹朱亚杰
赵 煜,张 涛,刘焕义,徐红玉,杨 波,苏晓妹,朱亚杰,刘 桢
中国人民解放军成都军区总医院肿瘤中心(四川 成都 610083)
IL-15对体外培养的DC致敏的T淋巴细胞的作用研究
赵煜,张涛,刘焕义,徐红玉,杨波,苏晓妹,朱亚杰,刘桢
中国人民解放军成都军区总医院肿瘤中心(四川 成都 610083)
【摘要】目的通过与IL-2进行比较,观察IL-15激活T细胞反应,增强DC细胞疫苗抗肿瘤的免疫反应。方法将骨髓来源的树突状细胞(BMDCs)皮下注射小鼠作为初次免疫,14d后取小鼠脾脏,制备淋巴细胞,与细胞因子(IL-2、IL-15)和BMDCs共同培养作为再次免疫,产生细胞毒T淋巴细胞(CTL)。流式细胞术检测细胞因子(IL-2或IL-15)联合BMDCs刺激小鼠淋巴细胞CD62L、CD69、CD44的表达情况;采用Cr51释放实验检测CTL对Levis肺癌细胞的杀伤作用;采用酶联免疫斑点实验(ELISPOT)检测分泌干扰素γ(IFN-γ)细胞亚群比例。结果IL-15联合 BMDCs疫苗上调CD8+T细胞表达CD69+、CD44+,增强对肿瘤细胞的杀伤活性,并能产生更多的IFN-γ分泌细胞。结论IL-15可能较IL-2更能增强DC疫苗抗肿瘤的免疫反应,为IL-15和DC疫苗的联合免疫治疗提供重要的试验依据和临床前研究的理论基础。
【关键词】白细胞介素15;白细胞介素2;CD8+T细胞;树突状细胞
手术、化疗和放疗是传统的肿瘤治疗三大手段,而现在生物治疗以其独特的优势已成为继这三种治疗手段后的第四种手段,而免疫治疗是肿瘤生物治疗的核心。正常情况下,机体存在以T淋巴细胞、 NK细胞和巨噬细胞为主的细胞免疫发挥主要的抗肿瘤作用。而肿瘤在人体免疫功能下仍能发生、发展,表明人体的抗肿瘤免疫作用不足,其原因可能与肿瘤逃避免疫监视,使人体不能有效的递呈肿瘤抗原,从而不能有效活化细胞毒性T细胞(CTL)有关[1]。
树突状细胞(dendritic cell,DC) 提呈抗原的能力远远强于B细胞、巨噬细胞等抗原提呈细胞(antigen presenting cells,APCs),是迄今所知机体内功能最强的抗原提呈细胞。DC可以对肿瘤抗原进行摄取和加工,并结合MHC-Ⅱ分子提呈于细胞表面,从而诱导CTL的抗肿瘤免疫反应[2];并且DC是细胞免疫应答的启动者,可以活化初始型T细胞。许多研究表明,肿瘤患者体内的DC不只数量有所下降,而且功能也受到不同程度的抑制,从而使T淋巴细胞介导的免疫应答不能被有效的激活。因此如何改善DCs疫苗的免疫状态,近年来逐渐成为肿瘤免疫学研究的热点[3-4]。
细胞因子在调节免疫反应中发挥重要作用,对DC的发育、成熟、免疫功能有着重要影响。IL-12、IL-2、粒-巨噬细胞集落刺激因子(grain-macrophage colony stimulating factor,GM-CSF)等常作为DC疫苗的免疫佐剂,使DC疫苗诱导的T细胞反应得以增强。IL-15是一种新近发现的细胞因子,具有与IL-2类似的激活T细胞、B细胞和NK细胞的作用,但其具有IL-2不具备的优势:目前认为它能激活、维持和扩增CD8+记忆性T细胞[5-6],但IL-2却抑制CD8+记忆性T细胞在体内的存活;IL-15不激活调节性T淋巴细胞 (tregs),并解除tregs对T细胞的抑制作用[7],IL-2却激活并维持tregs的活性和功能,而tregs对免疫的各个方面都有负调节作用[8];IL-15不会诱导活化诱导的细胞死亡(AICD),IL-2的作用正好相反。所以在肿瘤的免疫治疗中,IL-15可能是一种更好的DC免疫佐剂。本研究以IL-2为对照,观察IL-15对DC疫苗诱导的T淋巴细胞免疫反应的作用。
1材料与方法
1.1实验材料IL-15购自Peprotech公司。IL-2购自eBioscience公司。GM-CSF购自R&D公司。IL-4购自eBioscience公司。脂多糖 (LPS) 购自美国Sigma公司。PE-CD69 mAb购自eBioscience公司,PE-Cy5-抗CD8单抗(mAb),PE-CD44 mAb,PE-CD62L mAb。ELISPOT试剂盒购自MABTECH公司。C57BL/6小鼠,雄性,7~8周龄购自成都医学院实验动物中心。Levis肺癌细胞株购自ATCC,由本实验室保种储存。其它均为常用试剂。
1.2实验方法
1.2.1冻融法制备Levis肺癌细胞抗原Levis肺癌细胞复苏,用RPMl-l640完全培养基培养,0.25%胰蛋白酶消化、传代。取对数生长期的细胞,用PBS重悬细胞数为2×107/mL。置于液氮10min后放入37℃水浴中融化,反复5个循环。离心取上清即制成肿瘤细胞裂解液,置-80℃冰箱冻存备用。
1.2.2小鼠骨髓DC细胞(BMDCs)的获取与制备无菌取小鼠胫骨和股骨,用注射器吸取RPMI-1640培养基反复冲洗髓腔,冲洗液离心后弃上清。用红细胞裂解液裂解红细胞,离心后弃上清。用DC细胞培养基(RPMI-1640培养基:GM-CSF 1000U/mL、5%FCS和IL-4 500U/mL)调整细胞浓度为6×105/mL,加入6孔板(每孔含细胞1.8×106)。培养到第8d每孔加入0.1mL肿瘤细胞裂解液(2×107肿瘤细胞得来),培养4h后,加入LPS(终浓度1μg/mL)混匀诱导细胞成熟[9]。
1.2.3小鼠脾脏T淋巴细胞的制备无菌取得小鼠脾脏,无菌注射器芯研磨过200目钢网,离心弃上清,加入红细胞裂解液裂解红细胞后,RPMI-1640培养基3mL重悬置37℃孵箱备用。将尼龙毛柱加入预热为37℃的无血清RPMI-1640培养基置孵箱1h平衡尼龙毛柱。取出柱子加入3mL脾细胞悬液,37℃孵箱孵育45min。加入20mL37℃的RPMI-1640培养基,以1滴/s的速度洗柱子,得到小鼠脾脏T淋巴细胞悬液,调整细胞浓度为3×106/mL。
1.2.4淋巴细胞免疫表型测定采用流式细胞术直接免疫荧光标记法检测小鼠脾脏淋巴细胞免疫表型。收集培养第3、7、14d各组(IL-2,IL-15)T淋巴细胞,调整细胞浓度为1×106/mL,吸取1mL用PBS洗涤后,加入PBS缓冲液50μL及40μL各标记物(PE标记的抗CD44 mAb、 CD62L mAb、CD69 mAb或同型对照),室温避光孵育40min。采用不同浓度的IL-2(5、10、20或40mg/mL),IL-15(25、125、250或500ng/mL)培养淋巴细胞,在3、7、14d采用流式细胞术检测淋巴细胞免疫表型。
1.2.5肿瘤抗原负载的BMDCs诱导T淋巴细胞对肿瘤细胞杀伤活性的分析
1.2.5.1效应细胞的制备无菌取健康小鼠的脾脏淋巴细胞,制备T细胞悬液(步骤见上述)。调整细胞浓度为1×106/mL,取500μL/孔加入6孔板中。肿瘤抗原负载的BMDCs用RPMI-1640培养基调整细胞浓度为1×105/mL,取400μL/孔加入已置有T细胞的6孔板中,补足培养基为3mL,每组分别加入125ng/mL IL-15、10ng/mL IL-2或不加入细胞因子,37℃孵箱孵育7d,收集悬浮细胞作为效应细胞,以含10%FCS的RPMI-1640完全培养基稀释备用。
1.2.5.2用51Cr释放法检测效应细胞对Levis肺癌细胞的杀伤作用取1mL浓度为3×106/mL的Levis肺癌细胞作为靶细胞,加入100Ci Na51CrO4,混匀后置于37℃孵箱孵育2h。用Hanks液洗涤后加入RPMI-1640培养基重悬并调整细胞浓度为1×106/mL。将各组效应细胞与靶细胞按照效靶比(E/T)=160∶1、80∶1、40∶1、20∶1加入到96孔U型板中,各设4个复孔。同时设最小释放组(100μL靶细胞、100μL RPMl-l640培养基)、最大释放组(100μL靶细胞、100μL破膜剂l%triton-X100),于37℃孵箱孵育4h。离心取上清100μL于专用试管中。用γ记数器分别计数每管上清液的cpm值。细胞特异性杀伤率按以下公式计算:细胞特异性杀伤率%=(样本释放cpm平均值-最小释放cpm平均值)/(最大释放cpm平均值-最小释放cpm平均值) ×100%
1.2.6检测干扰素γ(Interferon-γ,IFN-γ)分泌细胞实验操作步骤按照ELISPPOT试剂盒说明书操作。调整效应细胞为1×106个/mL(制备步骤见1.2.5.1), 将100μL细胞悬液加入96孔培养板中每孔,各设4个复孔,孵育时间为24h。将ELISPPOT板置于解剖显微镜下(×40),记录黑紫色斑点,拍照,作统计学分析。
1.3统计学处理采用SPSS 17.0统计软件,各组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1IL-2和IL-15对CD8+T细胞免疫表型的影响
在第7d时,10ng/mL IL-2 、125ng/mL IL-15上调CD8+T细胞表达CD69+、CD44+,同时下调CD62L分子的能力较好。所以本实验选择在第7d时,以10ng/mL IL-2或125ng/mL IL-15检测T淋巴细胞的杀伤活性和IFN-γ分泌细胞,见图1。
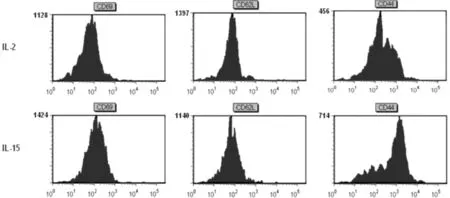
图1 流式细胞术分析CD8+T细胞的表型特征
2.2肿瘤抗原负载的DC疫苗诱导的T淋巴细胞对肿瘤细胞杀伤活性的影响在联合DC疫苗的情况下,将IL-15作为免疫佐剂这组对靶细胞的杀伤活性强于将IL-2作为免疫佐剂这组,而两者均显著高于对照组(P<0.05),见图2。

图2 DC疫苗再次免疫时,T淋巴细胞对肿瘤细胞杀伤活性的分析
2.3检测IFN-γ分泌细胞经DC疫苗再次刺激后,用含IL-15的培养基培养,每10万个细胞有约120个IFN-γ分泌细胞;而在IL-2培养的细胞中,每10万个细胞有约45个IFN-γ分泌细胞,两者之间有统计学差异(P<0.05),而两者均高于对照组(P<0.05),见图3。

图3 DC疫苗再次免疫时,分泌IFN-γ的细胞检测
3 讨论
在机体存在多种抗肿瘤免疫机制中,以T细胞介导的特异性细胞免疫起着主导作用。机体的免疫应答首先由APCs将肿瘤抗原进行摄取、加工,并将信息提呈给T淋巴细胞,进而引发特异性免疫应答。DC细胞是目前己知功能最强的APCs,细胞因子对DC细胞的发育、成熟,以及免疫功能的发挥至关重要,例如激活T细胞反应。许多细胞因子(如IL-2、IL-12、GM-CSF等)作为DC的免疫佐剂,从而使DC疫苗诱导的T细胞反应得以增强。因此以DC细胞为基础的肿瘤免疫治疗成为医学界研究的热点。
IL-15在空间构象上与IL-2相似,两者都属于4-螺旋的造血因子家族,螺旋为up-up-down-down的结构取向; IL-15受体(IL-15R)与IL-2受体(IL-2R)一样,包含IL-15Rα,IL-15Rβ,IL-15Rγ3条链。其中两者的β和γ亚单位相同,这可以解释实验中观察到的IL-15具有与IL-2相同的刺激T淋巴细胞增殖并维持其活性的作用。
但IL-15R本身有特异的IL-15α,是IL-15的高亲和力受体。与β,γ亚基结合后,IL-15Rαβγ成为IL-15的高亲和力受体,但IL-2Rαβγ对IL-2的亲和力没有改变。其次IL-15Rα在机体的表达更为广泛,主要激活单核细胞和DCs表达,而IL-2Rα主要由激活的T细胞和B细胞表达,这些有可能是两者具有不同生物学效应的原因之一。IL-2抑制记忆性T细胞在体内的存活,但是IL-15却能激活,维持和扩增CD8+记忆性T细胞。IL-2可以诱导AICD,而IL-15则不会诱导此作用。IL-2激活tregs,并维持其活性和功能,而tregs细胞对免疫的各个方面都有负调节作用,而IL-15不激活tregs,解除tregs对T细胞的抑制作用。长时间的使用IL-2仍然存在一定的毒副作用,其中最常见、最严重的是毛细血管渗漏综合症,而IL-15毒性较小。这可
以解释我们实验观察到了IL-15较IL-2更能刺激T淋巴细胞增殖,维持T淋巴细胞活性的作用。
鉴于以上分析,在肿瘤的免疫治疗中,IL-15可能是一种更好的DC免疫佐剂,具有更好的免疫治疗效果和临床应用前景[10]。
[参考文献]
[1]Grabstein K H,Eisenman J,Shanebeck K,et al.Cloning of a T cell growth factor that interacts with the beta chain of the interleukin-2 receptor[J].Science,1994(264):965-968.
[2]Burton JD,Bamford RN,Peters Cal.Alymphokine,provisionally designated interleukin Tand produced by a human adult T-cell leukemialine, stimulates T-cell proliferation and theinduction of lymphokine-activated killer cells[J].Proc Natl Acad,1994(91):4935-4939.
[3]Fehniger T A,Caligiuri M A.Interleukin 15:biology and relevance to human disease[J].Blood,2011(97):14-32.
[4]Kobayashi H,Carrasquillo JA,Paik CH,et al.Differences of biodistribution, pharmacokinetics, and tumor targeting between interleukins 2 and 15[J].Cancer Res,2000(60):3577-3583.
[5]Rubinstein MP,Kadima AN,Salem ML,et al.Systemic administration of IL-15 augments the antigen-specific primary CD8+T cell response following vaccination with peptide-pulsed dendritic cells J[J].Immunol,2002(169):4928-4935.
[6]Oh S,Berzofsky JA,Burke DS,et al.Coadministration of HIV vaccine vectors with vaccinia viruses expressing IL-15 but not IL-2 induces long-lasting cellular immunity[J].Natl Acad,2003(100):3392-3397.
[7]Stoklasek TA,Schluns KS,Lefran,et al.Combined IL-15/IL-15R alpha immunotherapy maximizes IL-15 activity in vivo[J].J Immunol,2006(177):6072-6080.
[8]Waldmann TA.The biology of interleukin-2 and interleukin-15: implications for cancer therapy and vaccine design[J].Nat Rev Immunol,2006(6):595-601.
[9]Weng NP,Liu K,Catalfamo M,et al.IL-15 is a growth factor and an activator of CD8 memory T cells[J].Ann N Y Acad Sci,2002(975):46-56.
[10]Villadsen LS.Resolution of psoriasis upon blockade of IL-15 biological activity in a xenograft mouse model[J].Clin Invest,2002(112):1571-1580.

·论著·
A Study on IL-15 as an Adjuvant for DC Vaccine Strategy to T Cell Response in Vitro
ZHAO Yu,ZHANG Tao,LIU Huan-yi,etal.
(DepartmentofMedicalOncology,CentralLabofChengduMilitaryGeneralHospital,Chengdu610083,China)
【Abstract】Objective Interleukin-15 (IL-15), compared with IL-2, was used as a potent adjuvant for dendritic cells (DCs)-directed vaccine strategy to activate T cell responses in vitro.Methods Bone marrow-derived DCs (BMDCs) were pulsed with tumor antigens and were injected subcutaneously into mice,14 days later, splenocytes were harvested and cultured in vitro with BMDCs to stimulate lymphocyte responses in the presence of IL-2 or IL-15 for 7 days. The activated T lymphocytes were examined by flow cytometric analysis, interferon-γ (IFN-γ ) enzyme-linked immunospot and cytotoxicity assays.Results IL-15 could enhance the expression of CD69+and CD44+、cytotoxicity and IFN-γ production.Conclusion The use of IL-15 acting as a potent adjuvant for DC-directed vaccine strategy may offer alternative choices for the immunotherapy of cancer.
【Key words】interlekin 15; interlekin 2;CD8+T cell response; dendritic cells
[收稿日期2014-06-15]
【中图分类号】R392
【文献标识码】A
【文章编号】1008-8164(2014)03-0001-04
作者简介赵煜(1983- ),女,四川绵阳人,硕士,研究方向:肿瘤生物治疗。
