pH调控对生物反应器发酵生产粪链球菌的影响
2015-12-25王红波陈禅友
王红波, 陈禅友, 刘 洁, 童 佩, 李 硕
(1.江汉大学生命科学学院,湖北省豆类(蔬菜)植物工程技术研究中心,湖北武汉430056;2.武汉回盛生物科技有限公司,湖北省兽药工程技术研究中心,湖北武汉430042)
粪链球菌(Streptococcus faecalis)也称粪肠球菌,为乳酸菌中的一类,属于链球菌科,肠球菌属,细胞呈球形,兼性厌氧,是革兰氏阳性菌(Franz等,2011)。粪链球菌作为益生菌,在动物的生产中应用效果良好,可提高动物机体的抗体水平,强化巨噬细胞的活力,提高免疫能力,促进动物健康养殖(Liu 等,2014;Swain 等,2009)。 在水产养殖中,粪链球菌有利于提高饲料的利用率,降低饲养成本,改善饲养环境。粪链球菌为兼性厌氧的乳酸菌,需氧量低,降低水体富营养的能力强,改善水质的功效良好。目前用摇瓶发酵优化粪链球菌培养条件的研究报道较多,但用生物反应器高效制备粪链球菌的发酵调控研究报道较少,摇瓶培养与生物反应器培养差异大,产业化大规模低成本发酵生产的难度大。溶氧和pH是发酵调控的两个关键因素,粪链球菌耗氧量低,溶氧易控制。因此试验研究了用生物反应器发酵生产粪链球菌的pH调控策略,为大规模高效发酵生产粪链球菌提供理论参考。
1 材料与方法
1.1 菌种 粪链球菌,由江汉大学生命科学学院保藏和提供。
1.2 培养基 固体培养基:葡萄糖2.5%、酵母浸粉1.0%、牛肉膏1.0%、蛋白胨1.0%、柠檬酸氢二铵0.2%、乙酸钠0.4%、硫酸镁0.02%、硫酸锰0.005%、琼脂粉2.0%,pH值7.0。
种子培养基:蔗糖2.5%、酵母浸粉2.0%、牛肉膏1.0%、蛋白胨1.0%、乙酸钠0.5%、磷酸氢二钾0.1%、磷酸氢二钠0.1%、柠檬酸氢二铵0.1%、硫酸镁0.05%、硫酸锰0.005%、吐温-80 0.1%、碳酸钙0.8%,初始pH值8.0,121℃灭菌30 min。
发酵培养基:蔗糖3.0%、酵母浸粉1.5%、牛肉膏1.5%、蛋白胨1.0%、乙酸钠0.6%、磷酸氢二钾0.1%、磷酸氢二钠0.1%、柠檬酸氢二铵0.3%、硫酸镁0.05%、硫酸锰0.005%、吐温-80 0.1%、乳化硅油0.2%、碳酸钙0.8%,初始pH值8.0,121℃灭菌30 min。
以上三种培养基组成均在Liu等(2014)和莫海燕等(2013)的研究基础上经过进一步发酵优化研究而得出。
1.3 试验方法
1.3.1 菌种的活化 将保存于甘油管的菌种稀释后涂布于培养皿固体培养基,37℃恒温培养48 h。
1.3.2 种子液制备 用3 mL无菌水从培养皿固体培养基上洗下菌落,取1 mL菌液接入装有50 mL种子培养基的250 mL三角瓶中,37℃、150 r/min培养15 h,获得种子液。
1.3.3 生物反应器发酵培养 按6%的接种量将种子液接入装有6 L发酵培养基的10 L发酵罐中,37℃,通气量0.4 VVM,搅拌转速200~300 r/min,流加5 mol/L NaOH溶液对发酵液的pH进行调控。
1.3.4 pH测定 使用pH电极测定。
1.3.5 发酵液中蔗糖浓度测定 取1 mL发酵液8000 r/min离心15 min,取上清液测定蔗糖的浓度,检测3个平行样品。蔗糖含量测定参考李利军等(2003)的紫外分光光度法。
1.3.6 活菌量 将发酵液按 106、107、1083个梯度进行稀释,取0.1 mL稀释后的发酵液涂布于培养皿固体培养基,每梯度重复3个培养皿,37℃培养 48 h,计数活菌数(cfu/mL)。
2 结果与讨论
2.1 pH对粪链球菌生长的影响 粪链球菌在不同的恒定pH环境(5.7~7.8)下发酵17 h,对比发酵液中粪链球菌的活菌数。研究结果表明,pH为6.6最有利于粪链球菌的生长。Liu等(2014)运用响应面优化的方法优化得出粪链球菌发酵液最佳的pH为6.7。pH低于6.0时,菌体生长受到抑制,生物量降低。6.3~7.5是菌体合适的pH范围,菌体生长良好,发酵液活菌数较高。pH为7.8时发酵液中活菌数降低,但降幅较小(图1)。发酵前期需要流加NaOH溶液中和粪链球菌生成的乳酸,而乳酸钠为强碱弱酸盐,水解后显碱性,为了控制恒定的发酵液pH,发酵后期需流加酸性溶液中和碱性。由于粪链球菌在pH 6.3~7.8生长差异不明显,为了操作简便、成本低廉、环境友好,只需调控发酵液的pH在6.3~7.8即可。

图1 pH对粪链球菌生长的影响
2.2 pH调控与非调控对发酵液pH及NaOH溶液残留量的影响 粪链球菌在pH非调控的自然条件下发酵生长,发酵前10 h,乳酸快速合成,pH下降明显;发酵10 h后,发酵液pH下降至4.67,发酵液pH趋于稳定。配制5 mol/L的NaOH溶液200 mL,中和发酵液中粪链球菌生成的乳酸,调控发酵液的pH为6.3~7.8。粪链球菌在pH调控的条件下发酵生长,当发酵液pH低于6.3时,流加NaOH溶液,控制pH为6.3~7.8。发酵1 h后开始流加NaOH溶液中和乳酸,发酵9 h后停止添加,发酵前5 h流加速率逐渐增加,发酵后4 h流加速率逐渐降低,表明菌体乳酸的合成能力在发酵4 h后达到最大值。发酵9~20 h,发酵液pH从6.49上升至8.33,此过程无需调控发酵液的pH。发酵液pH的升高可能是因为在发酵后期,粪链球菌的乳酸合成能力逐渐下降,新合成的乳酸少,且乳酸钠水解显碱性使发酵液的pH升高。粪链球菌生产只需在发酵前期(前9 h)流加NaOH溶液,使发酵液的pH维持在6.3~7.8,菌体生长良好(图2a、b)。
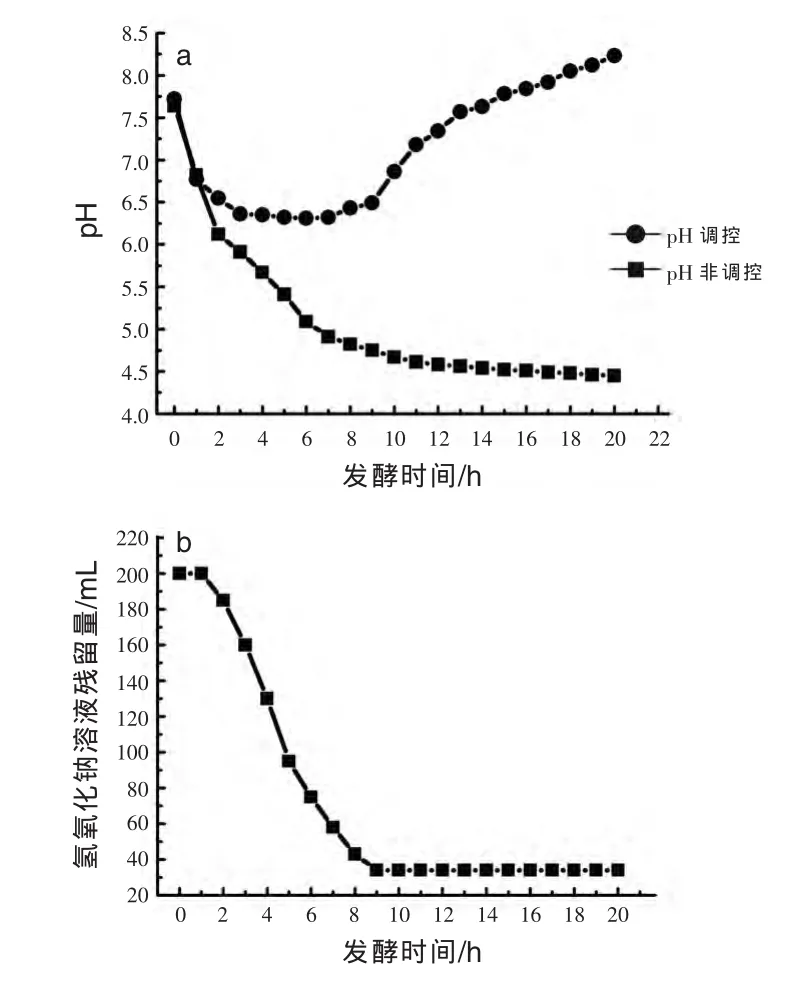
图2 pH调控与非调控对发酵液pH(a)及NaOH溶液残留量(b)的影响
2.3 pH调控与非调控对发酵液溶氧的影响及搅拌转速的变化规律 溶氧(DO)与通气量、搅拌转速和菌体耗氧能力密切相关。在通气量和搅拌转速恒定的情况下,溶氧水平能反映粪链球菌的耗氧能力。pH非调控,发酵前6 h,搅拌转速恒定于200 r/min,发酵液溶氧从83%下降到54.3%。为了使碳酸钙与乳酸充分混合,中和乳酸,发酵6 h后搅拌转速缓慢提升至250 r/min,溶解氧逐步上升至79.7%;发酵7~10 h过程中,溶氧缓慢下降;发酵10~20 h时,溶氧缓慢上升,菌体耗氧能力下降。pH调控发酵生产粪链球菌,发酵前3 h,转速恒定于200 r/min,发酵前3 h发酵液溶氧从85.7%快速下降至20.9%;发酵3 h后,搅拌转速缓慢提升至250 r/min,发酵7 h后,搅拌转速缓慢提高至300 r/min。发酵10 h后,发酵液的溶解氧开始缓慢上升,表明菌体耗氧能力下降,菌体生长速率下降。研究结果表明,控制发酵液的pH为6.3~7.8,能降低发酵液的溶氧,增加菌体的耗氧量,有利于菌体生长(图 3a、b)。
2.4 pH控制与非调控对蔗糖代谢的影响 Rea和Cogan(2003)研究表明,培养基中葡萄糖和果糖能抑制粪链球菌对柠檬酸盐的代谢,而蔗糖和半乳糖对柠檬酸盐的代谢无抑制作用。同时蔗糖相对于葡萄糖为缓释碳源,能降低乳酸的合成速率,有利于粪链球菌的生长。因此,本研究用蔗糖取代葡萄糖,作为发酵生产粪链球菌的碳源。发酵过程pH非调控时,发酵前16 h,蔗糖的平均代谢速率为1.23 g/L·h。发酵前12 h蔗糖的代谢速率快,主要满足于菌体的生长;发酵12 h后蔗糖代谢速率开始降低,主要满足于菌体自身生存的需要。发酵过程pH调控时,发酵前16 h,蔗糖的平均代谢速率为1.48 g/L·h,菌体生长快速;发酵16 h后,蔗糖分解速率开始降低,菌体生长进入稳定期,能量需求下降(图4a)。

图3 pH调控与非调控对发酵液溶氧的影响(a)及搅拌转速的变化规律(b)
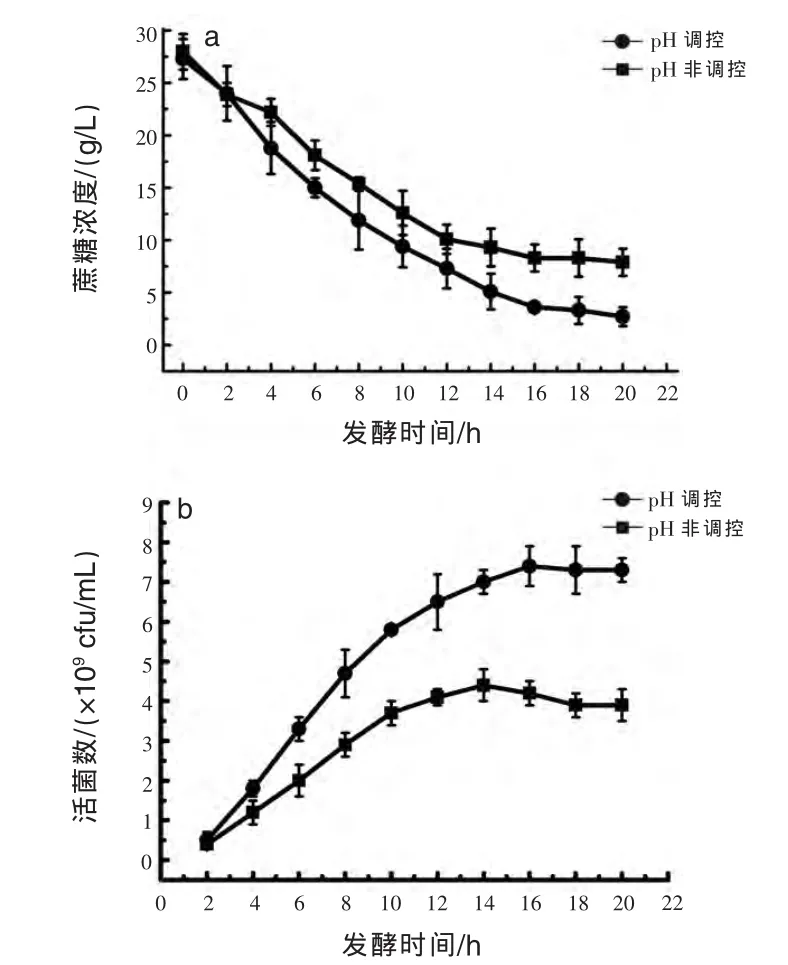
图4 pH调控与非调控对蔗糖代谢(a)及发酵液活菌数(b)的影响
2.5 pH调控与非调控对发酵液活菌数的影响pH是菌体生长的关键因素,不调控发酵液的pH,随着pH的降低,菌体细胞的耗氧能力下降,蔗糖代谢的能力下降,发酵10 h,pH降至4.67,菌体生长受到抑制。发酵14 h后菌体生长进入稳定期,发酵液中活菌数为4.4×109cfu/mL。莫海燕等(2013)研究表明,粪链球菌达到稳定期的时间为18~20 h。调控发酵液的pH维持在6.3~7.8,能提高菌体细胞的活力,增加菌体的蔗糖代谢能力和耗氧能力,提高了菌体的生长速率,延长了菌体的对数生长期,发酵16 h后,菌体生长进入稳定期,发酵液的活菌数达到7.3×109cfu/mL(图4b)。可见,调控发酵液的pH,发酵液的活菌数提高了65.9%。
3 结论
本试验结果表明,pH低于4.67时,粪链球菌生长受到抑制,进入衰老期。发酵1~9 h,流加NaOH溶液,调控发酵液的pH于区间为6.3~7.8,能增加发酵液中粪链球菌活菌数,较非调控提高65.9%。采用该pH调控方法发酵生产粪链球菌,效果良好、成本低廉、操作简单、重复性好。
[1]李利军,孔红星,伍时华,等.蔗糖测定的紫外分光光度新方法研究及应用[J].分析科学学报,2003,19(4):367 ~ 369.
[2]莫海燕.饲用粪肠球菌,戊糖片球菌发酵工艺研究:[硕士学位论文][D].新疆:石河子大学,2013.
[3]Franz C M,Huch M,Abriouel H,et al.Enterococci as probiotics and their implications in food safety[J].Int J Food Microbiol,2011,151(2):125 ~ 140.
[4]Liu X,Wang Y,Wang H,et al.Effect of a liquid culture of Enterococcus faecalis CGMCC1.101 cultivated by a high density process on the performance of weaned piglets[J].Livest Sci,2014,170:100 ~ 107.
[5]Rea M C,Cogan T M.Catabolite repression in Enterococcus faecalis[J].Syst Appl Microbiol,2003,26(2):159 ~ 164.
[6]Swain S M,Singh C,Arul V.Inhibitory activity of probiotics Streptococcus phocae PI80 and Enterococcus faecium MC13 against Vibriosis in shrimp Penaeus monodon[J].J Ind Microbiol Biot,2009,25(4):697 ~ 703.
