羊棘球蚴(包虫)间接ELISA抗体检测试剂盒的研制
2015-12-25邓灿新田东升李春燕赵扬扬曾仁权
邓灿新, 田东升, 李春燕, 赵扬扬, 曾仁权*, 曹 政*
(1.西南大学荣昌校区动物医学系,重庆 402460;2.重庆澳龙生物制品有限公司,重庆 402460)
羊棘球蚴(包虫)间接ELISA抗体检测试剂盒的研制
邓灿新1, 田东升1, 李春燕2, 赵扬扬2, 曾仁权1*, 曹 政2*
(1.西南大学荣昌校区动物医学系,重庆 402460;2.重庆澳龙生物制品有限公司,重庆 402460)
摘要[目的]研制基于Eg95重组蛋白为检测抗原的羊棘球蚴(包虫)间接ELISA抗体检测试剂盒。[方法]以细粒棘球蚴Eg95重组蛋白为检测抗原,筛选间接ELISA的最佳反应条件,确定ELISA的判定标准,检测敏感性和重复性,组成、包装试剂盒并初步应用。[结果]建立的ELISA方法特异性强、敏感性高、重复性好,检测阳性血清和阴性血清的准确率均为100%。[结论]研制的羊棘球蚴(包虫)病ELISA抗体检测试剂盒可用于细粒棘球蚴Eg95亚单位疫苗抗体水平的检测。
关键词细粒棘球蚴;Eg95蛋白;试剂盒;ELISA
10002)。
我国是世界上棘球蚴病最严重的国家之一,我国西北地区(如甘肃、新疆、宁夏、内蒙古、青海、四川、陕西、西藏等),棘球蚴病尤为严重[1]。棘球蚴病是我国卫生部规划防治的五大寄生虫病之一,现已证实全国有31个省(市、区)存在包虫病感染病例,有100多万包虫病现症患者,受威胁人口达几千万,包虫病畜超过4 000万头,每年新发病畜达800多万头,年经济损失超过10亿元。该病已成为西部牧区群众因病致贫、因病返贫的主要原因[2-3]。对动物棘球蚴病的生前诊断比较困难,疫苗免疫已成为预防与控制棘球蚴病的重要途径,但是国内还没有相应的检测试剂盒来评价疫苗的免疫效果,这就亟需准确、有效的诊断方法的出现。为了建立简单、有效的ELISA抗体检测试剂盒,用于对疫苗的免疫效果进行及时监测,为羊棘球蚴(包虫)病基因工程亚单位苗提供了配套的检测方法以评价疫苗的免疫效果,利用Eg95抗原的特异性和ELISA方法的快速、灵敏特点相结合研制出间接ELISA抗体检测试剂盒,旨在为促进细粒棘球蚴(包虫)病基因工程亚单位苗的应用及包虫病的预防发挥重要作用。
1材料与方法
1.1重组Eg95蛋白和绵羊血清细粒棘球蚴Eg95重组蛋白,保存于-70 ℃冰箱中备用;绵羊血清均采自四川省邛崃市非疫区,保存于-20 ℃备用[4]。
1.2主要试剂HRP酶稳定剂和proclin300防腐剂均购自上海闪晶分子生物科技有限公司;包被缓冲液(pH9.6、0.05 mol/L的碳酸盐缓冲液、TMB底物溶液、25×洗涤缓冲液(PBST)、样品稀释液、终止液、酶标二抗、标准阴性血清和阳性血清。
1.3阴性血清和阳性血清的制备取未注射Eg95基因工程亚单位苗、未感染包虫病的绵羊血清,经Western blot方法鉴定为阴性,即为阴性血清。SDS-PAGE电泳加样时,仅加入蛋白Mark与纯化后Eg95重组蛋白,转膜、分割后用于后续试验,第7步用1∶600倍稀释的待检血清作为一抗替代HRP标记的抗His标签鼠单克隆抗体溶液,37 ℃摇动(70 r/min)孵育1 h后,用PBST漂洗3次,用封闭液1∶2 000稀释的HRP标记的兔抗绵羊IgG作为二抗,37 ℃摇动(70 r/min)孵育1 h后,用PBST漂洗3次,加入TMB底物显色。
用Eg95基因工程亚单位苗对绵羊进行二次免疫,二免后1个月采血分离血凊,作为备选血清,选取60份备选血清和30份阴性血清用间接ELSA法测其OD450值。
1.4间接ELISA最佳反应条件的筛选
1.4.1棋盘法确定抗原包被量及血清稀释度。用包被缓冲液将纯化到的重组Eg95蛋白分别作0.5、1、2、4 μg/ml 4个倍比稀释度,包被酶标板,37 ℃温育1 h,然后4 ℃下过夜。用血清稀释液将阳性血清及阴性血清分别进行1∶50、1∶100、1∶200、1∶400倍比稀释,组成方阵。其余条件不变,按照ELISA程序操作。结果判定以阳性血清OD450值(P)为1.000左右,阴性血清OD450值(N)低,且P/N值最大时的重组Eg95蛋白包被浓度和血清稀释度为最佳条件。
1.4.2血清最佳作用时间的确定。在最适抗原浓度和血清稀释度的基础上,将血清作用时间分别设定为30、45、60 min,其他步骤按照ELISA程序操作,测定OD450值,按照判断标准比较分析数据,以确定血清作用的最佳时间[5-6]。
1.4.3酶标二抗稀释度及作用时间的确定。已确定的条件不变,将酶标二抗进行 1∶5 000、1∶10 000、1∶15 000稀释(即将二抗保护剂稀释后的二抗进行1∶50、1∶100、1∶150稀释),分别于37 ℃条件下反应30、45、60 min,进行ELISA试验,测定OD450值,以确定酶标二抗的稀释度和作用的最佳时间。
1.4.4显色时间的确定。已确定的条件不变,将底物于37 ℃条件下作用时间设定为5、10、15、20 min,进行ELISA试验,终止反应后,比较分析数据,以确定底物作用的最佳时间。
1.5ELISA判定标准的确定用 60份阴性绵羊血清为样本按照已建立的方法进行检测,对检测结果进行分析,确定阴性和阳性的判定标准。
1.6敏感性检测用ELISA方法检测1份阳性血清,从1∶200开始进行一系列稀释后作为一抗,确定能够检测出阳性的最高血清稀释度。
1.7阻断试验选取3份按1∶100稀释阳性血清各100 μl,分别加入100 μl 10 μg/ ml重组Eg95蛋白,37 ℃下温育1 h,然后8 000 r/min离心5 min,取100 μl上清作为一抗应用该ELISA方法进行检测。同时,设置未阻断的1∶200稀释的阳性血清作为对照,比较2组血清的OD450值,观察重组蛋白能否阻断阳性血清反应。
1.8重复性检测
1.8.1批内重复性检测。取3份不同效价的绵羊阳性血清和3份绵羊阴性血清,每份血清作8个孔,用同一批包被的酶标板在相同条件下同时进行批内重复试验,计算标准差和变异系数。
1.8.2批间重复性检测。取3份不同效价绵羊阳性血清和1份绵羊阴性血清,每份绵羊血清作2个重复,用5个不同批次包被的酶标板,在相同条件下同时进行批间重复试验,计算标准差和变异系数。
1.9ELISA方法的初步应用随机选取45份Eg95亚单位苗二免四周后绵羊血清用建立的ELISA方法进行检测;随机选取 30份未免疫未患棘球蚴病绵羊血清30份进行ELISA检测。
1.10羊棘球蚴(包虫)间接ELISA抗体检测试剂盒的组成及包装酶标板室温晾干后,用锡箔袋真空干燥(加干燥剂)包装酶标板,血清稀释版为没有包被抗原酶标板。试剂盒的组成如表1所示,试剂盒示意图见图1。
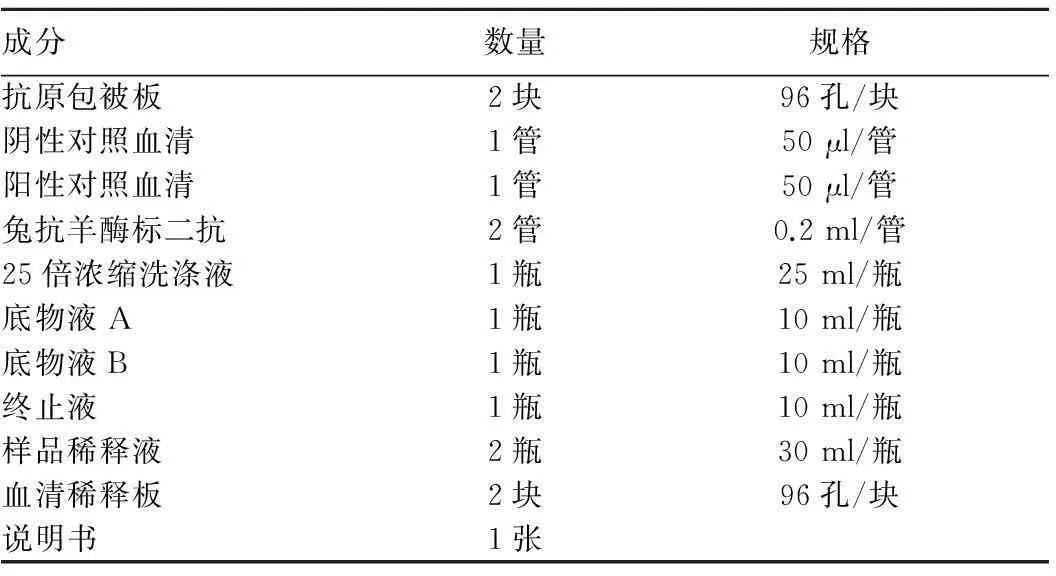
表1 试剂盒的组成
1.11试剂盒的保存期试验将同一批次制备的试剂盒置于4 ℃下保存,每月各取1个试剂盒,按照试剂盒说明书作标准阴阳性对照,并对同一份阳性血清进行敏感性测定,观察其敏感性的变化,以确定试剂盒的保存期限。
2结果与分析
2.1间接ELISA最佳反应条件的筛选结果
2.1.1Eg95重组蛋白的包被量和抗血清稀释度的确定。由表2可知,包被抗原浓度为 2 μg/ml、血清1∶200 稀释时,阳性血清OD450值在 1.000 左右,阴性血清OD450值较低,P/N值最高。因此,试验确定抗原的最佳包被浓度为 2 μg/ml,血清的最佳稀释度为 1∶200。
2.1.2血清最佳作用时间的确定。由表3可知,当血清作用时间为45 min时,阳性血清OD450(P)值在 1.000 左右,阴性血清OD450值(N)较低,且P/N值最大。因此,确定45 min为待测血清的最佳作用时间。
2.1.3酶标二抗稀释度及作用时间的确定。由表4可知,当酶标二抗以 1∶10 000 稀释作用 30 min 时,阳性血清OD450值(P)在 1.000 左右,阴性血清OD450值(N)较低,且P/N值最大。因此,确定酶标二抗以 1∶10 000 稀释,作用时间为30 min。

表2 抗原最适包被浓度及血清最佳稀释度的确定

表3 血清最佳作用时间的确定

表4 酶标抗体工作浓度及作用时间的确定
2.1.4底物最佳显色时间的确定。由表5可知,当显色时间为10 min时,P/N值最大,且阳性血清OD450值(P)也在1.000左右,阴性血清OD450值(N)较低。因此确定底物最佳显色时间为10 min。

表5 底物显色时间的确定
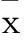
2.3敏感性检测结果取1份绵羊阳性血清从1∶200倍开始倍比稀释,进行间接ELISA检测。从图3可以看出,当血清稀释度为1∶25 600时结果仍为阳性。这表明建立的方法具有较好的敏感性。
2.4阻断试验结果用包被抗原蛋白和已知阳性血清进行阻断反应,结果表明,经重组Eg95蛋白处理过的3份阳性血清OD450值分别下降90.76%、90.53%和89.95%,表明该试验建立的间接ELISA方法具有良好的特异性。
2.5重复性检测结果
2.5.1批内重复试验结果。针对建立的间接ELISA方法进行批内重复性试验,结果表明6份绵羊血清测得OD450值的变异系数为2.24%~5.56%,均低于10%,表明该间接ELISA方法批内重复性良好。
2.5.2批间重复试验结果。针对建立的间接ELISA方法进行批内重复性试验,结果表明4份绵羊血清测得OD450值的变异系数为5.40%~8.67%,均小于 10%,表明该间接ELISA方法的批间重复性良好。
2.6ELISA方法的初步应用结果用建立的ELISA方法对45份二免后绵羊血清和30份未免疫健康绵羊血清进行检测,结果表明二免后绵羊血清OD450值为0.595~1.608,均大于临界值,判定为阳性;未免疫绵羊血清OD450值为0.060~0.147,均小于临界值,判定为阴性。
2.7羊棘球蚴(包虫)间接ELISA抗体检测试剂盒的使用方法①取抗原包被板,分别将稀释好的待检血清和标准对照各取100 μl加入到酶标板孔中,阴性对照和阳性对照各设2孔,轻轻振匀孔中样品(勿溢出),置于37 ℃条件下温育45 min;②取出96孔酶标板,倾去孔内液体,在吸水纸上拍干后每孔加入稀释过的1×洗涤液 200 μl,轻轻振匀孔中液体(勿溢出),每次洗板2 min,每次洗完在干净吸水纸上拍干,共计洗板3次;③将兔抗绵羊酶标二抗用稀释液稀释100倍,混匀,每孔加酶标二抗100 μl,置于37 ℃条件下温育30 min;④洗板,方法同上,但需洗4次;⑤将底物A、底物B按1∶1的比例混匀后,每孔加入100 μl,37 ℃条件下避光显色10 min;⑥每孔加入终止液50 μl,10 min内在酶标仪上测各孔OD450值;⑦结果判定:标准阳性血清血清OD450值≥0.6,标准阴性血清OD450值≤0.159,ELISA试验成立,样品OD450值≥0.196时,判为阳性;当OD450值≤0.159时,判为阴性;若样品OD450值介于二者之间则判为可疑,需重新检测,若检测结果仍小于 0.196则判定为阴性。
2.8试剂盒保存期的试验结果由表6可知,7次ELISA试验标准阳性血清及标准阴性血清均成立,且保存6个月后检测标准阳性血清能检出为阳性的最高稀释度为1∶25 600,到第7个月标准阳性血清能检出为阳性的最高稀释度下降到1∶12 800,说明试剂盒的检测效果略有下降。这表明试剂盒在4 ℃条件下至少可以保存6个月。

表6 试剂盒保存期的测定结果
3讨论
ELISA检测试剂盒包被所用的抗原要求必须有优质和稳定等特点,纯度较高,抗原的纯度直接关系到ELISA试验的特异性和敏感性。抗原包被的浓度也对试验结果有着较大的影响。若抗原包被浓度过低,就会留下未吸附的抗原固相载体影响试验效果;若抗原包被浓度过高,就会使蛋白分子产生多层化现象,使蛋白容易被洗掉,从而出现非特异反应及造成抗原的浪费。通过对比0.5、1.0、2.0、4.0 μg/ml 4个包被浓度的试验结果,确定的最佳包被浓度为2 μg/ml。
若要得到准确而且重复性好的试验结果,就要求血清样品必须以一个最佳的稀释度来进行试验。经过对比1∶50、1∶100、1∶200和1∶400 4个稀释度和30、45、60 min 3个作用时间的试验结果发现1∶200倍稀释血清、作用45 min效果最佳。因此,试验选用1∶200来稀释血清,37 ℃作用45 min。另外,待测血清的保存对ELISA试验也非常关键,若对血清的保存不当将会导致假阳性和假阴性的结果出现,保存血清应添加防腐剂,少量分装后保存于-20 ℃条件下,避免反复冻融。
酶标二抗也是影响试验结果的重要因素。若酶标二抗浓度太低,不足以充分与血清中抗体结合;若酶标二抗浓度太高,又会造成非特异性吸附。经过对比1∶5 000、1∶10 000和1∶15 000 3个稀释度和30、45及60 min 3个作用时间的试验结果发现1∶10 000稀释酶标二抗及二抗37 ℃作用30 min效果最佳,因此试验选用1∶10 000来稀释酶标二抗,37 ℃下作用30 min。
敏感性、特异性与重复性是建立ELISA方法时必须要检测的项目,是ELISA方法能否成功建立的关键。笔者将阳性血清稀释25 600倍时,仍能检测为阳性,说明建立的ELISA敏感性高。该试验用阻断试验来反应ELISA的特异性,所用Eg95蛋白对阳性血清的阻断率在90%左右,说明Eg95蛋白能特异性阻断阳性血清,表明该ELISA方法的特异性强;该试验的批内及批间重复性试验表明变异系数均在2.24%~8.67%,均不超过10%,与张先锋、吴洋、王芳等建立的ELISA方法的重复性相符,说明建立的ELISA方法的重复性良好[10]。试剂盒保存期的长短是影响试剂盒产业化的重要因素之一,也是试剂盒能否过关的关键因素。该试验建立的间接ELISA试剂盒在4 ℃条件下保存6个月后,敏感性无变化,表明试剂盒在4 ℃条件下可以保存6个月,与其他ELISA商品化试剂盒的保存期相近。
该ELISA方法对45份二免后绵羊血清进行检测,结果均为阳性;对30份来自非疫区未免疫的健康绵羊血清进行检测,结果均为阴性。这说明该ELISA方法可用于细粒棘球蚴Eg95亚单位疫苗抗体水平的检测。但是,由于目前还没有检测细粒棘球蚴Eg95亚单位疫苗抗体的商品化试剂盒问世,所以笔者的建立ELISA方法还不能与其他ELISA检测方法相比。
参考文献
[1] 王颖旺,杨光友,蒋忠荣,等.细粒棘球绦虫基因型与抗原研究进展[J].中国动物传染病学报,2010,18(1):79-86.
[2] WANG Z,WANG X,LIU X.Echinococcosis in China,a review of the epidemiology of Echinococcus spp.[J].Ecohealth,2008,5(2):115-126.
[3] 张先军.包虫病危害与预防[J].畜牧兽医杂志,2012(1):114-116.
[4] 贾海英,马秀敏,丁剑冰,等.细粒棘球蚴Eg95重组蛋白表达及其血清学反应的研究[J].中国人兽共患病学报,2009,25(4):344-347.
[5] 刘红霞,张德祯,闫鸿斌,等.细粒棘球绦虫重组EG95抗原在绵羊绦虫蚴病血清抗体检测中的应用[J].中国兽医科学,2012(9):911-915.
[6] 贾红,刘丹,侯绍华,等.羊细粒棘球蚴病抗体间接ELISA检测方法的建立[J].畜牧兽医学报,2011,42(1):65-70.
[7] 明道绪.生物统计附试验设计[M].4版.北京:中国农业出版社,2009:32.
[8] 胡小华,李刚,史利军,等.猪圆环病毒2型间接ELISA抗体检测试剂盒的研制及初步应用[J].中国畜牧兽医,2011,38(3):120-123.
[9] 吴忆春.猪繁殖与呼吸综合征病毒重组M蛋白间接ELISA抗体检测方法的建立及应用[J].中国畜牧兽医,2013,40(7):51-55.
[10] 王芳,雷震,于力,等.山羊痘病毒p32基因原核表达及间接ELISA抗体检测方法的建立[J].中国预防兽医学报,2009,31(12):945-948.
中图分类号S859.79+5文献标识码A文章编号0517-6611(2015)30-105-04
基金项目重庆市农业科技成果转化资金项目(cstc2015jcsf-nycgzhA
作者简介邓灿新(1990- ),男,广西梧州人,硕士研究生,研究方向:动物病原生物学。 *通讯作者,曾仁权,教授,博士,硕士生导师,从事动物药物化学研究。*通讯作者,曹政,研究员,博士,从事微生物分子生物学研究。
收稿日期2015-08-31
The Development of the Indirect ELISA Test Kit forEchinococcusgranulosusAntibody
DENG Can-xin1,TIAN Dong-sheng1,LI Chun-yan2,ZENG Ren-quan1*,CAO Zheng2*et al (1.Department of Veterinary Medicine,Southwest University,Chongqing 402460; 2.Chongqing Auleon Biological Company Limited,Chongqing 402460)
Abstract[Objective] This study was designed to develop an indirect ELISA kit for detecting antibodies against Echinococcus granulosus using recombinant EG95 protein as antigen.[Method] Eg95 recombinant protein as antigen,determined the optimal reaction conditions and criterion of indirect ELISA,detection sensitivity,repeatability,detected its sensitivity and repeatability.[Result] The ELISA method is high specificity,sensitivity,accuracy(100%) and good repeatability.[Conclusion] This ELISA kit could be used to monitor the immune status of the echinococcosis Eg95 genetic engineering subunit vaccine.
Key wordsEchinococcus granulosus; Eg95 protein; Kit; ELISA
