下调E2-EPF水平对宫颈癌Caski细胞生物学行为的影响
2015-12-24梁静李琳吴丽杰凌斌孙霭萍
梁静,李琳,吴丽杰,凌斌,孙霭萍
(中日友好医院妇产科,北京 100029)
泛素化是一个具有普遍意义的免疫生物学现象,细胞内蛋白质泛素化降解是蛋白质重要的转录后修饰方式之一,泛素-蛋白酶体途径参与调节细胞周期进程、细胞增生与分化,以及信号传导等多种细胞生理过程[1]。泛素系统的紊乱与肿瘤的发生密切相关。
泛素结合酶E2-EPF(ubiquitin-conjugating enzyme E2-EPF)是E2泛素结合酶家族成员之一,在多种肿瘤组织中高表达[2-3],无论是在常氧还是低氧情况下,都可以抑制抑癌基因von Hippel-Lindau[4],稳定低氧诱导因子-1α(HIF-1α),启动HIF-1α下游反应链,从而促进肿瘤的生长和侵袭[5-7]。前期研究中我们发现,E2-EPF 在宫颈癌组织中呈高表达状态,其表达水平与临床分期和病理分级密切相关,并参与肿瘤细胞的增殖、侵袭等[8]。但有文献报道,在不同的宫颈癌细胞株中E2-EPF 的作用存在差异[9-10]。因此,我们再次通过siRNA 下调Caski细胞株中E2-EPF 的表达,研究其在细胞周期、细胞增殖以及放、化疗反应等方面的影响,探讨E2-EPF在宫颈癌中的作用。
资料和方法
一、材料
1.试剂:E2-EPF-siRNA 质粒、对照质粒及转染试剂盒、羊抗兔多克隆抗体(Santa Cruz,美国);Isogen试剂(Nippon Gene,日本);逆转录试剂盒、E2-EPF探针、GAPDH 探 针 及PCR 反 应 试 剂(Applied Biosystems,美 国);M-PER 蛋 白 提 取 剂 及BCA 蛋白定量试剂盒(Pierce,美国);蛋白酶抑制剂(Roche,美国);E2-EPF C-term 抗体及β-actin抗体(ABGENT,美国);RPMI 1640培养基、Opti-MEM低血清培养基(Gibco,美国);MTT 细胞增殖实验试剂盒(Promega,美国);Annexin V-FITC 凋亡试剂盒(武汉华美生物)。
2.细胞系来源及培养:人类宫颈癌细胞Caski(日本东京医科大学),培养于含有10% FBS 的RPMI-1640培养基中,37℃,5%CO2。
二、实验方法
1.细胞转染:收集对数期生长期的Caski细胞,按3×105/孔种于6 孔板中,培养于含有10%FBS的RPMI-1640培养基中,37℃,5%CO2。24h后,取100μl E2-EPF-siRNA(siRNA 组)和对照质粒(对照组),按说明分别进行瞬时转染。
2.实时荧光定量PCR:按说明提取两组细胞总RNA,以 波 长A260/280 进 行 定 量。取1 μg 总RNA 进行逆转录。E2-EPF 探针上游序列为:5’-C GACCTCCAGGTCACCAT-3’;下游序列为:5 ’-GGAACAGACCTCCAGCATATGG-3 ’。 以GAPDH作为内参,于StepOnePlus Real-time PCR system 中进行扩增,扩增条件是:95℃10min;95℃15s,50℃10s,60℃1min,40个循环。以StepOne software v2.0进行定量分析。
3.Western blot:将M-PER 蛋白提取液和蛋白酶抑制剂按50ml∶1片的比例制成混合液加于两组细胞沉淀中,于冰上裂解30min后,14 800 g 离心15min,取上清,BCA 试剂盒进行蛋白定量。两组细胞分别提取30μg总蛋白,进行SDS-PAGE 电泳,一抗E2-EPF C-term浓度1∶250,4℃摇床孵育过夜,二抗浓度1∶500,室温摇床孵育30min。以β-actin为内参。
4.细胞周期检测:将两组细胞消化分离成单细胞悬液,离心收集细胞,以70%乙醇固定过夜。4ml PBS 洗 涤 细 胞 两 次,加 入 含 有100 μg/ml RNase A 的100μg/ml碘化丙啶染液,孵育30min。流式细胞仪分析细胞周期。
5.细胞增殖实验:将1×103Caski细胞接种于96孔板,6h后分别转染E2-EPF-siRNA 质粒和对照质粒,继续培养1~9d后,按说明进行MTT 实验,于酶标仪上测量570nm OD 值。每组设3个复孔,重复3次,取平均值。
6.放疗后细胞死亡与凋亡检测:取3×105的Caski细胞种于6孔板中,6h后分别转染E2-EPFsiRNA 质粒和对照质粒,于37℃,5%CO2培养24h后,将两组细胞分别经0Gy、4Gy、7Gy、10Gy 4个不同剂量X 线照射,继续培养24h、48h 和96h。取2×105细胞,PBS洗涤,400μl结合缓冲液悬浮后,加入5μl Annexin V-FITC,室温避光10 min,再加入5μl碘化丙啶,流式细胞仪检测细胞死亡和凋亡比例。每组设3复孔,重复3次,取平均值。
7.化疗药物实验:取2×104Caski细胞种于96孔板中,6h后分别转染E2-EPF-siRNA 质粒和对照质粒,37℃、5%CO2培养24h。加入不同浓度的顺铂(Cisplatin,5μmol/L、20μmol/L、40μmol/L),或紫杉醇(Taxol,10nmol/L、20nmol/L、50nmol/L),或 拓 扑 替 康(Topotecan,0.5nmol/L、1nmol/L、2nmol/L),或 依 托 铂 苷(Etoposide,0.5 μg/ml、5μg/ml、15μg/ml),24h后进行MTT 检测细胞相对数量。细胞存活率以加药组OD/未加药组OD×100%表示。不同药物剂量的两组细胞均行3复孔,重复3次实验,取平均值。
三、统计分析
结 果
一、siRNA 下调Caski细胞内E2-EPF水平
通过RNAi 技术下调Caski 细胞内源性E2-EPF水平,并分别通过Real-time PCR 和Western blot在mRNA 和蛋白水平上进行验证(图1)。
二、流式细胞周期检测及细胞增殖实验
下调E2-EPF水平后,细胞内G0-G1期细胞百分比显著增加;S和G2-M 期细胞总数比例减少(图2);细胞的生长速率明显低于对照组,再次证实了E2-EPF参与Caski细胞生长的调节(图3)。
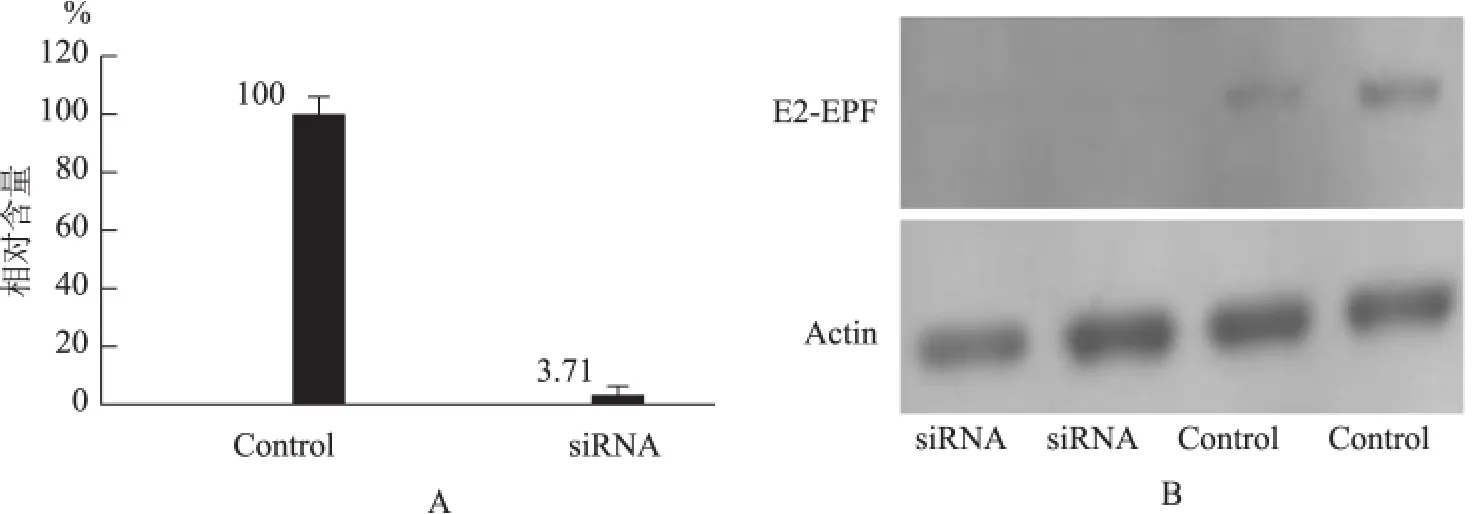
图1 Caski细胞株转染E2-EPF-siRNA 质粒后内源性E2-EPF的表达情况
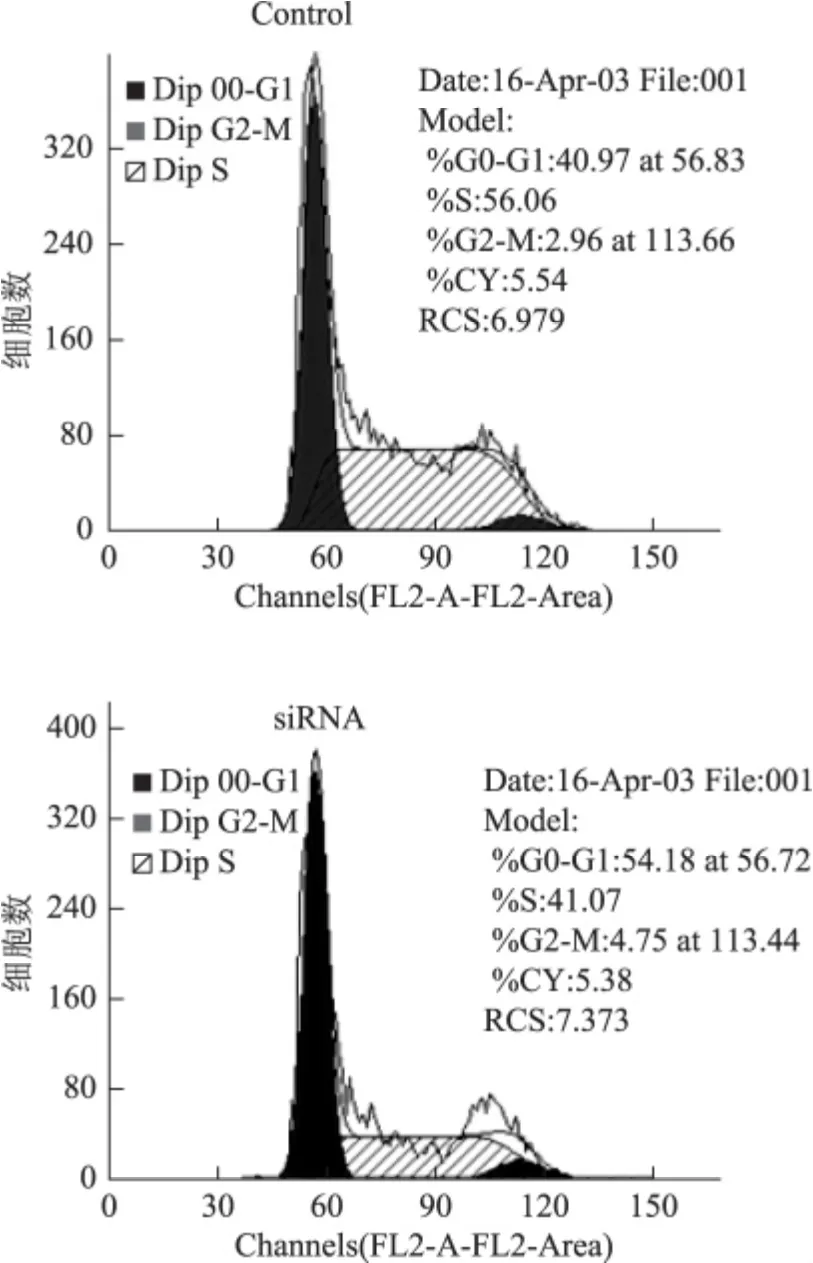
图2 Caski细胞株转染E2-EPF-siRNA质粒后细胞周期检测
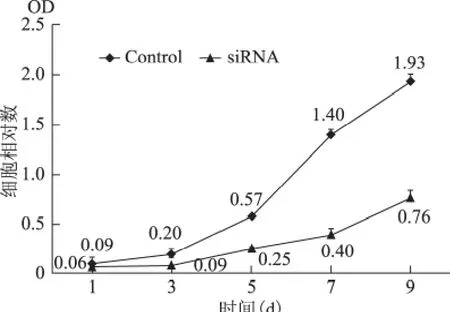
图3 Caski细胞株转染E2-EPF-siRNA质粒后细胞增殖MTT 实验
三、X 线放疗实验
经不同剂量(0Gy、4Gy、7Gy、10Gy)X 线照射后,未发现下调细胞内源性E2-EPF 对细胞死亡及凋亡的影响。两组细胞经照射后24h,细胞死亡与凋亡检测结果如图4。照射后48h及96h,两组间细胞死亡与凋亡也无明显差异(数据未显示)。
四、化疗药物实验
下调Caski细胞内源性E2-EPF水平对紫杉醇和顺铂的反应无明显作用,但能增强对Topotecan-拓扑异构酶I抑制剂和Etoposide-拓扑异构酶II抑制剂的敏感性(图5)。
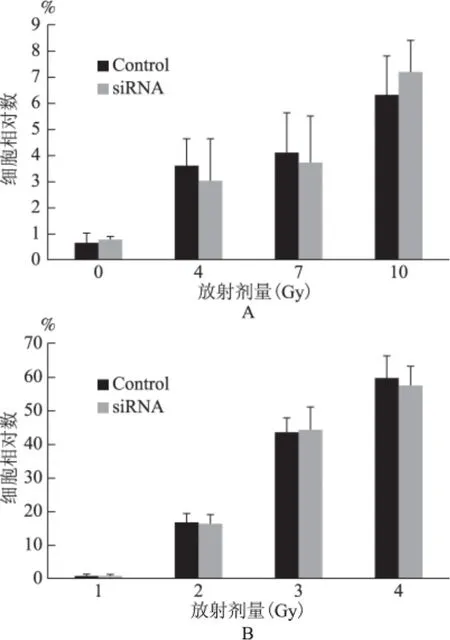
图4 不同剂量放疗处理24h对于转染E2-EPF-siRNA质粒Caski细胞株的影响
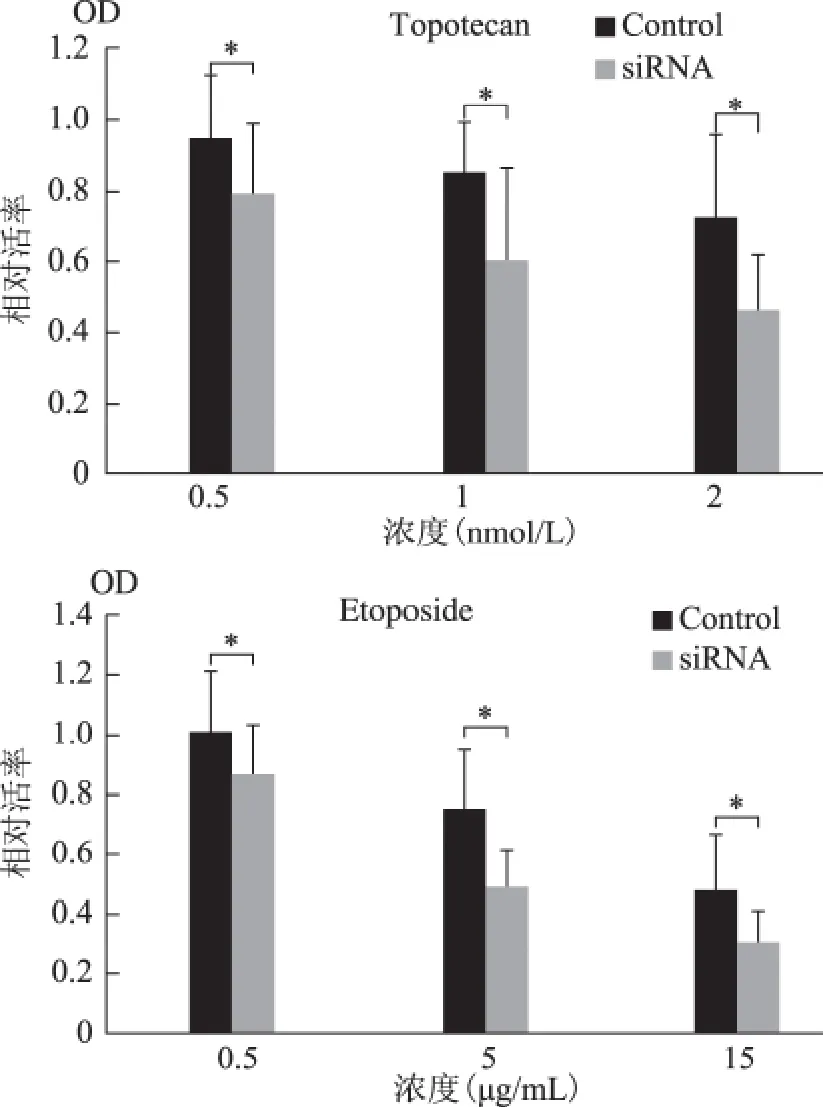
图5 不同浓度Topotecan和Etoposide作用24h对两组细胞活率的影响
讨 论
近年陆续有报道,E2-EPF 在乳腺癌和食道癌组织中也参与肿瘤的生长和转移,但是对宫颈癌Hela细胞的生长作用结果不一[9-10]。前期研究已经证实E2-2PF 在宫颈鳞癌组织中呈高表达水平,其表达水平与临床分期和病理分级密切相关,为了进一步研究E2-EPF 在不同宫颈癌细胞株中的作用,本文再次针对Caski进行研究。利用RNAi瞬时转染技术,下调Caski细胞株内E2-EPF水平,可以调控细胞的生长周期,减缓细胞的生长速度。由此可见,E2-EPF参与Caski细胞周期的调控及细胞的增殖,对于肿瘤细胞的生长有重要的意义。
Topotecan作为拓扑异构酶Ⅰ的抑制剂可以与拓扑异构酶I-DNA 三元复合物结合,从而阻碍断裂DNA 单链的重新连接,并影响拓扑异构酶I的再循环利用,使哺乳动物细胞无法有效地修复损伤的DNA 双链,最终导致细胞死亡[11-13]。细胞毒性作用主要作用于DNA 合成的S期,同样也作用于DNA损伤后的修复和基因表达过程[13]。由于拓扑异构酶I的浓度在增生期细胞中随整个细胞周期保持稳定,在静止期细胞中此酶也有表达,因此对增殖缓慢及耐药的实体瘤均有潜在作用[14]。本实验中,在0.5nmol/L、1nmol/L 和2nmol/L 三 个 浓 度 的Topotecan作用下,siRNA 组与对照组间均有显著差异。
Etoposide作用于DNA-拓扑异构酶II,形成药物-酶-DNA 复合物,阻碍DNA 修复造成DNA 链断裂,作用于哺乳动物细胞周期的G2期[15]。高浓度(≥10μg/ml)时,Etoposide使进入有丝分裂期的细胞溶解,而低浓度(0.3~10μg/ml)时,则抑制细胞进入有丝分裂的前期。本实验中,在0.5μg/ml、5 μg/ml和15μg/ml三个不同浓度下,下调E2-EPF使细胞对Etoposide的敏感性均显著增加,这一结果与其药理特性相吻合。
结合前期研究结果[8],在宫颈鳞状细胞癌中,E2-EPF参与细胞周期的调控与细胞增殖,对肿瘤的生长有重要意义。下调细胞内源性E2-EPF,可以使HIF-1α蛋白水平下降,明显减弱细胞的增殖、侵袭和体外成瘤性,并可以增强细胞对拓扑异构酶I抑制剂和拓扑异构酶II抑制剂的敏感性。
【致谢】 本实验部分于日本东京医科大学產婦人科实验室完成,特别感谢井本惠一教授、西洋孝医师及樋熊千夏给予的支持及帮助。
[1] Brown JS,Jackson SP.Ubiquitylation,neddylation and the DNA damage response[J].Open Biol,2015.5:DOI:10.1098/rsob.150018.
[2] Welsh JB,Zarrinkar PP,Sapinoso LM,et al.Analysis of gene expression profiles in normal and neoplastic ovarian tissue samples identifies candidate molecular markers of epithelial ovarian cancer[J].Proc Natl Acad Sci U S A,2001,98:1176-1181.
[3] Liu Z,Diaz LA,Haas AL,et al.cDNA cloning of a novel human ubiquitin carrier protein.An antigenic domain specifically recognized by endemic pemphigus foliaceus autoantibodies is encoded in a secondary reading frame of this human epidermal transcript[J].Biol Chem,1992,267:15829-15835.
[4] Ohh M.pVHL’s kryptonite:E2-EPF UCP[J].Cancer Cell,2006,10:95-97
[5] Roos FC,Evans AJ,Brenner W,et al.Deregulation of E2-EPF Ubiquitin Carrier Protein in Papillary Renal Cell Carcinoma[J].Am J Pathol,2011,178:853-860.
[6] Jung CR,Hwang KS,Yoo J,et al.E2-EPF UCP targets pVHL for degradation and associa tes with tumor growth and metastasis[J].Nat Med,2006,12:809-816.
[7] Lim JH,Shin HJ,Park KS,et al.Adenovirus-mediated E2-EPF UCP gene transfer prevents autoamputation in a mouse model of hindlimb ischemia[J].Mol Ther,2012,20:778-787.
[8] Liang J,Nishi H,Bian ML,et al.The ubiquitin-conjugating enzyme E2-EPF is overexpressed in cervical cancer and associates with tumor growth[J].Oncol Rep,2012,28:1519-1525.
[9] Tedesco D,Zhang J,Trinh L,et al.The ubiquitin-conjugating enzyme E2-EPF is overexpressed in primary breast cancer and modulates sensitivity to topoisomerase II inhibition[J].Neoplasia,2007,9:601-613.
[10] Chen MF,Lee KD,Lu MS,et al.The predictive role of E2-EPF ubiquitin carrier protein in esophageal squamous cell carcinoma[J].J Mol Med,2009,87:307-320.
[11] Meisenberg C,Ward SE,Schmid P,et al.TDP1/TOP1Ratio as a Promising Indicator for the Response of Small Cell Lung Cancer to Topotecan[J].J Cancer Sci Ther,2014,6:258-267.
[12] Josse R,Martin SE,Guha R,et al.ATR inhibitors VE-821 and VX-970sensitize cancer cells to topoisomerase i inhibitors by disabling DNAreplication initiation and fork elongation responses[J].Cancer Res,2014,74:6968-6979.
[13] Congur G,Erdem A,Mese F.Electrochemical investigation of the interaction between topotecan and DNA at disposable graphite electrodes[J].Bioelectrochemistry,2014,102:21-28.
[14] Musa F,Blank S,Muggia F.A pharmacokinetic evaluation of topotecan as a cervical cancer therapy[J].Expert Opin Drug Metab Toxicol,2013,9:215-224.
[15] Najar IA,Johri RK.Pharmaceutical and pharmacological approaches for bioavailability enhancement of etoposide[J].J Biosci,2014,39:139-144.
