MUC13基因第2内含子插入/缺失突变对基因表达和经济性状的影响
2015-12-23孙丽朱世平夏日炜黄小国吴圣龙包文斌
孙丽,朱世平,夏日炜,黄小国,吴圣龙,包文斌*
(1.扬州大学动物科学与技术学院,江苏省动物遗传繁育与分子设计重点实验室,江苏扬州225009;2.常州康乐农牧有限公司,江苏常州213149)
MUC13基因第2内含子插入/缺失突变对基因表达和经济性状的影响
孙丽1,朱世平1,夏日炜1,黄小国2,吴圣龙1,包文斌1*
(1.扬州大学动物科学与技术学院,江苏省动物遗传繁育与分子设计重点实验室,江苏扬州225009;2.常州康乐农牧有限公司,江苏常州213149)
研究报道MUC13基因第2内含子的插入/缺失突变与ETEC F4导致的仔猪腹泻病密切相关,但该突变位点是否会对基因表达和经济性状(如一般抗病力、生产性状及繁殖性能等)造成影响还有待评估。本试验通过PCR方法检测大白猪群体中该突变位点的多态性,并分析其对大白猪MUC13基因mRNA表达水平、部分重要细胞因子水平(IL-1β、IL-4、IL-6、IL-8、IL-10、IFN-γ、TGF-β及TNF-α)、生产性状及繁殖性能的影响,以探究将该位点作为抗性遗传标记应用于抗病育种实践的可行性。结果表明:该位点在大白猪群体中存在3种基因型;不同基因型个体间组织mRNA表达水平、重要细胞因子水平、生产性状及1~4胎繁殖性能(总产仔数、产活仔数和断奶仔猪数)差异均不显著(P>0.05)。综上所述,将MUC13基因第2内含子插入/缺失突变作为大白猪抗性遗传标记进行分子选育时,不会对机体基因表达和重要经济性状造成显著影响。本研究为将该突变位点作为大白猪抗仔猪腹泻分子选育遗传标记的可靠性提供了一定的理论依据。
MUC13基因;大白猪;ETEC F4;遗传标记
仔猪腹泻是规模化猪场最常见的一类疾病,据统计因腹泻死亡的仔猪占仔猪死亡总数的39.8%[1],给养猪业造成了重大的经济损失。传统的预防性措施(如抗生素的使用)并没有从根本上消除仔猪腹泻病的发生与流行,而从遗传角度提高猪的抗病性具有治本的功效。因此,了解仔猪细菌性腹泻的遗传学机理并获得有效的抗性遗传标记对预防和控制疾病的发生具有深远意义。研究表明,产肠毒素性大肠杆菌(Enterotoxigenic Escherichia coli,ETEC)F4是初生和断奶仔猪腹泻和死亡的主要病原菌,包含F4ab、F4ac和F4ad 3种亚型,其中F4ac是主要的致病菌[2]。ETEC F4通过其菌毛等粘附素与相应受体结合,从而抵制肠道蠕动和肠液的冲洗作用,并分泌大量的肠毒素刺激上皮细胞分泌大量液体进入肠腔,最终导致腹泻等疾病。因此,ETEC F4致病的关键在于仔猪小肠茹膜上皮细胞刷状缘能否表达相应受体,不表达受体的仔猪对ETEC F4具有抗性。
Zhang等[3]研究表明,MUC13基因与ETEC F4ab/ac受体位点存在连锁不平衡现象,为猪ETEC F4ab/ac病的抗性分子标记选择提供一定依据。Ren等[4]通过全基因组连锁定位分析、目的区域的断点重组分析和远缘群体的高通量SNPs标记关联性分析等遗传研究手段,最终确定了MUC13为决定断乳仔猪腹泻抗性或易感性的ETEC F4ac受体基因。杨怀谷[5]则进一步将MUC13基因第2内含子插入/缺失突变作为仔猪ETEC F4抗性潜在的重要遗传标记。本文系统分析了MUC13基因第2内含子插入/缺失突变对大白猪试验群体MUC13基因mRNA表达水平、部分重要细胞因子水平、生产性状及繁殖性能的影响,以探究将该突变位点作为ETEC F4抗性遗传标记应用于大白猪抗病育种的可行性。
1 材料与方法
1.1 实验材料138头大白猪来自常州康乐农牧有限公司(国家生猪核心育种场),每个个体采耳组织块约1.0 g,放入1.5 mL的EP管内于冰盒中取回实验室采用常规酚-氯仿法提取耳样DNA,用于检测MUC13基因第2内含子多态性。检测基因型后选取不同基因型35日龄个体共80头用于测定部分重要细胞因子(IL-1β、IL-4、IL-6、IL-8、IL-10、IFN-γ、TGF-β及TNF-α)水平,并对其中14头仔猪进行屠宰取样。屠宰所取组织样包括心脏、肝脏、脾脏、肺、肾脏、胃、肌肉、胸腺、淋巴结、十二指肠和空肠11个组织,现场液氮保存,然后转移至-70℃冰箱保存备用。
1.2 多态性分析PCR引物参照文献[6],同时利用MUC13基因的mRNA序列(GenBank登录号:NM_001105293.1)设计实时荧光定量引物(如表1),引物由上海生工生物工程技术服务有限公司合成。PCR扩增反应体系为模板DNA(100 ng/μL),PCR Master-Mix(北京天根生化科技有限公司)10.0 μL,上、下游引物(10 μmol/L)各1.0 μL,加灭菌蒸馏水补足体系至20 μL。PCR扩增条件为95℃预变性5 min, 95℃变性30 s,60℃退火30 s,72℃延伸30 s,共30次循环,然后72℃延伸10 min,最后4℃保存。基因组DNA经PCR扩增后直接用12%聚丙烯酸胺凝胶电泳银染分析判型。

表1 引物序列及相关信息
1.3 总RNA的提取及RT-PCR反应按照试剂盒的要求,利用Trizol法提取仔猪各个组织总RNA,以2.2%甲醛变性凝胶电泳和NanoDrop-1000微量核酸测定仪检测总RNA的纯度和浓度,-70℃保存待用。
cDNA合成反应体系(10 μL):5×PrimerScript Buffer反应液2μL,Primer ScriptRT Enzyme Mix I 0.5 μL, Oligo dT 0.5 μL,Random 6 mers 0.5 μL,总RNA 500 ng, RNase free H2O补足至10 μL;反应条件:37℃15 min;85℃5 s,最后4℃保存。
RT-PCR扩增反应体系为20 μL:cDNA 1 μL,上、下游引物各0.4 μL(10 μmol/L),SYBR Green Real-time PCR Master Mix(2×)10 μL,ROX Reference Dye II (50×)0.4 μL,双蒸水7.8 μL。PCR反应条件:95℃, 30 s;95℃,5 s,60℃,34 s,经40个循环后4℃保存。扩增结束后分析熔解曲线,用以判断PCR扩增的单一性。每份样本进行3次重复,取平均值。
1.4 免疫指标测定断奶后35日龄前腔静脉采血5 mL,于4℃倾斜静置30 min,待血清析出后1 000 r/min离心10 min,制得血清样品置于-70℃保存备用。利用ProCarta免疫分析试剂盒对8个细胞因子(IL-1β、IL-4、IL-6、IL-8、IL-10、IFN-γ、TGF-β、TNF-α)水平含量进行测定。
1.5 部分经济性状的测定[7]在185~195日龄,B超活体测定大白猪的眼肌厚、背膘厚,称量体重,并详细记录1~4胎次的总产仔数、产活仔数及断奶仔猪数。“100 kg体重日龄和100 kg背膘厚”,校正公式如下:校正日龄=测定时日龄-(实测体重-100)/CF1, CF1=(实测体重/测定日龄)×1.715(母猪);校正背膘厚=实测背膘厚×CF2,其中CF2=A/{A+[B×(实测体重-100)]}。大白母猪的A值和B值分别为13.706和0.119。
1.6 统计分析根据Hardy-Weinberg平衡定律计算基因型及等位基因频率,p=P+H/2,q=Q+H/2,χ2=∑d2/e。其中d=e-o是期望值与观测值之差,p、q分别表示给定位点上的等位基因的频率;相对定量的结果采用2-∆∆Ct法进行处理,2-∆∆Ct法计算公式:∆∆CT=(待测组目的基因平均Ct值-待测组看家基因平均Ct值)-(对照组目的基因平均Ct值-对照组看家基因平均Ct值),即每一个组织目标基因表达经内参均一化处理后相对于某个组织的倍数,用内参基因GAPDH对表达水平进行均一化,计算个体各个组织的表达量;利用SPSS16.0软件的广义线性模型(General Linear Model,GLM)对基因型与mRNA表达水平、重要细胞因子水平、生产性状及繁殖性能的关系进行最小二乘法分析,统计模型为Yijk=μ+Gi+Fj+eijk,其中Yijk为性状观察值;μ为群体平均值;Gi为第i种基因型的固定效应;Fj为第j个家系的固定效应;eijk为随机残差效应。
2 结果与分析
2.1 PCR产物直接电泳分析PCR扩增产物经12%聚丙烯酸胺凝胶电泳分析后产生3种带型,扩增产物为151 bp的条带定义为AA型,同时具有151 bp和83 bp的条带为AB型,只有83 bp的扩增条带为BB型(图1)。
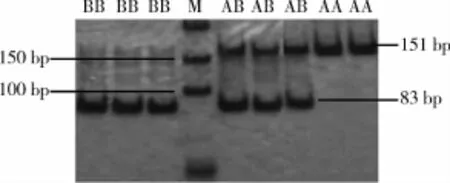
图1 猪MUC13基因PCR扩增产物电泳图
2.2 大白猪MUC13基因第2内含子基因型及等位基因频率分析利用PCR产物直接电泳的方法对138头大白猪个体进行检测,分型后计算出基因型和等位基因频率。结果发现,大白猪群体被检测到2种等位基因,共3种基因型,其中B为优势等位基因。χ2适合性检验结果表明,大白猪群体在MUC13基因第2内含子插入/缺失突变位点处于Hardy-Weinberg平衡状态(P>0.05)(表2)。
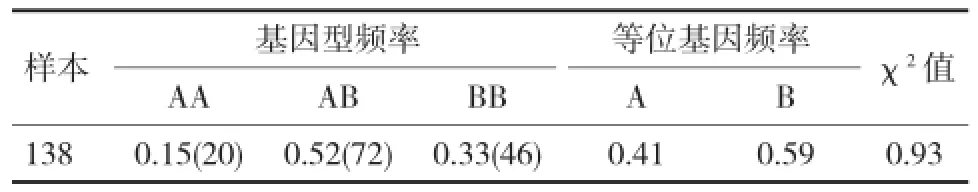
表2 大白猪MUC13基因第2内含子基因型及等位基因频率
2.3 MUC13基因在不同基因型大白猪中的mRNA组织表达差异内参基因GAPDH对表达水平进行均一化,并以心脏组织的相对表达量为1,以对MUC13基因在不同组织中的表达水平进行相对定量分析。结果显示,3种基因型个体对应的各组织MUC13基因的表达量间差异均不显著(P>0.05);MUC13基因在肠道组织(十二指肠和空肠)中的表达量较高(表3)。
2.4 大白猪MUC13基因第2内含子插入/缺失突变与细胞因子的关联分析80头大白猪来自4个家系,但经分析发现不同家系之间的细胞因子水平差异不显著(P>0.05),因此试验群体未分家系进行分析。相关性分析结果表明,试验群体3种基因型个体间的细胞因子水平差异不显著(P>0.05)(表4)。

表3 MUC13基因在不同基因型大白猪中的mRNA组织表达差异

表4 大白猪MUC13基因第2内含子插入/缺失突变与细胞因子水平的关联分析pg·μL-1
2.5 大白猪MUC13基因第2内含子插入/缺失突变与生产性状及繁殖性能的关联分析相关性分析结果表明,3种基因型对应的生产性状,1~4胎次的总产仔数、产活仔数和断奶仔猪数间差异均不显著(P>0.05)(表5和表6)。
3 讨论
MUC13基因存在MUC13-A和MUC13-B 2种拷贝类型,且两者是等位基因关系[5]。测序发现MUC13存在14个大于2 bp的插入/缺失突变位点,其中最大的插入/缺失位点为68 bp[6]。本研究采用直接PCR的方法对最大插入/缺失位点进行检测,获得大白猪MUC13基因第2内含子插入/缺失突变3种基因型为AA、AB和BB,其中B为优势等位基因。χ2适合性检验结果表明,大白猪群体在MUC13基因第2内含子插入/缺失突变位点处于Hardy-Weinberg平衡状态(P>0.05)。
MUC基因表达产物粘蛋白(mucins)又称上皮粘蛋白,是组织上皮细胞产生的,由膜结合和分泌型糖蛋白所组成的大分子蛋白家族。它在润滑、保护表皮细胞以及调节细胞信号转导等方面发挥着重要的作用[8]。MUC13蛋白作为粘蛋白家族的一员,在正常情况下,主要表达于各种分泌腺的上皮细胞,并对上皮细胞起保护和润滑作用;同时粘蛋白还通过其特殊的结构向细胞内传达信息,参与细胞间信号转导,其位置分布的特殊性使其成为茹膜防御体系的第一道屏障,保护茹膜抵御外来物质及微生物的侵犯[9]。本研究发现3种基因型个体对应的MUC13基因的表达丰度差异均不显著,提示MUC13基因第2内含子的插入/缺失突变不会对基因转录水平产生显著影响;此外,不同基因型个体的MUC13基因在肠道组织(十二指肠和空肠)中的表达量均较高,与其他学者的研究结果相一致[3,10],说明MUC13在抵抗肠道微生物感染中发挥着重要作用,但其作用机制还有待进一步研究分析。
Ren等[10]研究发现,MUC13基因第2内含子插入/缺失突变位点MUC13-A拷贝类型纯合时,猪只均表现为ETEC F4ac抗性,即AA基因型个体对ETEC F4有特殊抗性。在抗病育种实践中,人们希望培育出的抗性群体在能够抵抗疾病感染的同时,其他各种生产性能还能够保持稳定或有所提高。因此,基于重要候选基因及其遗传标记开展分子选育提高群体特殊特性的同时,尤其需要关注所开展的标记辅助选择对群体的一般抗病力和生产繁殖等重要经济性状的影响。而目前关于大白猪MUC13基因第2内含子插入/缺失突变与这些重要经济性状的关系研究尚未见相关报道。衡量动物机体对疾病抵抗能力大小的指标有很多,其中细胞因子是机体免疫细胞分泌的一类具有广泛生物学活性的小分子多肽,具有免疫调节、抗肿瘤、促进造血、参与炎症反应以及神经内分泌效应等多种生物学功能[11];免疫指标可代表机体的免疫功能状态,从而间接反映机体的抗病能力[12],因此可通过免疫指标的测定来了解动物的一般抗病力。本试验中,大白猪MUC13基因第2内含子插入/缺失突变与细胞因子水平的关联分析结果表明, 3种基因型个体对应的细胞因子水平间没有显著差异,提示针对大白猪MUC13基因第2内含子插入/缺失突变的分子选育不会对机体一般抗病力产生显著的影响。
100 kg体重日龄、100 kg背膘厚和眼肌厚是育种实践中对猪生长速度及瘦肉率的重要评价指标,繁殖性能也是决定养猪生产效益的重要经济指标,本研究结果表明,3种基因型个体间的100 kg体重日龄、100 kg背膘厚、眼肌厚、1~4胎的总产仔数、产活仔数和断奶仔猪数差异均不显著,说明针对大白猪MUC13基因第2内含子插入/缺失突变的分子选育不会对这2种重要经济性状产生不利的影响。

表5 大白猪MUC13基因第2内含子插入/缺失突变与生产性状的关联分析

表6 大白猪MUC13基因第2内含子插入/缺失突变与繁殖性能的关联分析
4 结论
MUC13基因第2内含子插入/缺失突变在大白猪群体中共检测到2种等位基因,3种基因型,其中B为优势等位基因;3种基因型个体对应的mRNA表达水平、重要细胞因子水平、生产性状以及1~4胎的繁殖性能间均无显著差异,将MUC13基因第2内含子插入/缺失突变作为大白猪抗性遗传标记进行分子选育时,不会对机体基因表达和重要经济性状造成显著影响。
[1]万遂如.仔猪腹泻性疾病的防控技术[J].猪业观察,2014,(1):100-103.
[2]Choi C,Chae C.Genotypic prevalence of F4 variants(ab,ac, and ad)in Escherichia coli isolated from diarrheic piglets in Korea[J].Vet Microbiol,1999,67(4):307-310.
[3]Zhang B,Ren J,Yan X,et al.Investigation of the porcine MUC13 gene:isolation,expression,polymorphisms and strong association with susceptibility to enterotoxigenic Escherichia coli F4ab/ac[J].Anim Genet,2008,39(3):258-266.
[4]Ren J,Tang H,Yan X,et al.A pig-human comparative RH map comprising 20 genes on pig chromosome 13q41 that harbours the ETEC F4ac receptor locus[J].J Anim Breed Genet, 2009,126(1):30-36.
[5]杨怀谷.猪ETEC F4ac受体编码基因MUC13的拷贝数及其在不同黏附表型个体中的表达分析[D].南昌:江西农业大学, 2012.
[6]陈一杰.ETEC F4ac易感和抗性猪只小肠差异蛋白的鉴别[D].南昌:江西农业大学,2011:12-13.
[7]王靖,刘颖,董文华,等.长白猪和大白猪生长激素基因多态性及其对部分经济性状的影响[J].中国畜牧杂志,2014, 50(11):1-4.
[8]Corfield A P,Carroll D,Myerscough N.et al.Mucins in the gastrointestinal tract in health and disease[J].Front Biosci, 2001,6:D1321-D1357.
[9]Julian J,Carson D D.Formation of MUC1 metabolic complex is conserved in tumor-derived and normal epithelial cells[J]. Biochem Bioph Res Co,2002,293(4):1183-1190.
[10]Ren J,Yan X M,Ai H S,et al.Susceptibility towards enterotoxigenic Escherichia coli F4ac diarrhea is governed by the MUC13 gene in pigs[J].PLos One,2012,7(9):e44573.
[11]高玲美,牛钟相,丁淑燕.动物细胞因子研究进展[J].动物医学进展,2003,24(4):46-48.
[12]欧阳解秀,王立贤,林纯洁.猪抗病力、免疫指标与生产性状关系的研究进展[J].中国畜牧兽医,2004,31(4):23-25.
Effect of Insertion/Deletion Mutation in MUC13 Gene Intron 2 on Gene Expression Level and Economic Traits
SUN Li1,ZHU Shi-ping1,XIA Ri-wei1,HUANG Xiao-guo2,WU Sheng-long1,BAO Wen-bin1*
(1.Key Laboratory for Animal Genetics,Breeding,Reproduction and Molecular Design of Jiangsu Province, College of Animal Science and Technology,Yangzhou University,Jiangsu Yangzhou 225009,China;2.Changzhou Kangle Farming Co.,Ltd.,Jiangsu Changzhou 213149,China)
It is reported that the insertion/deletion mutation in intron 2 of MUC13 gene is closely related to piglet diarrhea which is induced by ETEC F4,while it is unclear whether the mutation affects the gene expression level and economic traits(e.g.general disease resistance ability,production traits and reproductive performance)or not.This study detected the polymorphism of this site via PCR method in Yorkshire groups,then analyzed the effects of polymorphism on MUC13 mRNA expression level,partial important cytokine levels(IL-1β,IL-4,IL-6,IL-8,IL-10, IFN-γ,TGF-β and TNF-α),production traits and reproductive performance.On this basis,the study assessed the feasibility of this mutation site as one resistance genetic marker to be applied in resistance breeding.The results indicated that three genotypes were identified in test groups,and the mRNA expression levels,cytokines levels, production traits and reproductive performances(total number born,number born alive and number of piglets weaned)from first to fourth parity all had no significant difference among three genotypes individuals(P>0.05).In conclusion, the insertion/deletion mutation in intron 2 of MUC13 gene had no significant effect on gene expression level and important economic traits when regarded it as an important anti-disease genetic marker for molecular breeding in Yorkshire.This study provided a theoretical basis for the reliability of regarding this mutation site as an anti-diarrhea molecular breeding genetic marker in Yorkshire.
MUC13 gene;Yorkshire;ETEC F4;genetic marker
S828.2
A
0258-7033(2015)09-0004-05
2014-06-25;
2014-12-06
江苏省科技支撑计划(BE2013319、BE2014328、BE2014310);常州市科技支撑计划(CE2013011);扬州市农业科技攻关项目(2012038-17)
孙丽(1992-),女,江苏如皋人,硕士生,专业方向为猪抗病育种,E-mail:sl19920327@163.com
*通讯作者:包文斌(1974-),男,博士,研究员,研究方向为猪遗传育种,E-mail:wbbao@yzu.edu.cn
