中国进展期乳腺癌共识指南(CABC 2015)
2015-12-22中国女医师协会临床肿瘤学专业委员会
中国女医师协会临床肿瘤学专业委员会
中国抗癌协会乳腺癌专业委员会
乳腺癌的发病率逐年升高,这部分患者的治疗越来越受乳腺肿瘤科医生的重视。在新发乳腺癌患者中,有6%~7%的患者初次诊断即为进展期乳腺癌(advanced breast cancer,ABC)[1],而最初诊断为早期乳腺癌的患者在接受辅助治疗后,其中有30%的患者最终会出现复发转移[2-3],这就意味着在今后的几年内,我国进展期乳腺癌的比例也会增加,并会出现一个较大的群体。目前认为,进展期乳腺癌还不能被治愈,但可以被治疗;所以,治疗是以延缓疾病进展、改善生活质量、延长生存为目的的。进展期乳腺癌虽然没有绝对的标准治疗方案,但仍有一定的规律可循(附1)。
在乳腺癌患者的治疗领域中,早期诊断技术和新药研发都出现了蓬勃发展的态势,尤其是一系列新药的出现,更让乳腺癌的治疗得到了前所未有的进步,即便是进展期乳腺癌包括的原发局部晚期乳腺癌(即诊断时不能R0切除)、局部复发乳腺癌和转移性乳腺癌(metastatic breast cancer,MBC)仍然有很多方法可以治疗。目前进展期乳腺癌患者的中位生存时间为2~4年[4-5],但不同亚型和不同转移部位的结果完全不同。有文献报道并分析了544例乳腺癌患者的资料,其中位生存时间为33个月(13.6~53.4个月)[6];另一篇文献则报道,146例单纯骨转移的乳腺癌患者中,激素受体(HR)阳性患者的中位生存时间为65个月,人表皮生长因子受体(HER2)阳性和三阴性(ER阴性、PR阴性、HER2阴性)乳腺癌患者均为40个月[7],而这一结果可能会因治疗方式的不同而改变。由于进展期乳腺癌比较复杂,可以是单部位和单灶病变,也可以是多部位和多灶病变,所以其治疗方法也呈多样化,包括化疗、内分泌治疗、靶向治疗及免疫治疗等全身治疗,也包括放疗、手术、射频消融及介入等局部治疗;以上治疗方法均可使患者获益,并可以延长患者的生存时间。
在乳腺癌患者的治疗过程中,临床医生面临着很多问题:比如,乳腺癌为什么会复发?怎样才能减少复发或延缓复发?医生需要告诉乳腺癌患者多少内容?此外,临床医生还会被问到:我得的是晚期肿瘤吗?要化疗多久?还能治吗?还能活多久?等等!从理解疾病,到追求最好的治疗效果,再到患者要经历的不良反应、承担的费用等各个方面考虑,专家组希望:在治疗过程中,在循证医学的指导下制定进展期乳腺癌患者治疗的共识和指南,使患者得到最好的治疗、更长的生存时间并保持良好的生活质量。如何在如此复杂的疾病中合理又得心应手地应用已有的众多治疗方法,在进行了大量的文献阅读和与许多专家讨论之后,专家组觉得有必要在以往工作的基础上,整理几次会议达成共识的内容,并认为进展期乳腺癌治疗选择的基本依据来自对疾病层面因素和患者因素两方面的综合考虑。疾病层面因素为:患者接受辅助治疗后的无病生存时间,既往治疗的药物及其疗效、分子类型、肿瘤负荷、是否有需要快速控制的疾病症状和体征;同时还要考虑的患者方面因素为:患者的意愿、年龄、月经状态、是否有其他慢性病、经济状况、社会和家庭的支持以及患者的心理因素等。所以,进展期乳腺癌的诊疗是很复杂的治疗过程和疾病管理过程。
2013年11月,专家组在《癌症进展》杂志发表了《首届中国进展期乳腺癌共识指南(草案)》(CABC1)[8];2014年8月1日,在举办的第二届中国进展期乳腺癌会议(CABC2)上,来自中国20多个省市的乳腺肿瘤领域专家,以及1位来自美国和1位来自新加坡的乳腺肿瘤专家共同对进展期乳腺癌的诊断和治疗进行了充分讨论,并由北京大学肿瘤医院乳腺肿瘤内科医生负责整理成文。近两年,鉴于国内外学者发表了诸多新的临床研究结果,专家组认为有必要进一步更新和完善CABC1指南。在参考已发表指南的基础上,包括欧洲第二届进展期乳腺癌共识指南(ESO-ESMO 2nd international consensus guidelines for advanced breast cancer,ABC2)[9-10]、美国 NCCN 乳腺癌指南[11]、中国抗癌协会乳腺癌诊治指南与规范(CACABC)[12]等,并参照近一年发表的新的临床研究结果,通过两次专家讨论会,专家组对进展期乳腺癌的热点问题进行了广泛且深入的讨论,最后修订成文。
1 进展期乳腺癌诊疗的一般原则
1.1 多学科专家团队
进展期乳腺癌的治疗团队需要整合内科、外科、放疗、影像、病理、心理、社会工作者、护士和姑息治疗等多学科的专业人员。肿瘤专科护士或医生的助理也应该加入这一团队[13-14]。
1.2 鼓励患者参与治疗决策
在我国,多数患者不参与治疗决策过程,治疗决策多由患者家属参与并做出选择。因为进展期乳腺癌的治疗是一个长期的过程,患者的依从性可影响治疗的效果,所以专家组建议患者应积极参与治疗方式的制定,并确保患者对治疗决策有充分的知情权。通常一旦被确诊为乳腺癌,患者需要大量的信息,包括:如何治疗疾病,家庭的经济负担,对疾病的感受和承受能力。一方面,中国的大多数家庭选择对患者隐瞒病情,他们担心疾病对患者的打击,甚至希望医生开具一张隐瞒病情的诊断书,不告诉患者自身疾病的恶性程度;另一方面,如果患者没有医疗保险,其诊治费用主要由子女承担,患者不希望给家庭带来负担,从而选择不告诉家属自己的病情,而这两种做法都是不恰当的。所以,专家组鼓励患者及其家属共同参与治疗的决策,并且由患者起主导作用。在可能的情况下,应鼓励患者由支持他们的人(如家庭成员、护理人员、支持群体)陪伴,被邀请参与制定治疗决策。
1.3 进展期乳腺癌不能治愈但可以治疗
经全面评估和确诊为进展期乳腺癌后,相关人员应对治疗的目的进行讨论,并告知患者,进展期乳腺癌的患者可以有较长的生存时间,应该使用易懂的语言进行谈话,尊重患者的隐私和文化差异,并尽可能地提供书面信息。
1.4 特殊治疗药物的选择策略
帕妥珠单抗[15]、T-DM1[16]、依维莫司[17]、CDK4/6[18]都已经获得美国FDA的批准,并已上市用于乳腺癌的治疗;PARPi[19]被批准用于治疗BRCA1/2突变的卵巢癌,但同时有临床研究证实其对BRCA1/2突变的乳腺癌也有效[20];而贝伐珠单抗[21]经欧洲批准应用于乳腺癌。虽然这些药物在国内并没有获得批准,但均是乳腺癌可选择的治疗药物,可为经选择患者带来生存获益,所以它们在国内的应用需谨慎对待。
1.5 治疗相关不良反应的管理
治疗相关不良反应的客观可靠评价,是进展期乳腺癌患者生活质量管理的重要部分。每个患者对治疗不良反应的耐受性均存在差异。医生应该使用标准的、经验证的工具或患者自我评价量表(patients reported outcomes,PRO)来评估药物的安全性,通常使用不良反应常用术语标准(CTCAE)对不良反应的类型和严重程度进行评价(附2,http://outcomes.cancer.gov/tools/pro-ctcae.html)[22];这样可以更准确地反映患者的治疗获益和治疗危害。同时,专家组推荐的评价乳腺癌生活质量的量表为 FACT(附 3,http://www.facit.org/FACITOrg/Questionnaires;已注册并获准使用)。
1.6 生活质量
从诊断为进展期乳腺癌开始,在医护的日常工作中患者应接受适当的心理护理、支持护理和相关症状的干预。医生必须施以个性化的干预方法,以满足患者的个体需要。
治疗成本和医疗资源配备:医学界应了解进展期乳腺癌治疗成本的问题;应在平衡患者的福祉,生存时间和患者的意愿等所有情况下做出决定,并始终指导诊疗决策。
1.7 鼓励患者加入临床研究
在进展期乳腺癌的治疗中,很少有绝对的标准治疗方案。如果有临床试验可供选择,并且患者有意愿参与,在经过患者知情并同意后,将患者纳入精心设计的、前瞻性、随机对照的临床试验是一个优先选择。
1.8 患者教育的重要性
患者教育可以提高治疗依从性,可能会改善预后;同时可以改善患者的生活质量,可能会延长患者的生存时间。
2 进展期乳腺癌相关的重要定义和关键问题
乳腺癌的治疗在国外国内并不统一,尤其是进展期乳腺癌,包括治疗方法以及治疗的单位均不统一。乳腺外科、乳腺内科、肿瘤内科或外科均收治乳腺癌患者。这种治疗的复杂性需要研究者对一些重要的问题进行统一和规定。参照ABC2指南[9-10]、2014年ASCO HER2阳性乳腺癌治疗指南[23]、中国抗癌协会乳腺癌诊治指南与规范[12],以及在CABC会议上的专家讨论内容,本文对进展期乳腺癌治疗相关的几个重要定义也做了阐述。因为医生在临床工作中会遇到各种情况的患者,应尽量避免对已经耐药的患者继续使用相同的治疗,应尽可能让患者从治疗中得到最大获益;所以,这些定义不但对临床研究有指导意义,而且在临床实践中也发挥重要作用。
2.1 内脏危象
内脏危象的定义为:不但有内脏转移,疾病进展迅速,而且还可通过症状和体征、实验室检查结果评估器官功能障碍的严重程度;在这种情况下,内脏转移的病情通常需要得到快速的缓解,从而需要给予有效且能够快速缓解疾病的治疗方法[9-10]。虽然指南中会推荐应用有效的治疗(如给予化疗来改善疾病状况);但临床中通常存在器官功能障碍严重的患者,可能不适合化疗。所以,医生要谨慎处理。
2.2 内分泌治疗耐药
22..2.1原发性内分泌治疗耐药 指术后辅助内分泌治疗2年内出现复发转移的情况,或转移性乳腺癌一线内分泌治疗6个月内出现疾病进展[9-10]。
2.2..22继发性内分泌治疗耐药 术后辅助内分泌治疗过程中,治疗≥2年后出现复发转移,辅助内分泌治疗结束后12月内出现复发转移,或转移性乳腺癌一线内分泌治疗≥6个月出现疾病进展[9-10]。
这些定义考虑到了治疗过程中患者的实际需要;如果患者对内分泌治疗耐药,医生可以考虑加上靶向治疗来逆转耐药。
2.3 HER2的检测
HER2的规范化检测和阳性的判定应参照ASCO/CAP指南或中国相关的指南。一般是指:①免疫组化(IHC):3+;②FISH检测:HER2/CEP17信号比值≥2.0;③HER2基因拷贝数:≥6个信号/细胞。
2.4 H E R 2阳性乳腺癌曲妥珠单抗治疗的建议
是否和内分泌治疗一样,抗HER2的曲妥珠单抗治疗也存在耐药?临床实践中的确存在一些患者接受曲妥珠单抗治疗没有效果,这种情况可参考Wong等[24]给出的建议。他们认为:原发性曲妥珠单抗耐药是指转移性乳腺癌经曲妥珠单抗治疗8~12周内出现疾病进展,或第1次影像学疗效评价即出现疾病进展,早期乳腺癌术后辅助曲妥珠单抗治疗过程中出现复发转移;或曲妥珠单抗治疗结束后12个月内出现复发转移:继发性曲妥珠单抗耐药是指转移性乳腺癌行曲妥珠单抗治疗,首次进行疗效评价有效,在后续治疗过程中出现疾病进展。这些概念可能会有助于医生的治疗决策(与会专家讨论的结果为:目前,曲妥珠单抗耐药的定义还要进一步的证据支持)。
2.5 进展期乳腺癌相关急症
此类急症指有症状的脑转移、骨转移患者出现脊髓压迫、上腔静脉综合征、肿瘤破裂出血、化疗后出现发热性粒细胞减少等。
3 检查与疗效评估
3.1 基线检查
专家组建议:在全身性治疗前进行最基本的分期检查,包括病史、体格检查、血液学检查、肝肾功能、血清电解质(包括血钙)、肿瘤标志物(尤其是影像检查不能评估病灶时)、心电图、胸片或胸部CT、腹部超声或CT、骨扫描和ECOG PS评分。
3.2 病灶的活检
在开始治疗前,专家组建议进行肿瘤病灶的活检,用于提供组织学检查和生物学指标的检查(包括ER、PR、HER2和Ki-67等)。在转移阶段,建议进行至少1次生物学指标(特别是HR和HER2)的再次评价[26-27]。
3.3 PET-CT T-CT的应用
PET-CT被用于明确转移病灶,但是基线检查时仍需行CT或MRI检查。针对无病生存时间短、早期复发而且多部位复发的患者,可以行PET-CT检查确定复发的病灶[25-27]。
3.4 头部影像学检查
对无症状的患者,虽然头部影像学检查不是常规检查,但在临床实践中有些患者在常规复查时发现了脑转移且无症状。所以,临床医生应对复发风险高(如HR阴性、HER2阳性)的患者给予重视。针对无病生存时间较短、一线治疗多部位复发者,则可以考虑给予头部影像学检查,特别是三阴性和HER2阳性乳腺癌患者。
3.5 血清肿瘤标志物检查
血清肿瘤标志物通常检测CEA、CA153和CA125,这些指标增高可能是肿瘤复发的早期表现,医生必须谨慎对待。如果是已经转移的患者,治疗过程中肿瘤标志物增高要考虑两种可能:其一,可能是治疗无效,要结合影像学检查来判断是否更改治疗方案;其二,可能是肿瘤对治疗有反应。所以,如果无可测量转移病灶的患者仅有肿瘤标志物的增高,仅在极少数的情况下才是治疗有反应的标志,故不应作为更改治疗方案的依据[29];但持续增高时应警惕肿瘤进展。
3.6 疗效评价的频率
内分泌治疗通常为2~4个月评估一次,化疗通常为2~4个周期评估一次。多数患者,仅接受靶病灶的影像学检查就足够了。对于同一个靶病灶,通常进行同一种方法检查。对于疾病进展缓慢的患者,医生可以降低影像学检查的频率。如果怀疑PD或出现症状,无论是否到了计划的检查时间,应迅速予以检查。患者在每次评价疗效检查时均要接受病史询问和体格检查(附NCCN进展期乳腺癌评估方法[30],附4、附5)。
3.7 骨扫描
骨扫描主要用于骨转移的筛查。明确骨转移的诊断和随访评价必须进行CT或MRI检查。
3.8 循环肿瘤细胞的检测
循环肿瘤细胞(circulating tumor cell,CTC)是指从肿瘤组织脱离并进入血液循环系统的肿瘤细胞,这种细胞的产生是患者发生远处转移的必要前提。2004年,CellSearch循环肿瘤细胞检测系统被美国FDA批准用于评价转移性乳腺癌的预后。研究表明,全身治疗前以及治疗后首次随访检测的CTC数目是转移性乳腺癌患者无进展生存时间和总生存时间的独立预测指标。近期,多中心前瞻性研究证实,CTC在HER2阳性或三阴性转移性乳腺癌患者中同样具有重要的预后价值[31]。
4 进展期乳腺癌的基本治疗原则
4.1 治疗时应该考虑的因素
包括:HR和HER2状态、既往治疗及其不良反应、无病生存时间或无进展生存时间、肿瘤负荷(即转移的部位及数目)、年龄、体能状态、伴随疾病和患者意愿,尤其要考虑患者对化疗的接受程度等人文关怀方面的理念。
4.2 转移灶的活检和病理
原发灶和转移灶生物标志物不一致时,应该根据哪个生物标志物结果进行治疗决策目前尚不确定。因为临床试验难以评价这种情况,所以专家组推荐:在原发灶和转移灶中至少有一个病灶阳性,就可依据这个阳性结果选择内分泌治疗和(或)抗HER2的治疗[25-26]。但也有专家认为,如果原发灶和转移灶生物标志物不一致,对一线治疗的决策而言,转移灶测得的生物标志物可能更重要。
4.3 内分泌治疗选择时应考虑其是否绝经
虽然目前乳腺癌临床试验对绝经的定义各异,但绝经通常是指月经永久性终止,也被用于描述乳腺癌治疗过程中卵巢合成雌激素的持续性减少。
关于绝经,NCCN指南[11]有几条明确的定义:①双侧卵巢切除术后;②年龄≥60岁;③年龄<60岁,停经≥12个月,没有接受化疗、他莫昔芬、托瑞米芬或抑制卵巢功能的治疗,且卵泡刺激素及雌二醇水平在绝经后的范围内;④年龄<60岁,正在服他莫昔芬或托瑞米芬,卵泡刺激素及雌二醇水平应在绝经后范围内;⑤正在接受LH-RH激动剂或拮抗剂治疗的患者,无法判定其是否绝经;⑥正在接受辅助化疗的绝经前女性,停经不能作为判断绝经的依据,因为尽管患者在化疗后会停止排卵或出现停经,但卵巢功能仍可能正常或仍有恢复的可能。对于化疗引起停经的女性,如果考虑以芳香化酶抑制剂作为内分泌治疗,则需要进行卵巢切除或连续多次监测卵泡刺激素和(或)雌二醇水平,以确保患者处于绝经后状态。化疗导致的闭经不是真正意义上的绝经,芳香化酶抑制剂的应用也要慎重,尤其是对年轻患者,因为年轻患者化疗后月经恢复的可能性要高于年龄大的患者[32]。
医生需根据是否需要快速控制疾病或者症状来选择如何进行治疗,同时还应考虑患者的经济因素、心理因素、目前可采取的治疗措施以及患者本人的意愿。
4.4 患者的年龄不应影响有效治疗的实施
年龄通常不是影响治疗的决定因素。考虑到年龄大的患者对化疗的耐受差,其治疗方案应以内分泌治疗和单药化疗为主,但要避免老年患者的治疗不足问题和年轻患者的治疗过度治疗问题。年轻患者被确诊为乳腺癌后,将会面临更加复杂的情况,其治疗决策要考虑身体情况、器官功能、社会、心理、精神、工作、家庭和儿童看护等因素。
4.5 要考虑多种治疗模式
患者出现单发转移后,有可能获得完全缓解并能长期生存,可以考虑接受多种模式的治疗。如:单发的肝或肺转移,可以考虑给予患者手术切除、放疗、介入治疗等。
4.6 初治的Ⅳ期乳腺癌
对于初治Ⅳ期乳腺癌患者,切除原发性肿瘤的价值还不确定。但在全身治疗有效的前提下,如果乳腺局部病灶可以达到切缘阴性,腋窝淋巴结可以分期,就可以接受手术治疗。如果手术能改善患者的生活质量,也可考虑[33-36]。
5 不同类型乳腺癌的治疗
5.1 ER阳性/HER 2阴性进展期乳腺癌
目前认为,激素受体阳性乳腺癌是一种慢性疾病,患者的生存时间长、预后好。大部分这类患者对内分泌治疗敏感,治疗获益大,因此,推荐首选内分泌治疗。但是,对于存在内脏危象、症状严重、明确存在内分泌治疗耐药的患者,如果其在内分泌治疗阶段出现疾病进展,可以首选化疗,以便快速减轻或缓解临床症状,控制肿瘤发展,改善生活质量。
也有部分专家认为,即使是激素受体阳性的患者,也可以优先选择化疗,之后序贯内分泌治疗以维持治疗效果,患者也可能会获益。所以,辩证地考虑患者的治疗获益并使其经历更少的不良反应,是临床选择治疗的基本原则[37-38]。
55..1.1常用的内分泌治疗药物 选择性雌激素受体调节剂:他莫昔芬、托瑞米芬、氟维司群;芳香化酶抑制剂:依西美坦、来曲唑、阿那曲唑;逆转内分泌耐药或联合内分泌治疗的靶向药物:依维莫司、CDK4/6。
55..1.2优先化疗还是内分泌治疗 优先内分泌治疗的条件:无病生存时间大于2年,没有内脏危象,无症状或症状很轻。优先化疗的条件:无病生存时间小于1年,内脏危象,症状严重。介于上述两者之间的情况选择个体化治疗。通常建议给予患者更少的化疗,或者更少的化疗周期。
55..1.3选择内分泌治疗的一般状况 如果没有内分泌耐药的证据或没有快速减轻肿瘤负荷的需要,即使患者存在内脏转移,内分泌治疗也是激素受体阳性进展期乳腺癌患者的首选治疗。根据治疗的反应和患者的情况,可以进行2~3线的内分泌治疗。医生在为进展期乳腺癌患者选择内分泌治疗的药物时,一定要考虑患者在辅助内分泌治疗阶段使用的内分泌药物的治疗时间和耐药情况[39]。
55..1.4化疗联合内分泌治疗 目前尚无报道患者可自此类治疗中获得生存益处,因此,专家组不建议内分泌治疗和化疗的联合应用。
55..1.5内分泌治疗药物的应用 绝经后的患者,一线内分泌治疗可以选择芳香化酶抑制剂(aromatase inhibitor,AI)、氟维司群、他莫昔芬或托瑞米芬。通常会优先选择芳香化酶抑制剂,存在芳香化酶抑制剂治疗禁忌证、曾行芳香化酶抑制剂辅助内分泌治疗且无病生存时间短、或因经济原因不能接受芳香化酶抑制剂治疗的患者,可考虑给予他莫昔芬或托瑞米芬[40-42]。
氟维司群是雌激素受体拮抗剂,有两种给药方式,即每4周250 mg和每4周500 mg。大剂量氟维司群能显著延长患者的mPFS(23.4个月vs 13.1个月),且耐受性良好。因此,大剂量氟维司群(每4周500 mg)目前也被推荐用于绝经后患者的一线内分泌治疗[43-45]。
55..1.6绝经前患者通常采用他莫昔芬 如果患者辅助阶段应用过他莫昔芬,也可以考虑卵巢功能完全抑制(包括药物性卵巢功能抑制),去势后加用芳香化酶抑制剂[46]。这里要强调的是:对45岁以下、未绝经的患者,在给予药物性卵巢功能抑制加用芳香化酶抑制剂时要慎重,要检测激素水平(雌二醇和卵泡刺激素);因为如果卵巢功能不能被完全抑制,该疗法的效果不佳。
55..1.7绝经后芳香化酶抑制剂治疗进展的患者芳香化酶抑制剂治疗后进展的乳腺癌患者,可以根据患者的实际情况,考虑以下几种治疗。①非甾体类芳香化酶抑制剂(来曲唑、阿那曲唑)治疗失败后,依维莫司联合依西美坦是有效的治疗方式;对内分泌治疗失败的患者,依维莫司也可以联合他莫昔芬、来曲唑和氟维司群[17,47-49]。2012年7月20日,美国FDA基于BOLERO-2研究[17]的结果批准了依维莫司联合依西美坦用于非甾体类芳香化酶抑制剂治疗失败的绝经后激素受体阳性、HER2阴性的晚期乳腺癌患者。使用依维莫司治疗应权衡其疗效和不良反应。患者接受依维莫司治疗的主要不良反应是口腔溃疡和肺间质纤维化;对于口腔溃疡在用药时就要预防,包括口腔淡盐水漱口,及时治疗口腔溃疡等。总之,应根据具体情况进行个体化治疗。②大剂量氟维司群(每4周500 mg)。③可以换用另一类芳香化酶抑制剂。如非甾体类芳香化酶抑制剂(来曲唑、阿那曲唑)治疗失败后,可以考虑换为甾体类芳香化酶抑制依西美坦治疗,反之亦然。④使用他莫昔芬或托瑞米芬。⑤孕激素也可作为一种治疗选择。
5 5..1.8维持治疗 进展期乳腺癌患者化疗后的内分泌维持治疗,在临床实践中被广泛应用,是一个合理的选择。
5.1..9 9激素受体阳性和HER2均阳性的患者 此类患者可以接受内分泌治疗联合抗HER2的治疗(如曲妥珠单抗、拉帕替尼等)[50-51]。
5.2 HE R 2阳性进展期乳腺癌
靶向治疗药物的特点是高效、低毒、患者的耐受性好,能选择性地杀死肿瘤细胞,而对正常组织的影响较小。
最早被应用于临床的抗HER2的靶向治疗药物是曲妥珠单抗。一项转移性乳腺癌一线治疗的Ⅲ期临床研究显示,化疗联合曲妥珠单抗与单纯化疗治疗患者的TTP分别为7.4个月和4.6个月(p<0.001),反应的时间分别为9.1个月和6.1个月(p<0.001),OS分别为25.1个月和20.3个月(p<0.01);基于该临床研究结果,曲妥珠单抗于1998年被美国FDA批准用于转移性乳腺癌的一线治疗[52]。另一篇文献报道曲妥珠单抗治疗者的mOS被提高到3.5年(3.0~4.4年)[53]。曲妥珠单抗治疗早期乳腺癌可将10年的无病生存率从62.2%增加到73.7%[54];治疗转移性乳腺癌可以提高患者的OS,有些患者可以获得更长的生存时间[55]。
2002年曲妥珠单抗在中国上市,随后针对HER1和HER2的小分子酪氨酸激酶抑制剂拉帕替尼也在中国上市,其他的抗HER2治疗药物还有帕妥珠单抗、T-DM1。这些药物应用的一般原则是:患者尽可能早地接受抗HER2的治疗,除非有禁忌证[56]。
55..2.1 ER ER阳性/HER/HER22阳性的乳腺癌 可以选择内分泌治疗联合抗HER2的治疗,且无论是曲妥珠单抗还是拉帕替尼联合内分泌治疗都能显示出无进展生存时间的获益,特别是无化疗时间的延长[50-51]。
5 5..2.2抗HER2治疗失败后抗HER2药物的选择因为对HER2通路的持续抑制是有益的,所以抗HER2治疗联合化疗或内分泌治疗失败后,患者通常会继续接受抗HER2的治疗,至于是继续使用同一种抗HER2的治疗,还是选择另一种抗HER2的治疗,要根据之前治疗有效的时间而定。
5 5..2.3进展期乳腺癌抗HER2治疗的时间 这种需维持的时限,尤其是对处于缓解阶段的疾病,目前仍不明确。
5 5..2.4曲妥珠单抗 因帕妥珠单抗尚未在中国上市,目前的一线治疗方案仍是化疗联合曲妥珠单抗[54-56]。在辅助治疗和新辅助治疗阶段接受过曲妥珠单抗治疗,不影响复发转移后曲妥珠单抗的使用。
对曲妥珠单抗治疗进展的患者,医生通常会根据治疗的周期数考虑曲妥珠单抗的继续使用,而仅改变联合用药,如化疗或内分泌治疗;也可以选择T-DM1、拉帕替尼联合卡培他滨或曲妥珠单抗联合拉帕替尼[57-59]。
除临床试验外,曲妥珠单抗通常不与蒽环类药物联合应用,因其会增加心脏毒性[52]。
5 5..2.5拉帕替尼 该药通常被用于曲妥珠单抗治疗失败的患者,尤其是曲妥珠单抗治疗中出现脑转移的患者,常用方案为曲妥珠单抗联合拉帕替尼。一项国际多中心Ⅲ期临床试验(EGF100151)评价了拉帕替尼联合卡培他滨的疗效,入组曲妥珠单抗治疗失败、既往接受过含蒽环或紫杉类药物治疗的患者,将患者随机分为拉帕替尼/卡培他滨联合治疗组和卡培他滨单药治疗组;结果显示,联合治疗组患者的mTTP为27.1周,单药治疗组为18.6周(p<0.001);提示拉帕替尼联合卡培他滨可以用于曲妥珠单抗治疗失败的HER2阳性乳腺癌[60-64]。
5.2..6 6帕妥珠单抗 HER2阳性转移性乳腺癌的一线治疗,可以选择化疗/曲妥珠单抗/帕妥珠单抗联合治疗方案。
CLEOPATRA研究[69]结果显示,一线治疗中,曲妥珠单抗/帕妥珠单抗/多西他赛联合组患者的mPFS显著优于曲妥珠单抗/多西他赛组(18.5个月vs 12.4个月,p<0.001),1年生存率分别为23.6%和17.2%;证实化疗/曲妥珠单抗/帕妥珠单抗联合方案较化疗/曲妥珠单抗方案有明显的生存获益,特别是对于既往未使用曲妥珠单抗的患者。另有研究结果显示帕妥珠单抗不能单独发挥作用,而需要与曲妥珠单抗联合应用[65-66]。
5.2..7 7 T-DMT-DM1该药对曲妥珠单抗一线治疗失败的转移性乳腺癌有生存益处。EMILIA研究比较了T-DM1和拉帕替尼/卡培他滨方案在二线治疗中的疗效,证实曲妥珠单抗一线治疗失败的HER2阳性乳腺癌可优先选择T-DM1[67]。美国FDA于2013年2月正式批准T-DM1作为治疗HER2阳性进展期乳腺癌的药物。
综上所述,对于HER2阳性乳腺癌患者,化疗/曲妥珠单抗/帕妥珠单抗的联合是最佳的一线治疗方案。鉴于帕妥珠单抗未在中国上市且费用昂贵,目前推荐的一线治疗方案仍是化疗联合曲妥珠单抗;没有化疗适应证的激素受体阳性患者,也可考虑接受曲妥珠单抗或拉帕替尼联合内分泌治疗。对于曲妥珠单抗治疗失败的HER2阳性乳腺癌,T-DM1是最佳的治疗选择,但是T-DM1也没有在中国上市。因此,可以选择拉帕替尼联合卡培他滨,或继续使用曲妥珠单抗,仅更换化疗或内分泌治疗方案,也可以考虑曲妥珠单抗联合拉帕替尼的双靶向治疗。
5.3 三阴性乳腺癌
55..3.1三阴性乳腺癌特殊性 三阴性乳腺癌复发率高。一项研究总结了787例三阴性乳腺癌患者的资料,其中位复发时间为30.2个月(4~110个月),2年内发生复发的患者占36.3%,2~3年内发生复发的患者占27.8%[68]。
辅助治疗阶段曾接受蒽环类和紫杉类药物治疗的三阴性乳腺癌患者,如果不能入组临床试验,可以考虑接受以铂类药物为基础的治疗。
国外也有指南推荐,既往未用过蒽环类和紫杉类药物治疗的三阴性局部晚期乳腺癌患者,可以首选蒽环类和紫杉类药物化疗[9-10]。
5 5..3.2 BRCA1.2突变与含铂的化疗 BRCA1/2突变乳腺癌患者仅占全部乳腺癌患者的3%~5%,因此,很难开展针对BRCA突变转移性乳腺癌的大规模临床试验。目前,在新辅助治疗领域,有部分研究探讨铂类药物对BRCA突变乳腺癌的作用。结果显示,铂类药物可使BRCA突变乳腺癌患者的病理完全缓解率显著提高。一项研究用顺铂新辅助治疗BRCA1突变的患者,获得61%的pCR率[69]。而在43例存在BRCA突变的患者中,卡铂治疗组患者的客观有效率显著高于多西他赛治疗组(68.0%vs 33.3%,P=0.03)[70]。该研究提示,在未选择的三阴性乳腺癌中,卡铂并不显著优于多西他赛,但在BRCA1/2突变患者中卡铂治疗可能存在优势。
6 化学治疗
6.1 化疗适应证
化疗适应证为:激素受体阴性的患者,有症状的内脏转移患者,激素受体阳性但对内分泌治疗耐药的患者。
6.2 化疗方式的选择
联合化疗和单药序贯化疗都是合理的选择。基于现有数据,专家组推荐优选单药序贯化疗;对于病情进展迅速、存在内脏危象或需要迅速缓解症状、控制疾病进展的患者,可选择联合化疗。国内专家认为:化疗药物的联合应用及序贯应用在临床工作中均可选择,已有多项研究表明患者对单药序贯治疗的耐受性更佳,且OS相似。
6.3 化疗药物选择的一般原则
如果没有禁忌证,既往未接受过蒽环类或紫杉类药物辅助治疗的患者,通常选择蒽环类或紫杉类药物为基础的化疗方案,其他可选择的药物有长春瑞滨[71]、吉西他滨[72]、卡培他滨[73]、脂质体多柔比星和白蛋白结合型紫杉醇[74-75]、顺铂和卡铂等。
6.4 化疗中需要特别关注的问题
对蒽环类药物耐药或出现蒽环类药物的剂量累积毒性(如心脏毒性)而未用过紫杉类药物的患者,后续化疗通常选择以紫杉类药物为基础的方案,也可以选择紫杉类单药方案。
对于HER2阳性的局部晚期乳腺癌患者,专家组建议序贯使用蒽环类药物与抗HER2药物,不建议同时联合使用。
对在辅助治疗中使用过紫杉类药物的患者,特别是无病生存时间至少超过1年的患者,一线治疗时可再次使用紫杉类药物。
6.5 化疗有效后的维持治疗
专家组建议:应该根据对每位患者具体情况的评估结果予以个体化的治疗,包括对每种方案持续时间(周期数)的评估和对患者能否接受多线化疗的评估。有荟萃分析表明:一线治疗的持续时间长可轻度延长患者的OS,可显著延长PFS;所以这种治疗可持续应用直至疾病进展或出现不可耐受的不良反应(不可耐受的不良反应应由患者和医生共同判定)[76]。目前,大量临床试验已证明卡培他滨适合用于维持治疗,其还具有口服给药、应用方便的特性。此外,针对激素受体阳性的患者,内分泌维持治疗也是很好的选择[77]。
6.6 靶向治疗药物与化疗的联合
在晚期乳腺癌的治疗中,抗HER2的靶向治疗可以联合化疗,贝伐珠单抗也可以联合化疗,但要谨慎应用,注意选择合适的患者。
6.7 单药序贯化疗
E1193是一项随机对照临床研究[78],评价单药序贯化疗对比联合化疗一线治疗转移性乳腺癌的疗效,共纳入739例患者,被随机分为多柔比星/紫杉醇联合治疗组、多柔比星治疗进展后序贯紫杉醇治疗组和紫杉醇治疗进展后序贯多柔比星治疗组三个组。结果显示,联合治疗组的客观有效率和中位至治疗失败时间均显著优于单药序贯治疗组(两种序贯治疗组间的差异无统计学意义),三组患者总生存时间的差异无统计学意义,但联合治疗组的不良反应发生率显著增高。另外,2013年的一项荟萃分析[79]显示:单药序贯化疗有改善无进展生存时间的优势;虽然联合化疗组客观有效率显著增高(RR=1.16,95%CI 1.06~1.28;P=0.001),但并未明显改善无进展生存时间,且粒细胞缺乏性发热风险显著增高(RR=1.32,95%CI 1.06~1.65;P=0.01)。
7 其他的靶向治疗
7.1 贝伐珠单抗
贝伐珠单抗联合化疗一线或二线治疗转移性乳腺癌,仅改善无进展生存时间,并没有改善总生存时间,且目前没有贝伐珠单抗疗效的预测因子。
美国FDA先批准后又撤回了贝伐珠单抗用于乳腺癌的治疗。欧洲药品管理局人用医疗产品委员会目前批准的适应证包括:①贝伐珠单抗联合紫杉醇一线治疗转移性乳腺癌;②不适合紫杉类和蒽环类药物治疗的转移性乳腺癌,可考虑给予贝伐珠单抗联合卡培他滨一线治疗。因此,贝伐珠单抗仅可作为一线治疗或二线治疗的一种选择,并且不推荐其在二线以上的治疗中使用[80-83]。
7.2 依维莫司
依维莫司是哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂。基础研究显示依维莫司能够逆转内分泌治疗耐药。基于BOLERO-2研究[17]的结果,2012年7月20日,美国FDA批准依维莫司联合依西美坦治疗非甾体类芳香化酶抑制剂治疗失败的绝经后激素受体阳性、HER2阴性的晚期乳腺癌患者。BOLERO-2研究是一项随机、双盲、安慰剂对照的Ⅲ期临床试验,纳入了724例上述适应证的绝经后女性患者。结果显示:中位随访18个月,依维莫司联合依西美坦组患者的中位无进展生存时间较安慰剂联合依西美坦组显著延长(7.8个月 vs 3.2个月;HR=0.45,95%CI 0.38~0.54;p<0.0001),独立中心评估的结果分别为11.0个月和 4.1个月(HR=0.38,95%CI 0.31~0.48;p<0.0001),且无论是整体人群还是前瞻定义的各个亚组(包括内脏转移的患者,在辅助治疗完成后12个月内复发的患者)都得出类似的结果;但联合依维莫司在增强疗效的同时也增加了口腔炎、贫血和呼吸困难等不良反应事件的发生率,最常见的3~4级不良反应事件为口腔炎(8%vs 1%)、贫血(6%vs<1%)、呼吸困难(4%vs 1%)、高血糖(4%vs<1%)、疲乏(4%vs 1%)和肺炎(3%vs 0)。因此,医生为患者选择依维莫司联合芳香化酶抑制剂治疗时要权衡疗效和不良反应,根据具体情况给予个体化治疗。
7.3 CDK4.6(Palbocicl ibicl ib)
2015年3月2日,美国FDA批准Palbociclib联合来曲唑作为ER阳性/HER2阴性绝经后晚期乳腺癌的初治方案。Palbociclib单药初治ER阳性/HER2阴性绝经后晚期乳腺癌时,将患者的无进展生存时间从10.2个月延长到20.2个月[18]。
7.4 PARPi
2014年12月,PARPi被美国FDA批准用于治疗BRCA1/2突变的卵巢癌患者,虽然还没有批准乳腺癌的治疗,但有临床研究显示其对BRCA1/2突变的乳腺癌也有效[19]。
8 不能手术的局部晚期乳腺癌
8.1 诊治原则
针对不能手术的局部晚期乳腺癌患者,首先要给予粗针穿刺活检,以明确病理诊断,并使用免疫组化法检测ER、PR、HER2和Ki-67等生物学标志物;另外,还要予以全面的分期检查。因为此类患者容易存在远处转移,所以专家组推荐优先选择胸部CT检查和腹部CT检查,而不是胸部X线平片和腹部超声检查,也可以考虑PET CT检查。
局部晚期乳腺癌的治疗应强调多学科综合治疗,包括全身性治疗、手术和放疗,目的是获得局部控制和长期生存[33-36]。
8.2 新辅助治疗后的手术治疗
经全身治疗和(或)放疗等有效的新辅助治疗后,部分患者可获得手术机会。大部分患者可以进行乳腺切除联合腋窝淋巴结清扫术,小部分疗效较好的患者可以考虑进行保乳手术。此外,即使全身治疗效果较好的患者,也推荐进行乳腺切除联合腋窝淋巴结清扫术。
8.3 局部晚期炎性乳腺癌的治疗
专家组建议:局部晚期炎性乳腺癌的治疗可与局部晚期非炎性乳腺癌相似,首先选择全身治疗;此类患者不推荐术后立即给予局部重建手术,即使获得病理学完全缓解,也需给予局部放疗(胸壁和淋巴结引流区)。
99 特殊转移部位的治疗
9.1 肝转移
目前亟需前瞻性、随机对照临床试验来评价乳腺癌肝转移局部治疗的价值。因为尚无随机对照临床试验的数据提示肝转移病灶的局部治疗能够延长患者生存时间,所以在进行局部治疗前,医生必须告知患者这一事实。局部治疗仅适用于身体状况好、转移部位局限于肝、无肝外转移病灶且全身治疗效果好的患者;要综合考虑各种治疗方式,包括手术、立体定位放疗、肝内灌注化疗或其他治疗方式。有文献报道,39例乳腺癌肝转移患者接受肝转移灶切除术,中位随访60个月,从肝的病灶切除开始计算,患者的无病生存时间和总生存时间分别为29.4个月和43.0个月。1年、3年、5年生存率分别为84.6%、64.1%和38.5%,提示外科手术切除能延长此类患者的长期生存时间[84]。
9.2 恶性胸腔积液
恶性胸腔积液需要全身治疗联合或不联合局部治疗。胸腔积液的患者必须进行胸腔穿刺来明确诊断,有症状的患者建议接受胸腔积液引流。恶性胸腔积液患者虽然可以考虑接受胸腔灌注药物治疗,包括顺铂、博来霉素、生物调节剂等;但其最佳治疗方式仍有待临床试验的进一步探索。
9.3 胸壁和区域淋巴结复发
99..3.1手术治疗 胸壁转移或区域淋巴结复发的患者很可能同时存在远处转移,因此,要接受包括胸部、腹部和骨骼检查在内的全面分期检查。当评估结果提示手术风险小且可行时,此类患者可接受手术治疗。
99..3.2放射治疗 复发区域未经放疗的患者可接受局部区域的放疗。复发区域做过放疗的患者,胸壁复发区域的再次放疗仅适用于个别患者。
99..3.3药物治疗 针对仅局部复发而无远处转移的患者,在局部手术联合或不联合放疗治疗后,建议行化疗、内分泌治疗和(或)抗HER2治疗的全身治疗。
在首次出现局部复发的患者中,激素受体阴性患者进行全身化疗可以改善预后,激素受体阳性患者进行内分泌治疗可以改善预后。
全身治疗方式的选择应根据肿瘤生物学特征、既往治疗情况、无病生存时间和患者自身因素(如伴随疾病和患者意愿等)来决定。
99..3.4姑息治疗 对不能进行根治性局部治疗的患者,姑息性的全身治疗应遵循转移性乳腺癌的治疗原则。这些患者也可接受姑息性的局部治疗。
9.4 骨转移
9 9..4.1药物治疗 有骨转移的转移性乳腺癌患者应在全身治疗中常规联合使用骨改良药物(如双膦酸盐、地诺单抗)[85]。
9 9..4.2手术或放疗 当骨转移灶引发患者持续的或固定部位的疼痛时,需进行影像学检查以明确病理性骨折的发生情况(将要发生或已发生)。如果病理性骨折位于长骨,可予以外科固定及后续放疗,并需要进行整形外科的评估。如疼痛部位没有明确的骨折风险,可进行放射治疗。
9.5 脑转移
9 9..5.1脊髓压迫的处理 脊髓压迫属于肿瘤急症,如出现相应的神经系统症状及体征时,应立即检查并进行处理。医生应对可能受压的部位及邻近部位进行充分的影像学检查,推荐采用MRI检查。一旦出现脊髓压迫,需要急诊外科(神经外科或整形外科)评估是否予以外科减压;如不能实施减压/固定术,可予以急诊放疗或椎体成形术。
9 9..5.2某些特殊情况的处理 对孤立的或数目有限的、有切除可能的脑转移灶,可进行外科切除或放射治疗,对某些不可切除的脑转移也可进行放射治疗。
9 9..5.3局部治疗的选择 HER2阳性脑转移的转移性乳腺癌患者的生存时间可长达几年,应避免治疗所致的长期毒性作用。在合适的情况下(如脑转移灶的数目较少),不良反应较小的局部治疗(如立体定向放疗)相对于全脑放疗可作为首选。
9.5..4 4脑转移的发生情况 转移性乳腺癌患者脑转移总的发生率为5%~16%,且不同亚型间的发生率不同,三阴性乳腺癌和HER2阳性乳腺癌脑转移的发生率较高[86]。
9.5..5 5脑转移的主要治疗原则 乳腺癌脑转移药物治疗的效果有限,主要依靠放射治疗及外科治疗。一部HER2阳性乳腺癌脑转移治疗指南[86]推荐的主要原则包括:①预后良好且仅有单个病灶的脑转移患者,可根据转移灶的大小、手术切除的可行性和有无症状,选择下述5种方式进行治疗:局部手术联合术后放射治疗;立体定向放射治疗(stereotactic radiosurgery,SRS);全脑放射治疗(whole brain radiotherapy,WBRT),联合或不联合SRS;分次立体定向放射治疗(fractionated stereotactic radiotherapy,FSRT);SRS,联合或不联合 WBRT。治疗后,推荐每2~4个月进行1次脑部MRI检查以监测脑转移情况。②预后良好且转移灶数目有限(2~4个)的患者,治疗选择包括:有症状且较大病灶的手术治疗联合术后放疗,对其他较小的病灶则行SRS;WBRT,联合或不联合 SRS;SRS,联合或不联合WBRT,对直径>3~4 cm的病灶行FSRT;对直径<3~4 cm的病灶行局部切除联合术后放疗。具体治疗的选择取决于转移灶可否切除和有无症状。③存在弥漫性病灶或广泛转移但预后相对较好的患者,以及有症状的软脑膜转移患者,可采用WBRT。④预后较差的患者,指南建议采用WBRT、最佳支持治疗和(或)姑息治疗。
10 支持治疗和姑息治疗
专业的支持治疗和姑息治疗,特别是控制症状的治疗,在进展期癌症的治疗中发挥至关重要的作用。该领域主要关注的是有效的镇痛治疗,包括使用足量的吗啡。疼痛治疗药物,如吗啡及其具有较高性价比的衍生物,对肿瘤相关症状的控制十分重要。
致谢:
本共识指南得到了北京阳光长城肿瘤项目、北京大学的支持,也得到了ABC2委员的支持。
在这里,我们还感谢在指南撰写和推广之初就亲力亲为地参与和给予指导的孙燕院士、沈镇宙教授、张嘉庆教授,以及北京大学常务副校长柯杨教授和北京大学肿瘤医院院长季加孚教授的支持和指导;同时感谢在指南撰写和发表过程中邵志敏教授和徐兵河教授的支持;以及在本指南更新时与甄志成、李想、周行、赖明龙的讨论,在推广、完善过程中得到徐曼杰、杨晓炜、黄皓宇、宜乐、芮晓、陈一龙、郭敏、是豪、梅凌、王前的支持;并感谢北京大学肿瘤医院乳腺肿瘤内科医师在资料整理过程中所做的辛勤工作。
[1]Khodari W,Sedrati A,Naisse I,et al.Impact of loco-regional treatment on metastatic breast cancer outcome:a review[J].Crit Rev Oncol Hematol,2013,87(1):69-79.
[2]Kennecke H,Yerushalmi R,Woods R,et al.Metastatic behavior of breast cancer subtypes[J].J Clin Oncol,2010,28(20):3271-3277.
[3]Berman AT,Thukral AD,Hwang WT,et al.Incidence and patterns of distant metastases for patients with earlystage breast cancer after breast conservation treatment[J].Clin Breast Cancer,2013,13(2):88-94.
[4]Bonotto M,Gerratana L,Poletto E,et al.Measures of outcome in metastatic breast cancer:insights from a realworld scenario[J].Oncologist,2014,19(6):608-615.
[5]Dawood S,Broglio K,Buzdar AU,et al.Prognosis of women with metastatic breast cancer by HER2 status and trastuzumab treatment:an institutional-based review[J].J Clin Oncol,2010,28(1):92-98.
[6]Gerratana L,Fanotto V,Bonotto M,et al.Pattern of metastasis and outcome in patients with breast cancer[J].Clin Exp Metastasis,2015,32(2):125-133.
[7]Lee SJ,Park S,Ahn HK,et al.Implications of bone-only metastases in breast cancer:favorable preference with excellent outcomes of hormone receptor positive breast cancer[J].Cancer Res Treat,2011,43(2):89-95.
[8]李惠平,Rugo HS,张瑾,等.首届中国进展期乳腺癌共识指南(草案)[J].癌症进展,2013,11(6):500-505.
[9]Cardoso F,Costa A,Norton L,et al.ESO-ESMO 2nd international consensus guidelines for advanced breast cancer(ABC2)[J].Breast,2014,23(5):489-502.
[10]Cardoso F,Costa A,Norton L,et al.ESO-ESMO 2nd international consensus guidelines for advanced breast cancer(ABC2)[J].Ann Oncol,2014,25(10):1871-1888.
[11]National Comprehensive Cancer Network.NCCN Clinical Practice Guidelines in Oncology.Breast Cancer,2014,Version 3[DB/OL].Fort Washington PA:National Comprehensive Cancer Network,2014.http://www.nccn.org/professionals/physician_gls/pdf/breast.pdf.
[12]中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2013版)[J].中国癌症杂志,2013,23(8):637-693.
[13]Chirgwin J,Craike M,Gray C,et al.Does multidisciplinary care enhance the management of advanced breast cancer:evaluation of advanced breast cancer multidisciplinary team meetings[J].J Oncol Pract,2010,6(6):294-300.
[14]Ueno NT,Ito TD,Grigsby RK,et al.ABC conceptual model of effective multidisciplinary cancer care[J].Nat Rev Clin Oncol,2010,7(9):544-547.
[15]Blumenthal GM,Scher NS,Cortazar P,et al.First FDA approval of dual anti-HER2 regimen:pertuzumab in combination with trastuzumab and docetaxel for HER2-positive metastatic breast cancer[J].Clin Cancer Res,2013,19(18):4911-4916.
[16]Verma S,Miles D,Gianni L,et al.Trastuzumab emtansine for HER2-positive advanced breast cancer[J].N Engl JMed,2012,367(19):1783-1791.
[17]Baselga J,Campone M,Piccart M,et al.Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer[J].N Engl JMed,2012,366(6):520-529.
[18]Finn RS,Crown JP,Lang I,et al.The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive,HER2-negative,advanced breast cancer(PALOMA-1/TRIO-18):a randomised phase 2 study[J].Lancet Oncol,2015,16(1):25-35.
[19]Del Conte G,Sessa C,von Moos R,et al.Phase I study of olaparib in combination with liposomal doxorubicin in patients with advanced solid tumours[J].Br J Cancer,2014,111(4):651-659.
[20]Kaufman B,Shapira-Frommer R,Schmultzler RK,et al.Olaparib monotherapy in patients with advanced cancer and a germline BRCA1/2 mutation[J].J Clin Oncol,2015,33(3):244-250.
[21]D'Agostino RB Sr.Changing end points in breast-cancer drug approval--the Avastin story[J].N Engl J Med,2011,365(2):e2.
[22]Bruner DW,Movsas B,Basch E.Capturing the patient perspective:patient-reported outcomes as clinical trial endpoints[J].Am Soc Clin Oncol Educ Book,2012:139-144.
[23]Rakha EA,Starczynski J,Lee AH,et al.The updated ASCO/CAP guideline recommendations for HER2 testing in the management of invasive breast cancer:a critical review of their implications for routine practice[J].Histopathology,2014,64(5):609-615.
[24]Wong H,Leung R,Kwong A,et al.Integrating molecular mechanisms and clinical evidence in the manage-ment of trastuzumab resistant or refractory HER-2+metastatic breast cancer[J].Oncologist,2011,16(11):1535-1546.
[25]Arslan C,Sari E,Aksoy S,et al.Variation in hormone receptor and HER-2 status between primary and metastatic breast cancer:review of the literature[J].Expert Opin Ther Targets,2011,15(1):21-30.
[26]Pusztai L,Viale G,Kelly CM,et al.Estrogen and HER-2 receptor discordance between primary breast cancer and metastasis[J].Oncologist,2010,15(1.164-1168.
[27]Rosen EL,Eubank WB,Mankoff DA.FDG PET,PET/CT,and breast cancer imaging[J].Radiographics,2007,27(1 Suppl):S215-229.
[28]Eubank WB,Mankoff D,Bhattacharya M,et al.Impact of FDG PET on defining the extent of disease and on the treatment of patients with recurrent or metastatic breast cancer[J].AJR AM J Roentgenol,2004,183(2):479-486.
[29]叶蓓,柳光宇,陆劲松,等.常用的乳腺癌血清肿瘤标志物在早期诊断中的应用价值不高[J].中国癌症杂志,2009,19(10):807-808.
[30]Carlson RW,Allred DC,Anderson BO,et al.Metastatic breast cancer,version 1.2012:featured updates to the NCCN guidelines[J].J Natl Compr Canc Netw,2012,10(7):821-829.
[31]Jiang ZF,Cristofanilli M,Shao ZM,et a1.Circulating tumor cells predict progression-free and overall survival in Chinese patients with metastatic breast cancer,HER2-positive or triple-negative(CBCSG004):a multicenter,double-blind,prospective trial[J].Ann Oncol,2013,24(11):276.72.
[32]李惠平,马力文,张淑兰,等.绝经前乳腺癌化疗致闭经的观察及临床意义[J].中华肿瘤杂志,2006,28(11):848-851.
[33]Dominici L,Najita J,Hughes M,et al.Surgery of the primary tumor does not improve survival in stage IV breast cancer[J].Breast Cancer Res Treat,2011,129(2):459-465.
[34]Rashaan ZM,Bastiaannet E,Portielje JE,et al.Surgery in metastatic breast cancer:patients with a favorable profile seem to have the most benefit from surgery[J].Eur JSurg Oncol,2012,38(1):52-56.
[35]Ly BH,Vlastos G,Rapiti E,et al.Local-regional radiotherapy and surgery is associated with a significant survival advantage in metastatic breast cancer patients[J].Tumori,2010,96(6):947-954.
[36]Neuman HB,Morrogh M,Gonen M,et al.Stage IV breast cancer in the era of targeted therapy:does surgery of the primary tumor matter?[J].Cancer,2010,116(5):1226-1233.
[37]宋三泰.晚期乳腺癌如何选择内外科治疗[J].医学与哲学,2014,35(8B):10-11;15.
[38]Wilcken N,Hornbuckle J,Ghersi D.Chemotherapy alone versus endocrine therapy alone for metastatic breast cancer[J].Cochrane Database Syst Rev,2003,2:CD002747.
[39]Higgins MJ,Wolff AC.Therapeutic options in the management of metastatic breast cancer[J].Oncology(Williston Park),2008,22(6):614-623.
[40]李惠平,季加孚,侯宽永,等.芳香化酶抑制剂治疗晚期乳腺癌的临床研究[J].北京大学学报(医学版),2007,39(2):193-196.
[41]Nabholtz JM,Buzdar A,Pollak M,et al.Anastrozole is superior to tamoxifen as first-line therapy for advanced breast cancer in postmenopausal women:results of a North American multicenter randomized trial.Arimidex Study Group[J].J Clin Oncol,2000,18(22):3758-3767.
[42]Paridaens RJ,Dirix LY,Beex LV,et al.Phase III study comparing exemestane with tamoxifen as first-line hormonal treatment of metastatic breast cancer in postmenopausal women:the European Organisation for Research and Treatment of Cancer Breast Cancer Cooperative Group[J].JClin Oncol,2008,26(30):4883-4890.
[43]Di Leo A,Jerusalem G,Petruzelka L,et al.Results of the CONFIRM phase III trial comparing fulvestrant 250 mg with fulvestrant 500 mg in postmenopausal women with estrogen receptor-positive advanced breast cancer[J].JClin Oncol,2010,28(30):4594-4600.
[44]Robertson JF,Lindemann JP,Llombart-Cussac A,et al.advanced breast cancer:follow-up analysis from the randomized'FIRST'study[J].Breast Cancer Res Treat,2012,136(2):503-511.
[45]Di Leo A,Jerusalem G,Petruzelka L,et al.Final overall survival:fulvestrant 500 mg vs 250 mg in the randomized CONFIRM trial[J].J Natl Cancer Inst,2014,106(1):djt337.
[46]刘芊,王涛,江泽飞,等.药物性卵巢去势联合阿那曲唑治疗绝经前转移性乳腺癌患者的临床研究[J].肿瘤研究与临床,2012,24(6):392-394.
[47]Yardley DA,Noguchi S,Pritchard KI,et al.Everolimus plus exemestane in postmenopausal patients with HR(+)breast cancer:BOLERO-2 final progression-free survival analysis[J].Adv Ther,2013,30(10):870-884.
[48]Massarweh S,Romond E,Black EP,et al.A phase II study of combined fulvestrant and everolimus in patients with metastatic estrogen receptor(ER)-positive breast cancer after aromatase inhibitor(AI)failure[J].Breast Cancer Res Treat,2014,143(2):325-332.
[49]Martin LA,Pancholi S,Farmer I,et al.Effectiveness and molecular interactions of the clinically active mTORC1 inhibitor everolimus in combination with tamoxifen or letrozole in vitro and in vivo[J].Breast Cancer Res,2012,14(5):R132.
[50]Kaufman B,Mackey JR,Clemens MR,et al.Trastuzumab plus anastrozole versus anastrozole alone for the treatment of postmenopausal women with human epidermal growth factor receptor 2-positive,hormone receptor-positive metastatic breast cancer:results from the randomized phase III TAnDEM study[J].J Clin Oncol,2009,27(3.529-5537.
[51]Johnston S,Pippen J Jr,Pivot X,et al.Lapatinib combined with letrozole versus letrozole and placebo as first-line therapy for postmenopausal hormone receptorpositive metastatic breast cancer[J].J Clin Oncol,2009,27(3.538-5546.
[52]Slamon DJ,Leyland-Jones B,Shak S,et al.Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2[J].N Engl J Med,2001,344(11):783-792.
[53]Olson EM,Najita JS,Sohl J,et al.Clinical outcomes and treatment practice patterns of patients with HER2-positive metastatic breast cancer in the post-trastuzumab era[J].Breast,2013,22(4):525-531.
[54]Perez EA,Romond EH,Suman VJ,et al.Trastuzumab plus adjuvant chemotherapy for human epidermal growth factor receptor 2-positive breast cancer:planned joint analysis of overall survival from NSABP B-31 and NCCTG N9831[J].J Clin Oncol,2014,32(33):3744-3752.
[55]Marty M,Cognetti F,Maraninchi D,et al.Randomized phase II trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer administered as first-line treatment:the M77001 study group[J].J Clin Oncol,2005,23(19):4265-4574.
[56]江泽飞,邵志敏,徐兵河.人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识[J].中华肿瘤杂志,2010,32(2):158-160.
[57]Jackisch C,Welslau M,Schoenegg W,et al.Impact of trastuzumab treatment beyond disease progression for advanced/metastatic breast cancer on survival-results from a prospective,observational study in Germany[J].Breast,2014,23(5):603-608.
[58]von Minckwitz G,du Bois A,Schmidt M,et al.Trastuzumab beyond progression in human epidermal growth factor receptor 2-positive advanced breast cancer:a german breast group 26/breast international group 03-05 study[J].JClin Oncol,2009,27(12):1999-2006.
[59]Extra JM,Antoine EC,Vincent-Salomon A,et al.Efficacy of trastuzumab in routine clinical practice and after progression for metastatic breast cancer patients:the observational Hermine study[J].Oncologist,2010,15(8):799-809.
[60]Bian L,Wang T,Zhang S,et al.Trastuzumab plus capecitabine vs.lapatinib plus capecitabine in patients with trastuzumab resistance and taxane-pretreated metastatic breast cancer[J].Tumour Biol,2013,34(5):3153-3158.
[61]Blackwell KL,Burstein HJ,Storniolo AM,et al.Randomized study of Lapatinib alone or in combination with trastuzumab in women with ErbB2-positive,trastuzumab-refractory metastatic breast cancer[J].J Clin Oncol,2010,28(7):1124-1230.
[62]Blackwell KL,Burstein HJ,Storniolo AM,et al.Overall survival benefit with lapatinib in combination with trastuzumab for patients with human epidermal growth factor receptor 2-positive metastatic breast cancer:final results from the EGF104900 Study[J].J Clin Oncol,2012,30(21):2585-2592.
[63]Shawky H,Tawfik H.All-oral combination of lapatinib and capecitabine in patients with brain metastases from HER2-positive breast cancer--a phase II study[J].J Egypt Natl Canc Inst,2014,26(4):187-194.
[64]Geyer CE,Forster J,Lindquist D,et al.Lapatinib plus capecitabine for HER2-positive advanced breast cancer[J].N Engl J Med,2006,355(26):2733-2743.
[65]Swain SM,Kim SB,Cortés J,et al.Pertuzumab,trastuzumab,and docetaxel for HER2-positive metastatic breast cancer(CLEOPATRA study):overall survival results from a randomised,double-blind,placebo-controlled,phase 3 study[J].Lancet Oncol,2013,14(6):461-471.
[66]Cortés J,Fumoleau P,Bianchi GV,et al.Pertuzumab monotherapy after trastuzumab-based treatment and subsequent reintroduction of trastuzumab:activity and tolerability in patients with advanced human epidermal growth factor receptor 2-positive breast cancer[J].J Clin Oncol,2012,30(14):1594-1600.
[67]Blackwell KL,Miles D,Gianni L,et al.Primary results from EMILIA,a phase III study of trastuzumab emtansine(T-DM1)versus capecitabine(X)and lapatinib(L)in HER2-positive locally advanced or metastatic breast cancer(MBC)previously treated with trastuzumab(T)and a taxane[J].J Clin Oncol,2012,30(15 Suppl):Abstr LBA1.
[68]余峰,张霄蓓,张晟,等.三阴性乳腺癌复发特征及危险因素分析[J].中华医学杂志,2014,94(28):2180-2183.
[69]Byrski T,Huzarski T,Dent R,et al.Pathologic complete response to neoadjuvant cisplatin in BRCA1-positive breast cancer patients[J].Breast Cancer Res Treat,2014.,147(2),401-405.
[70]袁芃,徐兵河,王佳玉,等.多西他赛联合卡铂方案与表柔比星联合环磷酰胺序贯多西他赛方案辅助治疗三阴性乳腺癌Ⅲ期临床研究的安全性[J].中华肿瘤杂志,2012,34(6):465-468.
[71]陈灿铭,沈坤炜,柳光宇,等.长春瑞滨和表阿霉素联合新辅助化疗方案治疗局部晚期乳腺癌的临床研究[J].中华外科杂志,2006,44(11):745-747.
[72]Martín M,Ruiz A,Muñoz M,et al.Gemcitabine plus vinorelbine versus vinorelbine monotherapy in patients with metastatic breast cancer previously treated with anthracyclines and taxanes:final results of the phase III Spanish Breast Cancer Research Group(GEICAM)trial[J].Lancet Oncol,2007,8(3):219-225.
[73]Bajetta E,Procopio G,Celio L,et al.Safety and efficacy of two different doses of capecitabine in the treatment of advanced breast cancer in older women[J].J Clin Oncol,2005,23(10):2155-2161.
[74]洪熠,陈心华,李娜妮,等.白蛋白结合型紫杉醇治疗转移性乳腺癌的临床疗效与安全性观察[J].中国肿瘤临床,2012,39(6):352-354.
[75]梁旭,李惠平,邸立军,等.白蛋白结合型紫杉醇治疗晚期难治性乳腺癌的疗效及安全性分析[J].中国癌症杂志,2014,24(11):836-845.
[76]Gennari A,Stockler M,Puntoni M,et al.Duration of chemotherapy for metastatic breast cancer:a systematic review and meta-analysis of randomized clinical trials[J].J Clin Oncol,2011,29(16):2144-2149.
[77]Liang X,Di L,Song G,et al.Capecitabine maintenance therapy for XT chemotherapy-sensitive patients with metastatic triple-negative breast cancer[J].Chin J Cancer Res,2014,26(5):550-557.
[78]Sledge GW,Neuberg D,Bernardo P,et al.Phase III trial of doxorubicin,paclitaxel,and the combination of doxorubicin and paclitaxel as front-line chemotherapy for metastatic breast cancer:an intergroup trial(E1193)[J].JClin Oncol,2003,21(4):588-592.
[79]Dear RF,McGeechan K,Jenkins MC,et al.Combination versus sequential single agent chemotherapy for metastatic breast cancer[J].Cochrane Database Syst Rev,2013,12:CD008792.
[80]Miller K,Wang M,Gralow J,et al.Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer[J].N Engl JMed,2007,357(26):2666-2676.
[81]Miles DW,Chan A,Dirix LY,et al.Phase III study of bevacizumab plus docetaxel compared with placebo plus docetaxel for the first-line treatment of human epidermal growth factor receptor 2-negative metastatic breast cancer[J].J Clin Oncol,2010,28(20):3239-3247.
[82]Robert NJ,Diéras V,Glaspy J,et al.RIBBON-1:randomized,double-blind,placebo-controlled,phase III trial of chemotherapy with or without bevacizumab for first-line treatment of human epidermal growth factor receptor 2-negative,locally recurrent or metastatic breast cancer[J].J Clin Oncol,2011,29(10):1252-1260.
[83]Valachis A,Polyzos NP,Patsopoulos NA,et al,Bevacizumab in metastatic breast cancer:a meta-analysis of randomized controlled trials[J].Breast Cancer Res Treat,2010,122(1):1-7.
[84]Kostov DV,Kobakov GL,Yankov DV.Prognostic factors related to surgical outcome of liver metastases of breast cancer[J].JBreast Cancer,2013,16(2):184-192.
[85]江泽飞,陈佳艺,牛晓辉,等.乳腺癌骨转移和骨相关疾病临床诊疗专家共识(2014版)[J].中华医学杂志,2015,95(4):241-247.
[86]Ramakrishna N,Temin S,Chandarlapaty S,et al.Recommendations on disease management for patients with advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases:American Society of Clinical Oncology clinical practice guideline[J].JClin Oncol,2014,32(19):2100-2108.
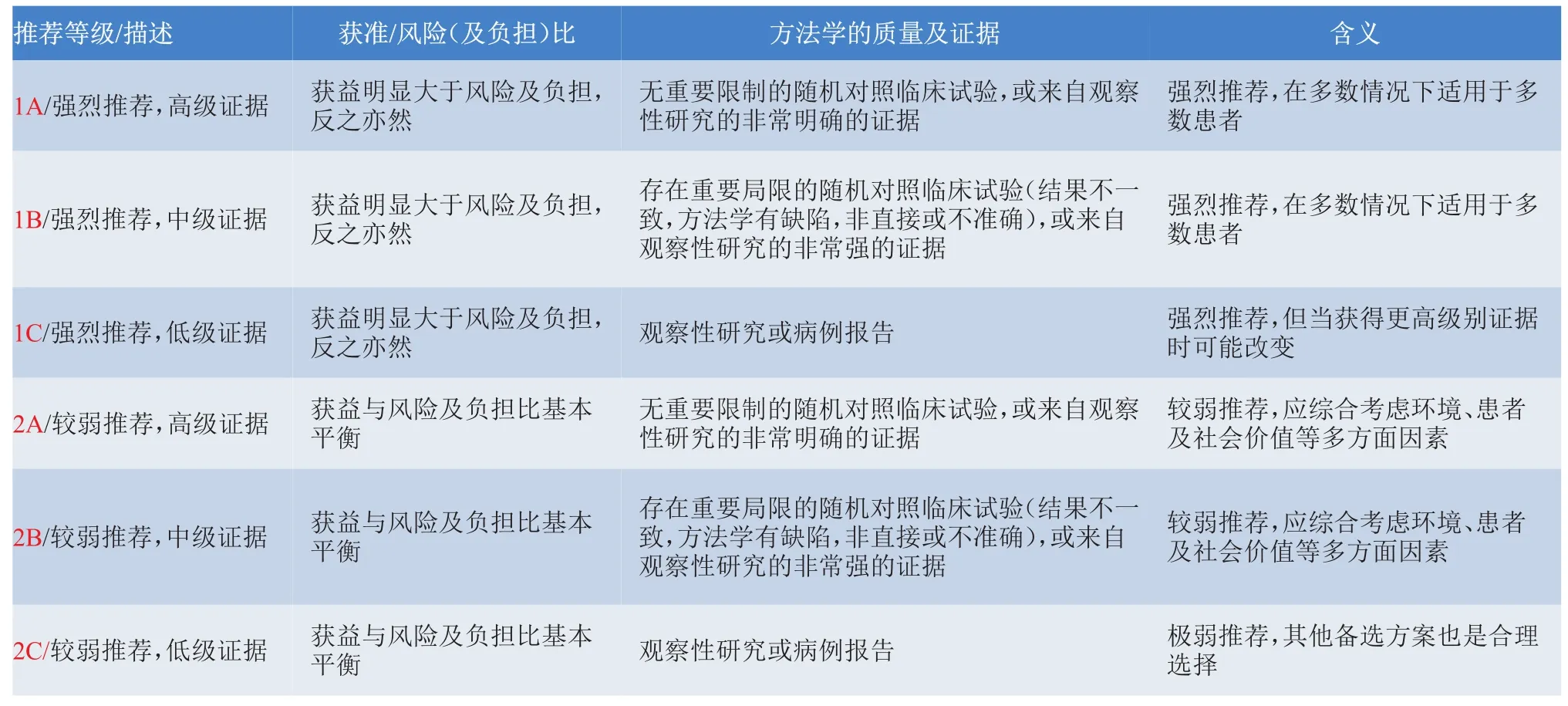
附1证据等级
推荐等级//描述1A/强烈推荐,高级证据1B/强烈推荐,中级证据1C/强烈推荐,低级证据2A/较弱推荐,高级证据2B/较弱推荐,中级证据2C/较弱推荐,低级证据获准//风险(及负担)比获益明显大于风险及负担,反之亦然获益明显大于风险及负担,反之亦然获益明显大于风险及负担,反之亦然获益与风险及负担比基本平衡获益与风险及负担比基本平衡获益与风险及负担比基本平衡方法学的质量及证据无重要限制的随机对照临床试验,或来自观察性研究的非常明确的证据存在重要局限的随机对照临床试验(结果不一致,方法学有缺陷,非直接或不准确),或来自观察性研究的非常强的证据观察性研究或病例报告无重要限制的随机对照临床试验,或来自观察性研究的非常明确的证据存在重要局限的随机对照临床试验(结果不一致,方法学有缺陷,非直接或不准确),或来自观察性研究的非常强的证据观察性研究或病例报告含义强烈推荐,在多数情况下适用于多数患者强烈推荐,在多数情况下适用于多数患者强烈推荐,但当获得更高级别证据时可能改变较弱推荐,应综合考虑环境、患者及社会价值等多方面因素较弱推荐,应综合考虑环境、患者及社会价值等多方面因素极弱推荐,其他备选方案也是合理选择
附2乳腺内科患者不良反应评价表

方案性别周期数病案号日期姓名全身症状1. 乏力(嗜睡、不适、虚弱)□ 无 □ 轻度乏力 □ 中度乏力,影响一些日常活动的进行□ 重度乏力,妨碍日常生活、活动,大部分时间卧床 □致残2. 出汗(盗汗)□ 无 □ 轻度,偶尔 □ 经常,大汗淋漓3. 失眠(请排除因疼痛或其他症状影响睡眠的情况)□ 无 □ 偶尔难以入睡,不影响功能□ 难以入睡,影响功能,但不妨碍日常生活、活动 □ 经常难以入睡,妨碍日常生活、活动4. 体重下降□ 无 □5%~10%,不需治疗□ 10%~20%,需营养支持 □ ≥20%鼻饲或胃肠外营养胃肠道反应1. 厌食□ 无 □ 食欲缺乏,进食量与饮食习惯同前□ 进食量下降,进食习惯改变,但无明显的体重下降□ 明显的体重下降,营养不良,需口服或静脉营养支持2. 接受治疗后食欲缺乏的时间□ 无食欲缺乏 □持续时间不超过3天 □ 持续时间不超过1周□ 持续时间约1~2周 □ 持续时间在2周以上3. 吞咽困难□ 无 □ 有,但能正常进食 □ 干硬食物需用水送服,能进软流食□仅能进流食 □ 不能进食4. 黏膜炎/口腔炎□ 无 □ 黏膜充血,但可正常进食

□ 黏膜溃疡,但能进食与吞咽较软的食物 □ 影响进食,有黏膜出血5. 胃部灼烧□ 轻度 □中度 □ 重度6. 味觉改变□ 无 □ 有,但不影响进食□ 影响进食,有恶心味觉 □ 有味觉丧失7. 恶心、呕吐□ 无 □ 恶心、无呕吐 □ 24小时内呕吐1次□ 24小时内呕吐2~5次□ 24小时内呕吐6次以上,需静脉输液□ 持续时间小于3天 □ 持续时间小于1周 □ 持续时间大于1周8. 腹胀□ 无 □ 有症状,但不影响排便 □ 有症状,影响进食与排便9. 便秘□ 无 □ 偶尔,偶尔需饮食调节、缓泻剂或通便药□ 持久性,需长期用缓泻剂或通便药 □ 需手工疏通的顽固性便秘10.腹泻□ 无 □ 与平日相比,大便增加次数<4次/天□ 与平日相比,大便次数增加4~6次/天 □ 与平日比,大便次数增加≥7次/天,失禁□ 持续时间<1天 □ 持续时间<3天 □ 持续时间<1天□ 持续时间>1周 □ 不需用止泻药物 □ 需用止泻药物皮肤1. 皮肤干燥□ 无 □ 症状不影响日常生活活动 □ 妨碍日常生活活动2. 潮红□ 无 □ 有3. 毛发脱落/秃顶□ 无 □ 轻度或斑片状 □ 完全4. 色素沉着□ 无 □ 轻度或局部 □ 显著或全身5. 色素减退□ 无 □ 轻度或局部 □ 显著或全身6. 指甲改变□ 无 □ 脱色起嵴(钥匙甲)孔蚀□ 失去部分或全部指甲或甲床疼痛 □ 影响日常生活、活动7. 瘙痒□ 无 □ 轻度或局部 □ 强烈或广泛 □ 强烈或广泛,且妨碍日常生活、活动8. 皮疹/手足综合征□ 无 □ 无症状的斑疹、丘疹、红斑、无痛性,无液体渗出□ 伴瘙痒或疼痛,局部脱皮,脱屑,大水疱,出血,水肿,<50%体表面的其他皮损,不影响功能□ 严重的、全身的、>50%体表面积的脱皮,疼痛,影响功能其他1. 肌肉关节酸痛、无力、关节炎□ 无 □ 轻度疼痛,不影响功能 □ 疼痛明显,影响功能与日常生活

2. 疼痛(0代表无痛,7以上的疼痛影响睡眠,10代表所能想象的、无法忍受的疼痛)□0 □1 □2 □3 □4 □5 □6 □7 □8 □9 □10 3. 神经毒性(肢端麻木、疼痛、感觉异常)□无 □ 化疗期间存在,下个周期化疗前缓解□下个周期化疗前不能缓解 □停药后仍持续存在4. 接受治疗后是否有症状改善□有改善 □同前无改变 □较前恶化5.其他_____________________________________________________________________
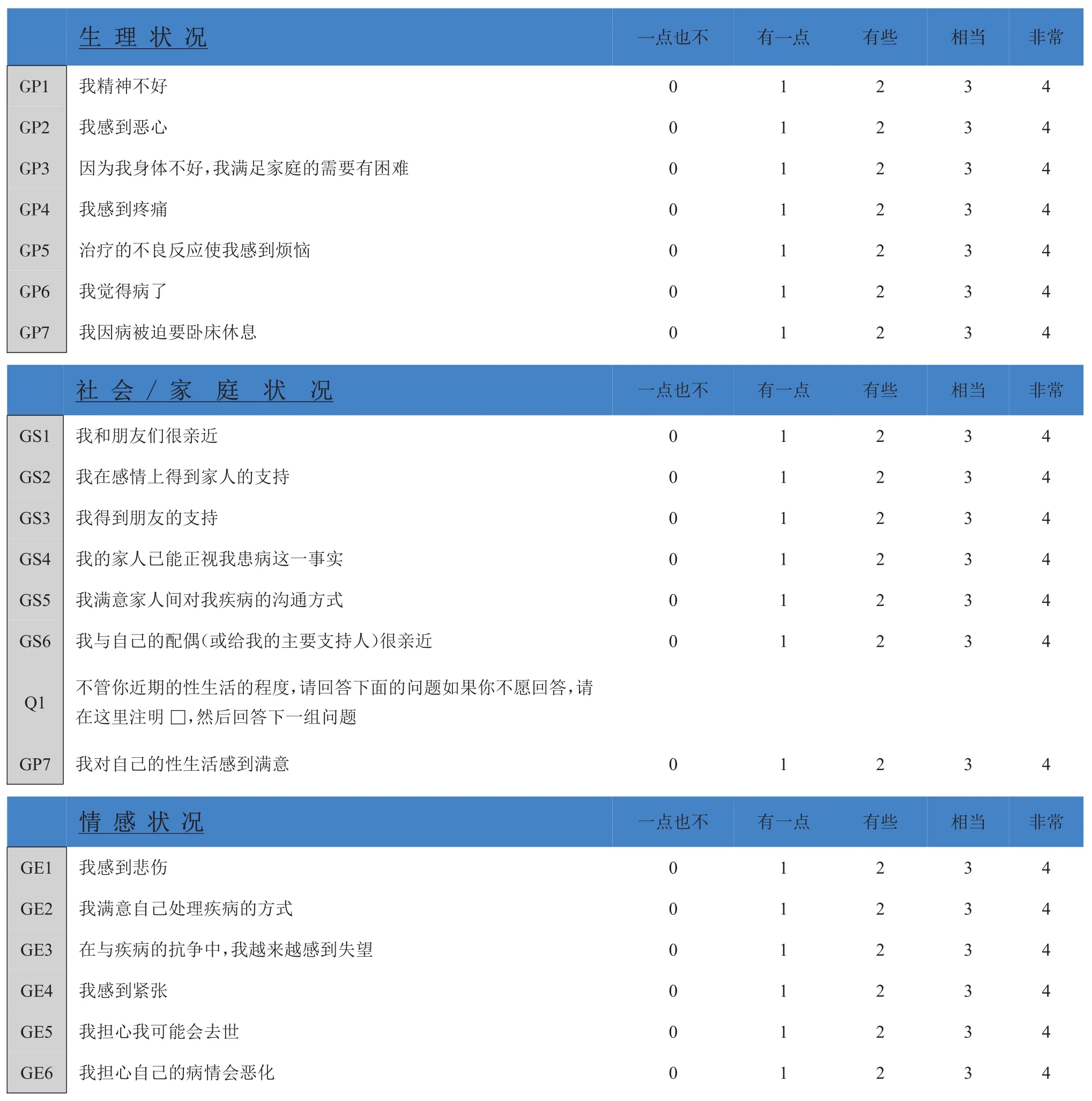
附3生活质量评价表(FACT-BACT-B第4 4版)
以下是一些与您患有同样疾病的人所认为重要的陈述。请在每行圈选或标出一个数字来表明适用于您过去7天情况的回答。
生理状况GP1 GP2 GP3 GP4 GP5 GP6 GP7我精神不好我感到恶心因为我身体不好,我满足家庭的需要有困难我感到疼痛治疗的不良反应使我感到烦恼我觉得病了我因病被迫要卧床休息社 会//家 庭 状 况GS1 GS2 GS3 GS4 GS5 GS6 Q1 GP7我和朋友们很亲近我在感情上得到家人的支持我得到朋友的支持我的家人已能正视我患病这一事实我满意家人间对我疾病的沟通方式我与自己的配偶(或给我的主要支持人)很亲近不管你近期的性生活的程度,请回答下面的问题如果你不愿回答,请在这里注明□,然后回答下一组问题我对自己的性生活感到满意情感状况GE1 GE2 GE3 GE4 GE5 GE6我感到悲伤我满意自己处理疾病的方式在与疾病的抗争中,我越来越感到失望我感到紧张我担心我可能会去世我担心自己的病情会恶化一点也不0 0 0 0 0 0 0一点也不0 0 0 0 0 0 0一点也不0 0 0 0 0 0有一点1 1 1 1 1 1 1有一点1 1 1 1 1 1 1有一点1 1 1 1 1 1有些2 2 2 2 2 2 2有些2 2 2 2 2 2 2有些2 2 2 2 2 2相当3 3 3 3 3 3 3相当3 3 3 3 3 3 3相当3 3 3 3 3 3非常4 4 4 4 4 4 4非常4 4 4 4 4 4 4非常4 4 4 4 4 4
(由北京肿瘤医院郭奕强提供)
附4转移性乳腺癌监测原则
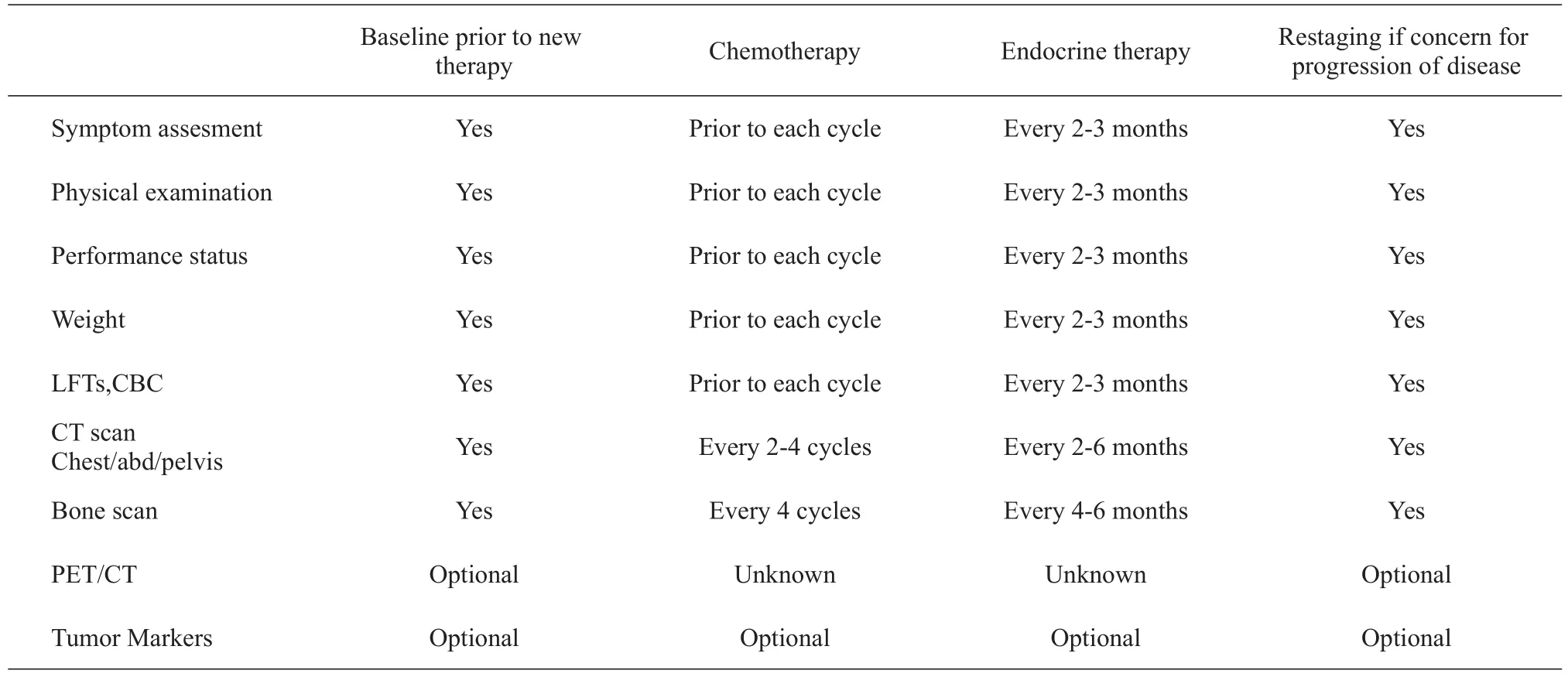
PRINCIPLES OF MONITORING METASTATIC DISEASE EASESuggested Intervals of follow-up for patients with metastatic disease1
附5实体瘤的疗效评价标准(RECI STECI ST)版本1.1
(参考Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].Eur JCancer,2009,45(2):228-247.)
基线病灶分类
可测量病灶
·至少有一条可以精确测量径线的病灶。
·根据CT或MRI评价,病灶最长直径至少为2个层厚≥10 mm(层厚5~8 mm)。·根据胸部X线评价,病灶最长直径至少20 mm。·根据测径器评价,最长直径≥10 mm的浅表性病灶。
·根据CT评价,恶性肿瘤淋巴结短轴≥15 mm。
注:恶性肿瘤淋巴结用最短轴作为直径,其他可测量病灶用最长轴。
不可测量病灶
不可测量病灶包括小病灶(包括短轴在10~14.9 mm的淋巴结)和真正无法测量的病灶,如胸腔或心包积液、腹腔积液、炎性乳腺疾病、软脑膜病、累及皮肤或肺的淋巴管炎,测径器不能准确测量的临床病灶,体检发现的腹部肿块,重现影像技术无法测量的病灶。
骨病:骨病为不可测量的疾病,除软组织成分可采用CT或MRI评价外,并且符合基线时可评价的定义。
既往局部治疗:既往放疗病灶(或其他局部治疗的病灶)为不可测量病灶,除非治疗完成后进展。
特殊情况
囊性病灶:单纯囊肿不应视为恶性病灶,也不应记录为靶病灶或非靶病灶。目前认为是囊性转移的囊性病灶是可测量病灶,如果符合上述特定定义,还出现了非囊性病灶,那么这些病灶将作为靶病灶。
小结节:短轴<10 mm的结节被视为正常,不应记录或按照可测量或不可测量病灶分类。
治疗评价记录
在基线时必须评价所有部位疾病。基线评价应尽量在接近试验开始前进行。对于充分的基线评价,治疗前28天内必须进行所有要求的扫描,所有疾病必须正确记录。如果基线评价不充分,以后的状况通常为不确定。
靶病灶
基线时可测量病灶不只1个时,所有可测量病灶(具有代表性的病灶,最多5个,每器官最多2个)应视为基线靶病灶。根据大小(最长病灶)和适合性选择靶病灶准确重复测量。记录每个病灶的最长直径,除外病理学淋巴结(应记录短轴)。基线时所有靶病灶直径(非结节病灶的最长径,结节病灶的最短轴)的总和是试验中进行评价比较的基础。
若两个病灶融合,就测量融合的肿块。如果靶病灶分裂,则使用各部分的总和。
应继续记录变小的靶病灶的测量结果。如果靶病灶变得太小而不能测量,如认为病灶已消失则记录为0 mm;反之应记录为默认值5 mm。
注:结节性病灶缩小至<10 mm(正常),仍应记录实际测量结果。
非靶病灶
所有不可测量的疾病均为非靶病灶。所有未鉴别为靶病灶的可测量病灶也纳入非病灶疾病。不需要进行测量,但是评价以“无、不确定、有/未增大、增大”表示。1个器官的多发性非靶病灶在病例报告表上记录为一项(例如,“多发性骨盆淋巴结增大”或“多发性肝转移”)。
客观缓解状态评价(表1.2)
疾病部位评价必须采用与基线相同的方法,包括一致进行增强和及时的扫描。如需变化,必须与放射学医生讨论该病例以明确是否可能用替代法。如不能,以后的客观状况为不明确。
靶病灶
·完全缓解(CR):除结节性疾病外,所有靶病灶完全消失。所有靶结节须缩小至正常大小(短轴<10 mm)。所有靶病灶均须评价。
·部分缓解(PR):所有可测量靶病灶的直径总和低于基线≥30%。靶结节总和使用短径,而所有其他靶病灶的总和使用最长直径。所有靶病灶均须评价。
·稳定(SD):不符合CR、PR或疾病进展的情况。所有靶病灶均须评价。仅在总增大相对于谷值<20%的罕见病例,PR后可获得稳定,但尚未达到以前记录缩小30%的水平。
·疾病进展(PD):可测量靶病灶的直径总和增大20%,超过观察到的最小总和(超过基线,如治疗期间未观察到总和降低),最小绝对值升高5 mm。
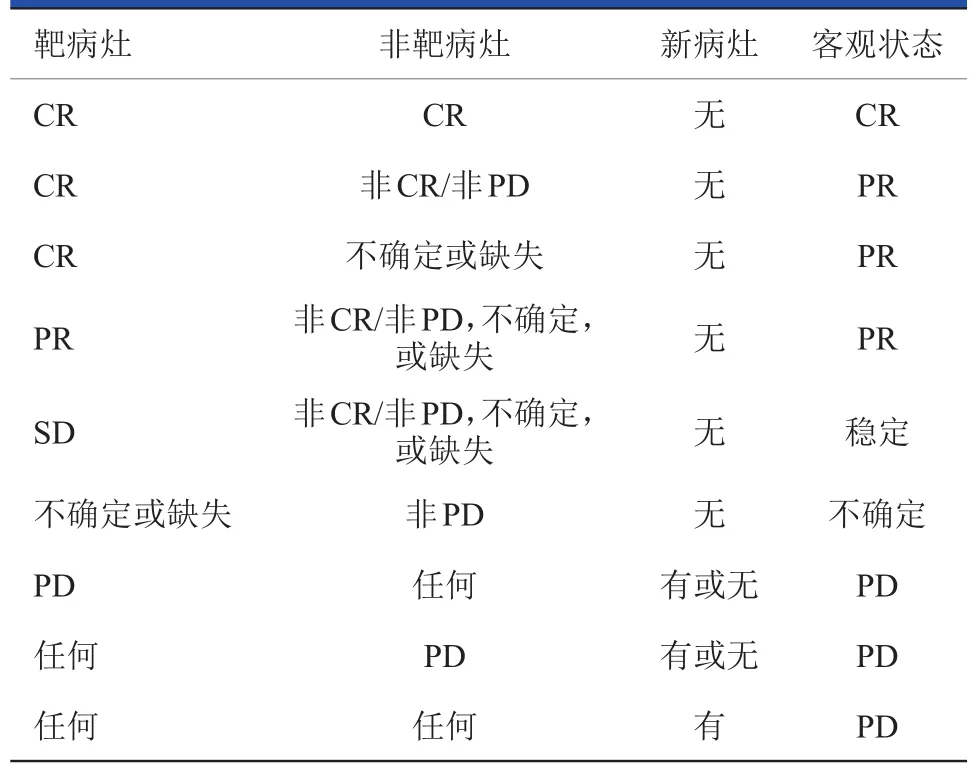
表11 靶病灶(++//--非靶病灶)患者客观缓解状态评价
·不确定。未记录进展,且:①1个或以上可测量的靶病灶未评价;②或所用评价方法与基线不一致;③或1个或以上靶病灶不能准确测量(例如,看不清除,除非由于太小而不能测量);④或1个或以上靶病灶被切除或辐射,且未复发或增大。
非靶病灶
·CR:所有非靶病灶消失或肿瘤标志物水平正常。所有淋巴结大小必须“正常”(短轴<10 mm)。
·非CR/非PD:任何非靶病灶持续存在和(或)肿瘤标志物水平高于正常上限。
·PD:已有病灶明确进展。通常,总体肿瘤负荷须增大到足以停止治疗。靶病灶SD或PR时,罕见由于非靶病灶明确增大的进展。
·不明确:未测量进展,1个或以上非靶病灶部位未评价或评价方法与基线所用方法不一致。
新病灶
出现任何明确的新发恶性肿瘤病灶都表明PD。如果新病灶不明确,例如,体积较小,进一步评价会明确病因。如果重复评价明确病灶,那么应在首次评价日期记录进展。在以前未扫描区发现的病灶被认为是新病灶。
注:如果明确CR取决于体积减小但未完全消失的残留病灶,建议活检或细针抽吸残留病灶进行研究。如未发现疾病,主观状况记录为CR。
如果明确进展可能取决于坏死增大的病灶,那么病灶应活检或细针抽吸以明确状态。
无疾病进展的客观证据,需要终止治疗的患者,在肿瘤评价病例报告表(CRF)上不应报告为PD。这一情况应在治疗结束CRF上标明为由于健康状况总体恶化停止治疗。即使在停止治疗后也应尽量记录客观进展。
附6进展期乳腺癌常用化疗方案
(参考2014年美国的《NCCN乳腺癌指南》第3版)
1单药化疗方案
蒽环类
表柔比星:60~90 mg/m2,iv,第1天,21天为1个周期
吡柔比星:60~75 mg/m2,iv,第1天,21天为1个周期
脂质体表柔比星:50 mg/m2,iv,第1天,28天为1个周期
紫杉类
紫杉醇:175 mg/m2,iv,第1天,21天为1个周期或紫杉醇:80 mg/m2,iv,qw
多西他赛:60~100 mg/m2,iv,第1天,21天为1个周期
白蛋白结合紫杉醇:100~150 mg/m2,iv,第1、8、15天,28天为1个周期
卡培他滨:1000~1250 mg/m2,po,bid,第1~14天,21天为1个周期
吉西他滨:800~1 200 mg/m2,iv,第1、8、15天,28天为1个周期
长春瑞滨:25 mg/m2,iv,第1、8天,21天为1个周期
卡铂:AUC=5,iv,第1天,21-28天为1个周期
顺铂:75 mg/m2,iv,第1天,21天为1个周期
2联合化疗方案
TX TX方案
多西他赛:75 mg/m2,iv,第1天
卡培他滨:950 mg/m2,po,bid,第1~14天,21天为1个周期
TG TG方案
紫杉醇:175 mg/m2,iv,第1天;或80 mg/m2,iv,第1、8天
吉西他滨:1000 mg/m2,iv,第1、8天,21天为1个周期
NX NX方案
长春瑞滨:25 mg/m2,iv,第1、8天
卡培他滨:950 mg/m2,po,bid,第1~14天,21天为1个周期
EC方案(进展期乳腺癌剂量)
表柔比星:75 mg/m2,iv,第1天
环磷酰胺:600 mg/m2,iv,第1天,21天为1个周期
紫杉醇联合贝伐珠单抗方案
紫杉醇:80 mg/m2,iv,第1、8、15天
贝伐珠单抗:7.5~10 mg/kg,第1、15天,28天为1个周期
3 H E R 2阳性患者的曲妥珠单抗治疗
曲妥珠单抗:首次剂量4 mg/kg,之后为2 mg/kg,每周1次;或首次剂量8 mg/kg,之后6 mg/kg,每3周1次
联合化疗药物的用法同上述化疗用法。
4常见化疗方案的药物配置
EC EC方案
0.9 %NaCl 100 ml,ivgtt
5%Glucose 250 ml+还原型谷胱苷肽1.2 g,ivgtt 0.9%NaCl 100 ml+ 托烷司琼4 mg,ivgtt,化疗前30分钟
地塞米松:5~10 mg,iv,化疗前30分钟
0.9 %NaCl 50 ml+ 环磷酰胺600 mg/m2,ivgtt
5%Glucose 100 ml+表柔比星75~90 mg/m2,
ivgtt,1天或分2天(视患者情况)
TX TX方案
地塞米松:7.5 mg,po,q12h[化疗前1日,化疗当日,化疗第2日(可选)]
5%Glucose 250 ml+还原型谷胱苷肽1.2 g,ivgtt
0.9 %NaCl 100 ml,ivgtt
0.9 %NaCl 100 ml+ 托烷司琼4 mg,ivgtt,化疗前30分钟
0.9 %NaCl 250 ml+多西他赛75 mg/m2,ivgtt,1h
0.9 %NaCl 100 ml+泮托拉唑60 mg,ivgtt
卡培他滨:1000 mg/m2,bid,服2周
维生素B6:60 mg,tid,服2周
TG TG方案
艾司唑仑:1 mg,po,0am
地塞米松:10 mg,iv,化疗前30分钟(第一周0 am,6 am各口服地塞米松7.5 mg)
5%Glucose 250 ml+还原型谷胱苷肽1.2 g,ivgtt 0.9 NaCl 100 ml+磷酸肌酸1.0 g,ivgtt西咪替丁:0.4 g,iv,化疗前30分钟
苯海拉明:40 mg,im,化疗前30分钟0.9%NaCl 100 ml,ivgtt
0.9 %NaCl 100 ml+ 托烷司琼4 mg,ivgtt,化疗前30分钟
0.9 %NaCl 500 ml+ 紫杉醇80 mg/m2,ivgtt,3 h,第1、8天;或0.9%NaCl 500 ml+紫杉醇175 mg/m2,ivgtt,3 h,第1天
注:紫杉醇输注前30 min,0 min,15 min,30 min,
60 min,2 h,3 h监测血压,心率
0.9 %NaCl 100 ml+吉西他滨1000 mg/m2,ivgtt,30分钟,第1、8天
0.9 %NaCl 100 ml+泮托拉唑60 mg,ivgtt
NX NX方案
5%Glucose 250 ml+还原型谷胱苷肽1.2 g,ivgtt
0.9 NaCl 100 ml+磷酸肌酸1.0 g,ivgtt
0.9 %NaCl 100 ml,ivgtt
0.9 %NaCl 100 ml+ 托烷司琼4 mg,ivgtt,化疗前30分钟
0.9 %NaCl 100 ml+ 长春瑞滨25 mg/m2,ivgtt,大于15分钟
0.9 %NaCl 100 ml+泮托拉唑60 mg,ivgtt
卡培他滨:1000 mg/m2,po,bid,服2周
维生素B6:60 mg,po,tid,服2周
(由北京肿瘤医院严颖整理)
附7 进展期乳腺癌常用靶向治疗药物不良反应的防治
11曲妥珠单抗心脏毒性防治原则[[11]]
(1)曲妥珠单抗联合化疗药物尤其是蒽环类化疗药物会增加心肌损害,严重者会发生心力衰竭。因此,复发转移性乳腺癌患者不推荐使用曲妥珠单抗联合蒽环类化疗。
(2)尽管临床研究发现心脏毒性事件的发生率不高,且多数可以恢复,但应该注意的是:临床研究者选取的病例是化疗后经过心脏功能安全筛选的。所以,临床实践中要对患者的既往史、体格检查、心电图、超声心动图的LVEF基线评估后再开始应用曲妥珠单抗,使用期间应该每3个月监测心功能。若患者存在无症状性心功能不全,监测频率应更高(如每6~8周1次)。
(3)当出现LVEF较治疗前绝对数值下降≥16%,或LVEF低于该检测中心正常范围并且LVEF较治疗前绝对数值下降≥10%时,应暂停曲妥珠单抗治疗至少4周,并每4周检测1次LVEF;4~8周内LVEF回升至正常范围,或LVEF较治疗前绝对数值下降≤15%,可恢复使用曲妥珠单抗。
(4)一旦LVEF持续下降超过8周,或者3次以上因心脏问题而中断曲妥珠单抗治疗,应永久停止使用曲妥珠单抗。
22贝伐珠单抗不良反应防治原则[[22]]
贝伐珠单抗治疗乳腺癌最常见的不良反应为高血压和蛋白尿。其他不良反应如血栓形成、伤口愈合不良、出血、胃肠道穿孔等相对少见。
2.1 高血压的分级及处理
预防::排除未控制的高血压,对于有高血压病史的患者,在开始贝伐珠单抗治疗之前,应该对先前所患有的高血压给予充分的控制(<150/100 mmHg)。
监测::整个治疗期间监测血压并积极控制血压,医生应经常性地测量患者血压,以便对患者的高血压及其恶化情况进行监控;终止治疗时仍然存在高血压的,应定期监测血压,直到血压恢复正常。
处理:见表1。
2.2 蛋白尿的分级及处理
预防:①在开始贝伐珠单抗治疗前检测24 h尿蛋白。②当尿蛋白≥2 g/24 h,需推迟贝伐珠单抗治疗,直到尿蛋白恢复到<2 g/24 h,再开始治疗。
监测:①在整个治疗期间,对所有患者密切监测蛋白尿,有血压病史的患者发生蛋白尿的风险加大,应加强监测。②在每次贝伐珠单抗给药前48 h内,所有患者都应进行尿蛋白试纸检测,对于尿蛋白≥2+的患者要进行24 h尿蛋白测定。③患者在终止贝伐单抗治疗后仍应每3个月检测一次24小时尿蛋白,直到24小时尿蛋白<1 g。
处理:在出现蛋白尿后,对贝伐单抗所进行的剂量调整应遵照以下原则:①尿蛋白1+~3+或24 h尿蛋白≤2 g:按照计划继续贝伐珠单抗给药。②尿蛋白4+或24 h尿蛋白>2 g:暂停本次计划的贝伐珠单抗给药,推迟贝伐珠单抗给药直到24小时尿蛋白≤2 g。③如出现4级蛋白尿(肾病综合征),则永久性停止贝伐珠单抗给药。
参考文献
[1]中国抗癌协会乳腺癌专业委员会.Her-2阳性乳腺癌临床诊疗专家共识[J].中国癌症杂志,2012,22(4):314-318.
[2]Hamilton EP,Blackwell KL.Safety of bevacizumab in patients with metastatic breast cancer[J].Oncology,2011,80(5-6):314-325.
附8专家委员会名单
