基于生理生化差异的黄菠萝雌雄株鉴别技术研究
2015-12-22张东来黑龙江省林业科学院黑龙江哈尔滨5008黑龙江省林业科学研究所黑龙江哈尔滨5008
张东来,张 玲 (.黑龙江省林业科学院,黑龙江哈尔滨5008;2.黑龙江省林业科学研究所,黑龙江哈尔滨5008)
自然界中雌雄异株的植物仅占6%,不同性别的植物具有不同的经济价值,研究雌雄异株植物性别及其鉴定在理论与实践中都具有重要意义[1]。例如以种子和果实为收获对象时需大量的雌株,而获取以营养器官生长为主的绿化林木有时雄株具更高的经济价值。
黄菠萝(Phellodendron amurense Rupr.)是东北三大硬阔树种之一,为国家一级珍贵树种、国家2级保护树种和易危物种[2]。黄菠萝不仅木材具有很高的经济价值,而且还是珍贵的药用植物。黄菠萝为雌雄异株植物,性成熟前无法鉴别其植株性别,一般的树木要到5~8年才能性成熟,且雌雄鉴定主要在开花期间进行,因此黄菠萝苗木的早期性别鉴定就成了林业科研及营林生产中亟待解决的一个问题[3]。雌雄异株树种的性别鉴定方法很多种[4-8],包括形态鉴别法、生理指标鉴别法、化学物质分析鉴别法、同工酶图谱鉴别法等。目前已报道的雌雄鉴定植物种类有红松、水曲柳、栝楼、中华猕猴桃、沙棘、银杏等[4-9]。黄菠萝叶片中富含多糖、多酚等次生代谢物质,该研究采用形态学方法、化学方法(甲基红法、BTB法、TTC法和斐林试剂法)及生理学方法(保护酶活性)等,通过分析成熟黄菠萝叶片提取液颜色和光谱吸收值与其性别之间的关系,探索黄菠萝幼苗早期性别鉴定技术,为黄菠萝人工林恢复和营林生产提供理论参考[9]。
1 材料与方法
1.1 试验材料 以哈尔滨市香坊区松乐公园黄菠萝成树为试验植株,树龄平均为40年,郁闭度为0.7左右,林内伴生种为白桦、水曲柳、山杨、榆树等,灌木为紫丁香、金银忍冬等。分别在2013年、2014年6月中旬,随机取黄菠萝雌雄株各30株,在每株样树树冠上、中、下3个层次的东、南、西、北4个方向采摘叶片,将同株样树上所采摘的叶片充分混合装入袋内,迅速放入冰盒,带回实验室放入冰箱中,冷藏,待测。
1.2 研究方法
1.2.1 甲基红染色法。按雌雄株分别选取幼叶,洗净、拭干,称1 g,加入蒸馏水10 ml,研磨成匀浆,室温浸提1 h,10 000 r/min离心5 min,取上清液,等量加入2 g/L甲基红溶液,混匀,置于30℃恒温水浴中保温,每隔3 h记录提取液的颜色变化[4]。
1.2.2 溴麝香草酚蓝法(BTB法)。称取叶片1 g,加入10 ml蒸馏水,研磨成匀浆,室温浸提1 h,10 000 r/min离心5 min,取上清液2 ml,加入1 g/L的碱性BTB溶液4~5滴,于30℃的恒温下保温,观察其颜色变化,并每隔4 h用分光光度计测定其在400~730 nm(每隔30 nm测吸收值)的吸收值[4]。
1.2.3 氯化三苯基四氮蓝唑法(TTC法)。取叶片0.5 g,剪成小块,放入试管,加入4 g/L TTC溶液和0.067 mol/L pH=7.0磷酸缓冲液各5 ml,使样品完全浸入到反应液中,置于常温下浸提2 h,然后加入1 mol硫酸2 ml以终止反应,取出叶片,用滤纸吸干水分,在研钵中加入3 ml乙酸乙酯及少量石英砂,研碎提取TTCH,用乙酸乙酯洗研钵并将提取液全部转入10 ml试管中,用乙酸乙酯定容到10 ml,在485~690 nm下测定吸光值[4]。
1.2.4 斐林试剂法。取叶片1 g,加入10 ml蒸馏水,研磨成匀浆,室温浸提1 h,10 000 r/min离心5 min,取上清液5 ml,分别加入斐林试剂各1 ml,观察颜色变化及沉淀,在480~690 nm下测定吸光值[9]。
1.2.5 CAT、POD、SOD 酶活性测定。酶液提取:称取 1.0 g新鲜黄菠萝叶片,液氮研磨,加入6 ml 0.05 mol/L磷酸缓冲液,10 000 r/min 离心10 min,取上清液[2]。
1.2.5.1 CAT 酶活性测定。取 40 μl酶液,加入 2.5 ml 0.05 mol/L磷酸缓冲液和1 ml蒸馏水,不加酶液对照。在30℃水中水浴10 min,加入0.3 ml 0.1 mol/L 的 H2O2,测定吸光度。
1.2.5.2 POD 酶活性测定。取100 μl酶液,加入2.9 ml 0.1 mol/L磷酸缓冲液和1 ml 0.1 mol/L愈创木酚,不加酶液为对照。在30℃水中水浴30 min,加入1 ml 8 g/L H2O2,终止反应,测定吸光值。
1.2.5.3 SOD 酶活性测定。取 100 μl酶液加 3 ml 0.05 mol/L磷酸缓冲液,在正常日光下反应20 min,对照暗处理,测定吸光值。
2 结果与分析
2.1.1 形态学鉴定。测定黄菠萝株高、叶宽、叶长指标,结果见表1。从表1可以看出,黄菠萝叶片形态学鉴定差异性均不显著(P>0.05),黄菠萝雌雄株株高、叶宽、叶长相关性较小,其相关系数分别为 R2=0.111、R2=0.081、R2=0.117。因此,形态学方法不能鉴定黄菠萝雌雄株。

表1 黄菠萝叶片形态学鉴定结果
2.1.2 甲基红溶液鉴定。以成熟黄菠萝幼叶提取液,加入2 g/L浓度甲基红溶液,30℃水浴3 h后观察发现,向叶部提取液中加入甲基红溶液时,雄性植株上清液呈现深红色,雌性植株为橘红色,雄雌株颜色开始变浅,继续水浴观察至24 h,发现雌雄株提取液颜色明显变浅,48 h后褪去,并有沉淀物。因此采用甲基红溶液测定时,水浴3 h可作为鉴别雄、雌植株性别的最佳时期(图1)。
2.1.3 BTB法。采用溴麝香草酚兰法(BTB法)对黄菠萝雄雌株进行鉴定,雄雌株提取液颜色差异明显,雄性植株深蓝色,雌性植株为棕黄色。在吸收光谱方面,雌雄株的提取液吸光值差异显著(图2)。在480 nm下测定雌雄株提取液吸光值,雄株平均值为 2.680 00 ±0.159 63,雌株平均值为1.389 33±0.076 35。BTB方法鉴定的雌雄株吸光值在480~690 nm处的检验结果均达到极显著水平(P<0.01),认为BTB方法鉴定雌雄株的效果是显著的。因此,BTB方法可以作为黄菠萝雌雄株鉴定的方法。
2.1.4 TTC法。用氯化三苯基四氮蓝唑法(TTC法)对黄菠萝雌雄植株性别进行鉴定,在吸收光谱方面雌雄株的提取液差异显著。如图3所示,在480 nm和660 nm下测定雌雄株提取液吸光值,雄株平均值为 1.643 67±0.176 79和1.841 33±0.098 20,雌株提取液吸光值为 2.067 33 ±0.145 82和2.145 67 ± 0.124 93,显著水平为 0.009 9(P <0.01),雌雄株之间具有极显著差异。因此,TTC方法在480、660 nm下可以作为黄菠萝雌雄株鉴定的方法。
2.1.5 斐林试剂法。雌雄株提取液采用斐林试剂的显色反应具有明显差异,雌株呈现草绿色,雄株呈现翠绿色。在480~690 nm吸收光谱下,雌雄株的提取液吸光值存在差异,雄株提取液吸光值为1.532 25±0.037 26,雌株提取液吸光值为1.363 75 ±0.059 23,显著水平为0.038(0.01 <P <0.05),认为雌雄株之间存在差异,即可认为斐林试剂法可以作为鉴定黄菠萝雌雄株的方法。
2.1.6 保护酶活性测定。以6月份40年生成熟黄菠萝树幼嫩叶片提取保护酶,测酶活性。从表2中可以看出,黄菠萝
雌雄株叶片内保护酶活性表现为CAT酶、SOD酶和POD酶活性差异不显著。因此,测定叶片保护酶方法不能作为鉴定雌雄株的方法。
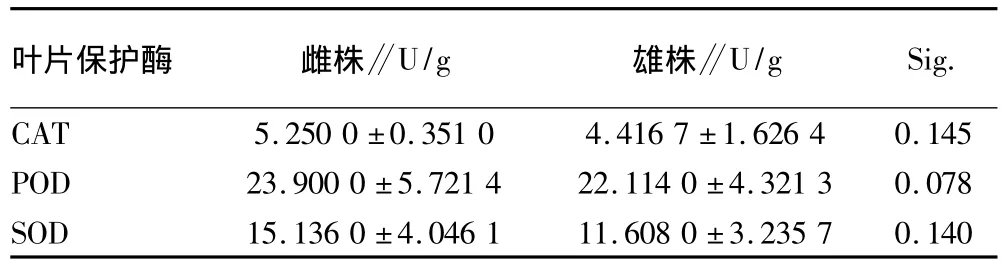
表2 黄菠萝雌雄株叶片保护酶活性差异
3 结论与讨论
雌雄株鉴别技术的应用潜力主要在于苗木性别的早期鉴定,该试验所得到的结果和其他相关研究所得到的结果是一致的[9-11],证明了性别差异与雌雄植株代谢生理有关。通过连续2年的试验比较发现,采用甲基红法、BTB法、TTC法和斐林试剂方法进行黄菠萝性别鉴定,结果显示雌雄株具有显著性差异,表明用这4种方法进行黄菠萝雌雄株鉴定是完全可行的。形态学和生理学方法表现为差异不显著,因此,形态学和生理学方法不能作为鉴定黄菠雌雄株的方法。而化学药剂方法操作简单、结果明显,而且费用低廉,可以对黄菠萝幼苗期鉴定提供理论支持,在林业生产中具有很好应用价值和现实意义。这些方法的缺点是容易受到温度、光强及采样时间的影响,因此,需要在今后的工作中综合研究各种因素对鉴别结果的影响(例如内源激素的差异),探索更为合适的措施以缩短鉴别过程所需要的时间。另外,在染色液的分光光度计检测中的特征吸收峰值可能是提取液中糖类或酚类物质与染色剂反应后的产物所形成的,这类物质还有待进一步确定研究。
[1]李瑞丽,卢龙斗,高武军,等.雌雄异株植物性别鉴定的研究进展[J].广西植物,2006,26(4):387 -391.
[2]何冬明,严善春,鲁艺芳.黄檗叶片内保护酶活性的时序变化[J].东北林业大学学报,2011,39(9):37 -39.
[3]赵林森,徐锡增,崔培毅,等.雌雄异株树种植物性别鉴定的研究[J].南京林业大学学报,1998,22(1):71 -74.
[4]胡静.红松偏雄、偏雌性别型鉴别技术研究[D].北京:中国林业科学研究院,2008:20.
[5]纪丽丽.水曲柳雌雄株鉴别技术研究[D].哈尔滨:东北林业大学,2006:35.
[6]詹亚光,纪丽丽,亓磊,等.水曲柳雌雄株酚类物质和几种氧化酶活性的比较[J].林业科学,2006,42(7):131 -136.
[7]曲超,刘宁侠,字肖萌,等.栝楼雌雄株苗期、花期生理生化指标差异的比较研究[J].中国农学通报,2012,28(24):42 -45.
[8]祖元刚,王延兵,王慧梅,等.黄檗(Phellodendron amuranse)叶片总RNA提取方法研究[J].植物研究,2007,9(5):593 -595.
[9]王在明,廖镜思.中华猕猴桃雌雄株快速鉴定初报[J].福建农学院学报,1982,6(2):83 -84.
[10]陈学森,邓秀新,章文才,等.银杏雌雄株核型及性别早期鉴定[J].果树科学,1997,14(2):87 -90.
[11]王庆亚,郭巧生,孙建云,等.绞股蓝雌雄株的识别及内源激素变化的研究[J].中国中药杂志,2004,9(9):837-840.
