新城疫病毒的分离与鉴定
2015-12-22徐丹雯魏和朋胡顺林石火英扬州大学兽医学院病理教研室禽类预防医学教育部重点实验室江苏扬州225009
徐丹雯,魏和朋,胡顺林,石火英(扬州大学兽医学院病理教研室,禽类预防医学教育部重点实验室,江苏扬州225009)
新城疫(Newcastle disease,ND)是由新城病毒引起的鸡和多种禽类的一种急性、热性、败血性和高度接触性传染病,主要以呼吸困难、下痢、神经紊乱、粘膜和浆膜出血为特征。不同毒株的致病性也不相同,ND可表现为严重程度有很大的差异的疾病。国际兽医局(OIE)将该病定为A类烈性传染病,我国将其定为一类传染[1]。人类也可感染新城疫病毒,潜伏期约为48 h,主要引起急性结膜炎,偶尔也可侵害角膜,病程为7~10 d,一般不经治疗可自然康复,不会在人群中造成传播[2]。目前NDV采用反转率-聚合酶反应(RTPCR)技术进行研究,在其毒力分子基础方面有了较为深入的了解,也更成熟地将NDV分为强度和弱毒。研究发现,NDV在复制过程中融合蛋白(F)的前体F0的形式合成,仅当宿主细胞的蛋白酶介导F0裂解才具有传染性。F0的第112~117位氨基酸序的裂解位点上,所有NDV的 F蛋白的116位均为精氨酸,所有低毒毒株117裂解位上均为亮氨酸,而113位有另1个碱性氨基酸。相反,所有强毒株和中毒株117为均为苯丙氨酸,因此强毒和低毒的主要差异是在F0的112~117位的氨基酸基序上。但是,主要与NDV毒力密切相关的是融合蛋白(F)和血凝素-神经氨酸酶(HN)[3]。笔者从江苏省扬州市几个活禽交易市场采集鸡泄殖腔棉拭子40份,经SPF鸡胚扩增和PCR鉴定,共分离出4株新城疫病毒。对分离株的F蛋白氨基酸序列研究发现,分离株裂解位点附近的氨基酸残基组成均为112ERQERL117,符合弱毒株裂解序列特征,并且分离的NDV之间具有较高的同源性,介于86.3% ~93.9%。
1 材料与方法
1.1 材料与试剂
1.1.1 病料来源。2014年10月从扬州市几个活禽交易市场采取鸡的泄殖腔棉拭子40份。
1.1.2 试验动物。10日龄SPF鸡胚,购自北京梅里亚维通动物技术有限公司。
1.1.3 标准阳性血清。新城疫LaSota株标准阳性血清,由扬州大学兽医学院病理教研室自制,HI为210;禽流感(H9和H5)单因子阳性血清,由扬州大学兽医学院病理研究室自制,HI均为 211。
1.1.4 1%鸡红细胞。采集至少3只 SPF公鸡或无禽流感或新城疫等抗体的健康公鸡的血液与等体积阿氏液混合,用pH7.2的0.01 mol/L PBS液洗涤3次,每次均以1 500 r/min离心10 min,洗涤后用PBS配制成体积分数为1% 红细胞悬液,4℃下保存备用。
1.2 病毒的分离
1.2.1 病料处理。从扬州市几个活禽交易市场采集鸡泄殖腔棉拭子样品,共计40份。样品反复冻融3次,4 000 r/min离心5 min,取上清液作为待检样品。
1.2.2 鸡胚接种。每个样品接2枚,每枚经尿囊腔途径接种0.2 ml,置37℃ 孵育5 d,弃去24 h内死亡的胚,24 h后死亡的鸡胚收取尿囊液,120 h未死亡的鸡胚,4℃下过夜,收取其尿囊液。
1.3 血凝试验及血凝抑制试验 将无菌收集的鸡胚尿囊液以1.0% 鸡红细胞悬液采用β微量法进行HA试验,以HA价≥3 log2为试验阳性。对有直接血凝性的样本进行NDV以及H5亚型和H9亚型AIV HI试验。
1.4 NDV F基因部分片段序列测定与分析
1.4.1 提取 RNA 。取尿囊液 350 μl,加入 700 μl的 Trizol液,混匀;室温放置10 min,然后加入200 μl的氯仿异戊醇,盖紧漩涡振荡器摇荡15 s左右,室温静置10 min后,在4℃条件下12 000 r/min转速离心10 min;取上层水相于一新的Ep管,加入550 μl等量异丙醇,室温放置15 min,4℃条件下12 000 r/min离心10 min;弃去上清液加入700 μl的经70%DEPC处理的乙醇,轻轻颠倒数次混匀,4℃条件下12 000 r/min离心10 min;小心弃去上清液,室温干燥 5~10 min;加入 10.5 μl DEPC处理的水中,放置10 min后用于cDNA的合成。
1.4.2 cDNA 的合成。取5 μl含 RNA的DEPC水于经过DEPC 处理的 200 μl Eppendorf管中;加入反转录引物 1 μl、2.5 mmol dNTP 2 μl,70 ℃ 温浴 10 min,快速置冰上 5 min,稍微离心;快速加入 5 × AMV buffers 5 μl、Rnasin 1 μl、RNA反转录酶 (AMV)1 μl、DEPC 水 10 μl,瞬间离心;继续 42 ℃水浴60 min,70℃ 15 min温浴终止反应。
1.4.3 RT-PCR。PCR 体系(25 μl体系):模板(cDNA)2 μl、上游引物 1 μl、下游引物 1 μl、mix Taq 预混酶 12.5 μl、ddH2O 8.5 μl。RT-PCR 反应条件:95 ℃ 3 min;94 ℃ 40 s,54℃ 40 s,72℃ 2 min,30个循环;最后72℃延伸10 min。取25 μl反应产物在1%琼脂糖电泳中进行检验。设置DL 20000 DNA Marker;调节电压为80~100 V,电泳40 min左右;小心取出凝胶,放入凝胶成像仪中,观察照相,保存图片。若有条带,切胶测序。
1.4.4 NDV F基因序列分析。参照Liu等[4]的方法选取分离毒株F基因与GenBank中发表的NDV参考毒株相应片段进行分析。
2 结果与分析
2.1 病毒分离与鉴定 从40份病料中成功分离出4株新城疫病毒,分别简称为 YZ14、YZ22、YZ29、YZ34,其 HA 效价分别为25、24、25和23;使用新城疫阳性血清、H9N2亚型禽流感病毒阳性血清和H5亚型禽流感病毒阳性血清,对分离到的4株有血凝价的病毒进行HI效价检测发现,分离到的病毒与H9和H5亚型的阳性血清反应阴性,而与新城疫阳性血清的血凝效价很高,分别为29、28、210和29(表1)。
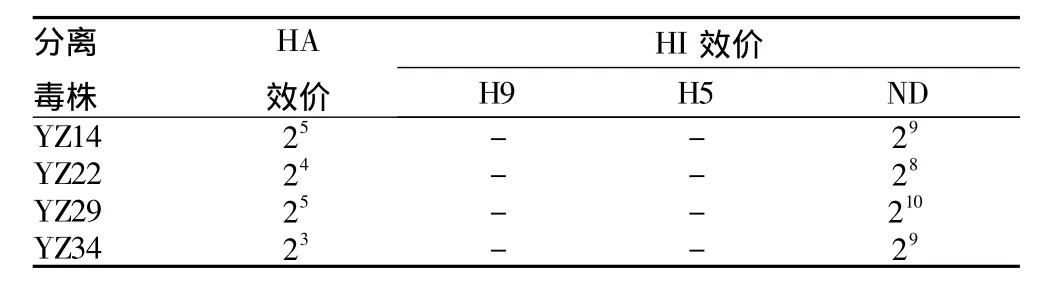
表1 血凝试验与血凝抑制试验结果
应用新城疫病毒的特异性引物对分离株的基因组RNA进行RT-PCR,反应产物经过1% 琼脂糖凝胶电泳观察,得到特异性扩增条带,YZ14、YZ22、YZ29、YZ34 NDV毒株与预期设计的F基因的扩增片段大小相符均约为1 100 bp。1%琼脂糖凝胶电泳结果如图1所示。
2.2 NDV F基因序列分析
2.2.1 分离株与参考毒株的同源性比较。将RT-PCR产物送测序,与GenBank中已发表的参考毒株F基因的核苷酸序列进行对比分析。从图2可以看出,此试验分离到的NDV毒株的F基因与Genbank已发表的NDV参考弱毒株的同源性介于73.2% ~77.9%;然而,分离到的NDV之间具有较高的同源性,介于86.3% ~93.9%。系统进化树分析表明,这几株分离毒株与LaSota株亲缘性较近,属于同一分支(图3)。
2.2.2 分离株的裂解位点分析。分析F蛋白裂解位点附近的氨基酸序列发现,YZ14、YZ22、YZ29、YZ34 4株病毒F蛋白裂解位点序列为112ERQERL117,具有典型的NDV弱毒株特征。
3 讨论
20世纪90年代以来,新城疫虽然没有形成世界性的大流行,但是我国鸡群新城疫发病逐年加重,新城疫感染的空间比例不断扩大。自1998年以来,世界范围以及我国出现机率最高的流行毒株的基因型为基因Ⅶ型,近年来新发生鹅源NDV分离株大部分也属于该型。NDV虽然只有1个血清型,但病毒的毒力可随病毒宿主和外界条件的变化而改变。该试验对活禽市场的表征正常的40只鸡采集泄殖腔棉拭子,从40份病料中成功分离到4株新城疫病毒,总阳性率为10%。
新城疫病毒的F基因裂解位点处氨基酸的组成与病毒毒力具有非常密切的关系。F蛋白是决定新城疫病毒毒力的主要因素。F0裂解位点氨基酸的组成与毒株的毒力有很大的关系。国内外研究表明,NDV强毒株F0蛋白裂解位点的氨基酸序列一般为112R/K-R-Q-K/R-R-F117,而弱毒株在该位点则以中性氨基酸代替碱性氨基酸,尤其是112位和115位,从而使相应序列成为112G/E-K/R-Q-G/E-R-L117,这种F0蛋白不易裂解,以非活性的形式插入子代病毒子中,没有膜融合活性,感染性很低或无感染性。笔者通过对分离株的F基因氨基酸序列分析发现,分离株裂解位点附近的氨基酸残基组成均为112ERQERL117,符合弱毒株裂解序列特征。
大量研究表明,来自水禽的NDV能够在易感宿主鸡或火鸡体内逐渐演变为强毒力 NDV[5-7]。于圣青[8]研究表明无毒性的鹅源NDV在易感宿主鸡的体内发生了毒力返强现象,随着在气囊传代次数的增加,病毒毒力也随之增强,并逐渐变成了泛嗜性病毒;F蛋白裂解位点的序列也由开始时的112ERQERL117变为112ERQGRL117(气囊传代8次),再变为112ERQKRL117(气囊传代9次),最终变成112ERQKRF117(气囊传代9次+脑内传代1次)。虽然,对活禽市场随机采集的家禽泄殖腔棉拭子分离到的4株NDV的裂解位点氨基酸分析发现,这4株NDV分离株均为弱毒株,但是依然存在一定的潜在威胁,如小型活禽市场一般都没有将不同种家禽分离开来。相关研究表明,从发病鹅群分离的NDV对鸡具有高度的致病性,直接感染或间接接触感染都可导致鸡100%的发病率和死亡率[9]。同时,从分离株与参考株的F基因核苷酸序列同源性比较中看出分离到的NDV之间具有较高的同源性,介于86.3% ~93.9%,且这些分离株与疫苗株LaSota的F基因属于同一分支,这也很大程度上说明可能是由于我国多年来一直采用以疫苗接种为主、隔离消毒为辅的控制ND流行措施的副作用。
[1]陈溥言.兽医传染病[M].5 版.北京:中国农业出版社,2013:345-351.
[2]金宁一,胡仲明,冯书章,等.新编人兽共患病学[M].北京:科学出版社,2007:345-358.
[3]韦平,刘禄,韦天超,等.禽Ⅰ型副粘病毒广西分离株F基因序列及毒力的研究[J].中国预防兽医学报,2003,25(2):104-106.
[4]LIU H,LWANG Z,WU Y,et al.Molecular characterization and phylogenetic analysis of new Newcastle disease virus isolates from the mainland of China[J].Res Vet Sci,2008,85(3):612 -616.
[5]ALEXANDER D J,MORRIS H T,POLLITT W J.Pollitt,et al.Neweastle disease outbreaks in domestic fowl and turkeys in Great Britain during 1997[J].Ver Rec,1998,143:209 -212.
[6]HUOVILAINEN A,EK-KOMMONEN C,MANVELL R,et al.Phylogenetic analysis of avian paramyxovirus 1 strains isolated in Finland[J].Archives of virology,2001,146:1775 -1885.
[7]WESTBURY H.Commentary Newcastle disease virus:An evolving pathogen?[J].Avian pathology,2000,30(1):5 -11.
[8]于圣青.新城疫病毒某水禽分离株经鸡体传代后由非致病型转变为速发型的研究[J].中国预防兽医学报,2003,25(1):59 -64.
[9]WAN H Q,CHEN L G,WU L L,et al.Neweastle disease in geese natural occurrence and experimental infection[J].Avian pathology,2004,33(2):216-221.
