响应面法优化枯草芽孢杆菌B91发酵培养基
2015-12-22孟利强赵晓宇陈静宇张淑梅胡基华沙长青
孟利强,赵晓宇,陈静宇,李 晶,张淑梅,曹 旭,胡基华,沙长青
(1.黑龙江省科学院微生物研究所黑龙江省生物工程重点实验室,黑龙江哈尔滨150010;2.黑龙江省科学院高技术研究院,黑龙江哈尔滨150020;3.黑龙江省科学院条件财务处,黑龙江哈尔滨150001)
枯草芽孢杆菌是一种革兰氏阳性好氧细菌,能产生蛋白酶、抗生素、抗菌多肽等多种物质,已被广泛应用于环保、畜牧和生物防治等领域[1]。枯草芽孢杆菌的微生态制剂可以作为饲料或肥料的添加剂来防治动物疾病和植物病害,制剂中活菌数是衡量其质量的重要指标[2]。而微生态制剂中的活菌数会随着其存放时间的延长而减少,最终影响其使用效果,这一问题可以通过提高芽孢杆菌制剂的芽孢比例得以缓解[3]。芽孢是芽孢杆菌的休眠体,具有多种抗逆特性,可以延长微生态制剂的保存期并保证其使用效果[4]。
在工业化生产中,由于液体发酵的各个工艺参数易于控制,已成为主要的发酵手段,然而在枯草芽孢杆菌的生产过程中由于芽孢形成不稳定和菌数低等因素,给实际生产带来不便[5]。枯草芽孢杆菌B91是黑龙江省生物工程重点实验室的自有菌株,是一株具有光谱抑制植物病原真菌能力的细菌,能够防治多种植物病害,具有广泛的应用前景。笔者对其发酵培养基进行优化,以期实现该菌株的高密度培养的同时提高芽孢形成率,为其工业化生产提供支撑。
1 材料与方法
1.1 试验菌种 枯草芽孢杆菌B91由黑龙江省生物工程重点实验室保存。
1.2 培养基
1.2.1 斜面培养基。葡萄糖10 g/L,酵母膏5 g/L,牛肉膏3 g/L,氯化钠3 g/L,K2HPO42 g/L,琼脂15 g/L,初始 pH 为7.2 ~7.5。
1.2.2 种子培养基。葡萄糖10 g/L,酵母膏5 g/L,牛肉膏3 g/L,氯化钠 3 g/L,K2HPO42 g/L,CaCO32 g/L,初始 pH 为7.2 ~7.5。
1.2.3 基础发酵培养基。葡萄糖10 g/L,酵母膏5 g/L,氯化钠 3 g/L,K2HPO42 g/L,MgSO40.2 g/L,MnSO40.01 g/L,CaCO32 g/L,初始 pH 为7.2 ~7.5。
上述培养基灭菌条件均为湿热灭菌:121℃,20 min。
1.3 培养方法
1.3.1 种子活化。将枯草芽孢杆菌B91转接到斜面培养基上,30℃培养24 h。
1.3.2 种子培养。挑一环斜面种子接种于250 ml三角瓶种子培养基中,三角瓶装液量为20 ml,30℃、75 r/min振荡培养20 h。
1.3.3 发酵培养。将种子液以2%接种量接种于三角瓶发酵培养基中,三角瓶装液量为50 ml,30℃、180 r/min摇床培养48 h。
1.4 芽孢计数方法 将待测样品置于80℃水浴处理15 min,使未形成芽孢的菌体失活,自然冷却后采用平板菌落计数法计数,所得结果即为待测样品中的芽孢数[6]。
1.5 Plackett-Burman设计 采用Plackett-Burman进行试验设计,筛选基础发酵培养基中的显著因子,对培养基的7个组分,即葡萄糖(A)、酵母膏(B)、氯化钠(D)、K2HPO4(E)、MgSO4(G)、MnSO4(H)、CaCO3(K)进行全面考察。选择10因子2水平的试验设计,增加3个空项C、F、J来估计试验误差,每个因子取高低2个水平,且高水平是低水平的1.5倍(表1)。
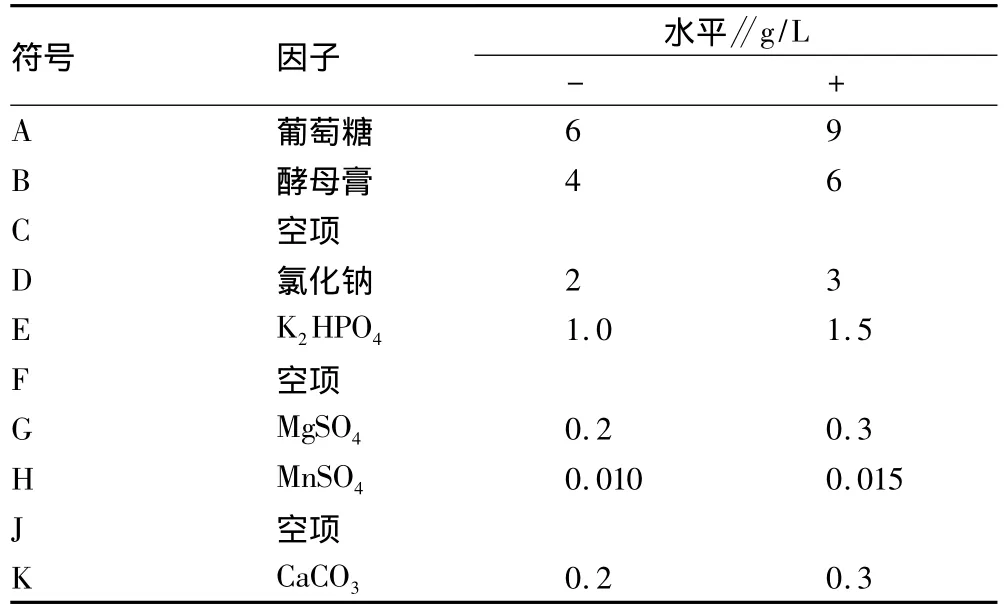
表1 Plackett-Burman设计因子与水平
1.6 爬坡试验 通过对Plackett-Burman设计的试验结果进行分析,确定主要因子,根据回归方程各因子的系数来确定主要因子的爬坡路径和步长[7]。改变各主要因子在基础发酵培养基中的质量浓度,使其成梯度变化,检测各个梯度下发酵液芽孢数量,快速确定最大响应值的区域。
1.7 响应面分析 Plackett-Burman设计确定了影响B91菌株发酵芽孢浓度的3个主要因子,爬坡试验确定了3个主要因子响应区域的中心点,采用Box-Behnken的中心组合设计原理在主要因子的响应区各取3个水平,设计3因素3水平的响应面分析试验。
1.8 数据分析 一个处理包含3个平行试验,取值为3个平行试验的均值。Plackett-Burman设计采用Minitab 16软件完成,Box-Behnken设计的响应面分析由Design-Expert 8.0完成。
2 结果与分析
2.1 Plackett-Burman设计筛选显著因子 采用Plackett-Burman设计对基础发酵培养基的7个组分进行分析,各组分分别取高低2个水平(表2),各因子水平方差分析结果见表3。
由表3中P值的大小可以判定,培养基中各因子对B91菌株发酵液芽孢浓度影响的重要性排序为A>B>H>G>D>E>K,即葡萄糖、酵母膏和MnSO4的影响较为突出,由相关系数可以判定葡萄糖和酵母膏对芽孢数量的影响呈现正效应,而MnSO4呈现负效应。这些效应关系由回归模拟方程表示为Y=19.9+1.98A+1.82B -0.400D+0.267E+0.583G-1.18H -0.150K,R2=0.956 4,这表明该方程式拟合较好。
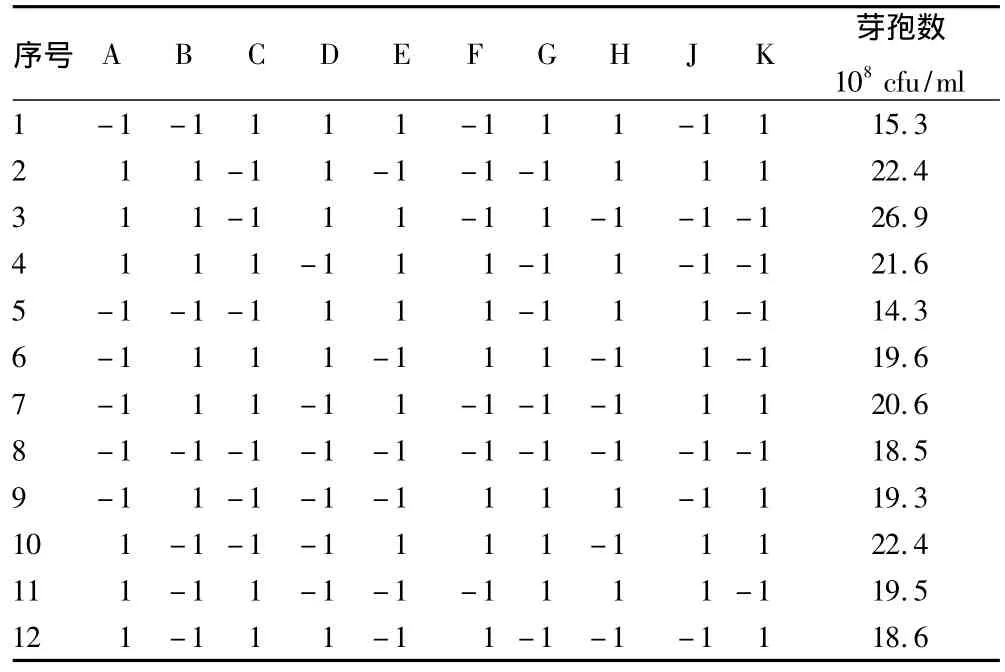
表2 Plackett-Burman设计及响应值
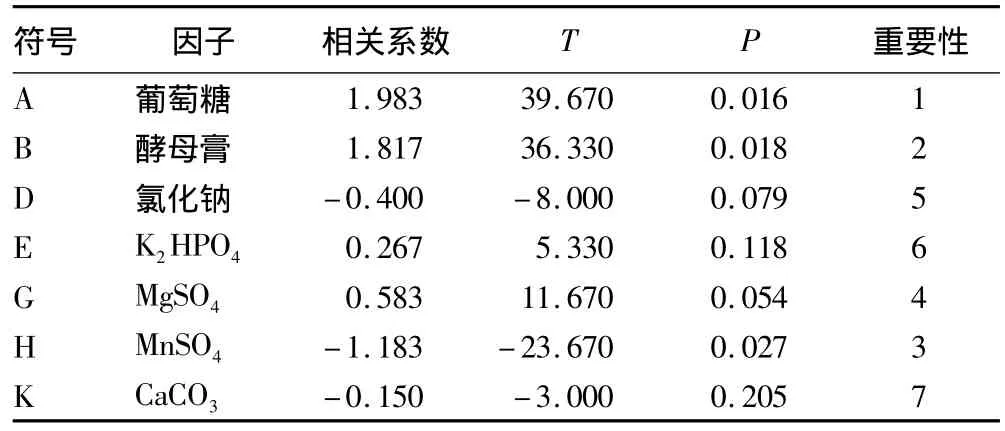
表3 Plackett-Burman设计显著因子分析
2.2 爬坡试验 爬坡试验是一种快速逼近最大响应值稳定响应区的方法,根据Plackett-Burman设计筛选出的显著因子及其相关系数来设计它们的爬坡路径和步长(表4)。其中第2组试验发酵芽孢浓度最大,即当葡萄糖浓度为10.0 g/L,酵母膏浓度为7.0 g/L,MnSO4浓度为 0.010 0 mg/L 时发酵芽孢浓度达到最大值,所以以此为中心点进行响应面试验分析。
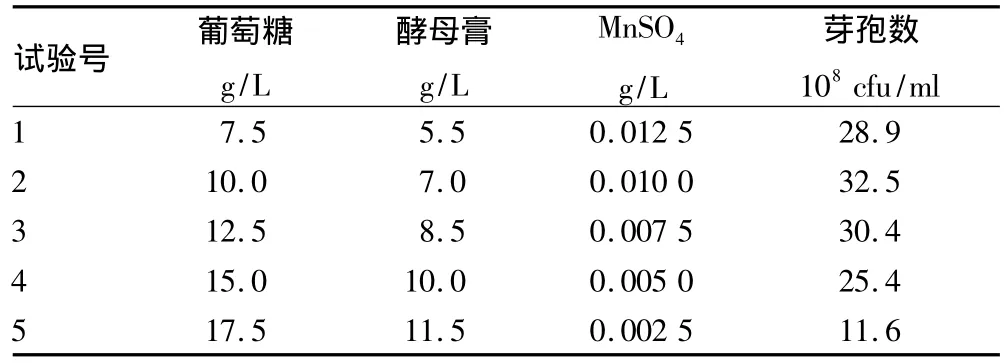
表4 爬坡试验设计及结果
2.3 响应面试验分析 确定了显著因子的最适浓度区域之后,即以葡萄糖 10.0 g/L,酵母膏 7.0 g/L,MnSO40.010 0 mg/L为中心点进行响应面分析试验,各因素代码和水平见表5。根据Box-Behnken中心组合设计原理在3个主要因素的响应区各取3个水平,设计3因素3水平的响应面试验,每个处理设定3个重复试验,响应面试验设计及试验结果见表6。根据表6结果,以芽孢浓度为响应值,采用Design-Expert 8.0 分析。
方差分析结果表明,该模型的一次项和二次项对芽孢浓度的影响均显著,而交互作用对芽孢浓度的影响不显著;回归模型的P值为0.000 1,表明模型是显著的,而失拟项的P值为0.217 8,失拟不显著;模型的决定系数 R2=0.978 4,说明模型达到较好的拟合程度[8-9]。经分析软件回归拟合得到该模型的回归方程:
Y=41.16 -2.81A -1.29B+1.20C -1.12AB+0.55AC+2.65BC -4.17A2 -7.62B2-5.74C2
为解得该回归方程的极值点,对其各自变量分别求一阶偏导,得到三元一次方程组,解出该模型的极值点,从而计算出对应因素的取值:葡萄糖9.35 g/L,酵母膏 6.93 g/L,Mn-SO410.16 mg/L,此时模型的理论最优芽孢浓度为41.695 4×108cfu/ml。
根据拟合回归方程采用Design-Expert 8.0分析,绘出主要因素相应的等高线和相应的响应面分析图(图1~3)。每个响应曲面能够反映出2个主要因素之间的相互作用,在第3个因素固定在最优值不变的情况下,随着另外2个因素的逐渐增加,芽孢浓度呈先增加后减小的趋势,而曲面的顶点即为芽孢浓度的最大值点[10]。
2.4 验证试验 根据响应面分析结果,枯草芽孢杆菌B91菌株芽孢浓度最优极值为葡萄糖9.35 g/L、酵母膏 6.93 g/L、MnSO410.16 mg/L,预测最优值为41.695 4 ×108cfu/ml。为了验证这一结果的有效性,按照上述分析结果进行重复试验,检测结果为(41.89 ±0.21)×108cfu/ml,与预测值相近,说明该模型拟合的有效性。枯草芽孢杆菌B91菌株的最优培养基配方为:葡萄糖9.35 g/L,酵母膏6.93 g/L,氯化钠3 g/L,K2HPO42 g/L,MgSO40.2 g/L,MnSO410.16 mg/L,CaCO30.2 g/L。
3 结论与讨论
培养基的优化是微生物菌种从实验室走向工业化生产的第一步,而对于芽孢杆菌微生态制剂而言,其中的芽孢含量才是其质量的保证,该研究从实验室自有枯草芽孢杆菌B91的培养基优化入手,提高其发酵产物细胞浓度和芽孢形成率。在培养基的优化过程中,Plackett-Burman设计可以从众多的培养基组成成分中筛选出对目标产物影响最为显著的几个因子。而响应面分析法可以同时对响应值的几个变量进行回归分析,能分析多种因素间的相互作用,同时能通过回归方程预测响应值的最优值[11-12]。目前,国内外许多研究者采用该方法对不同微生物的培养基进行了优化,均获得了较为理想的试验结果。李志华[13]利用响应面法对谷氨酸棒杆菌CN1021的发酵培养基进行了优化,结果谷氨酸产量比未优化的发酵培养基提高了22.75%;王永宏等[14]利用响应面法对YL001菌株的培养基进行了优化,结果菌株抗菌活性达268.9 U/ml,与预测值相符;黄丽金等[15]采用响应面方法对德氏乳杆菌保加利亚亚种LB14增殖培养基进行了优化,在优化培养基中LB14的菌体浓度比优化前提高了近5倍;Muthu等[16]利用响应面法优化了嗜盐细菌VKMM 013的培养基,使其菌体浓度提高了2.4倍。
该研究采用Plackett-Burman设计从B91菌株基础发酵培养基中的7个组分中筛选出3个显著因子:葡萄糖(A)、酵母膏(B)和MnSO4(C),然后利用爬坡试验快速逼近最大响应值的稳定响应区,并用响应面分析法的Box-Behnken设计确定显著因子的最优配比:葡萄糖9.35 g/L、酵母膏 6.93 g/L、MnSO410.16 mg/L。最终确定了枯草芽孢杆菌B91的最优培养基配方:葡萄糖9.35 g/L,酵母膏6.93 g/L,氯化钠3 g/L,K2HPO42 g/L,MgSO40.2 g/L,MnSO410.16 mg/L,Ca-CO30.2 g/L。经验证试验检测结果为(41.89±0.21)×108cfu/ml,与预测值相近,说明该模型拟合的准确性和试验结果的有效性。
[1]王晓阁.枯草芽孢杆菌研究进展与展望[J].中山大学研究生学刊(自然科学·医学版),2012(3):14 -23.
[2]张彦杰,罗俊彩,武燕萍,等.生防枯草芽孢杆菌研究进展[J].生命科学仪器,2009(4):19-23.
[3]王星云,宋卡魏,张荣意.枯草芽孢杆菌菌剂的开发应用[J].广西热带农业,2007(2):32-35.
[4]王晓阁.枯草芽孢杆菌研究进展与展望[J].中山大学研究生学刊(自然科学·医学版),2012(3):14 -23.
[5]徐世荣,陈骧,吴云鹏.细菌芽孢形成机制在微生态制剂生产中的应用[J].食品与生物技术学报,2007(4):121 -126.
[6]杜连祥.工业微生物学实验技术[M].天津:天津科学技术出版社,1992:104.
[7]褚以文.微生物培养基优化方法及其OPTI优化软件[J].国外医药(抗生素分册),1999(2):58 -60,66.
[8]张广臣,雷虹,何欣,等.微生物发酵培养基优化中的现代数学统计学方法[J].食品与发酵工业,2010(5):110 -113.
[9]李勇昊,周长海,丁雷,等.发酵培养基优化策略[J].北京联合大学学报(自然科学版),2011(2):53 -59.
[10]刘志祥,曾超珍.响应面法在发酵培养基优化中的应用[J].北方园艺,2009(2):127-129.
[11]MRUDULA S,GOPAL R,SEENAYYA G.Optimization of medium components using response surface methodology for production of thermostable amylopullulanase in submerged fermentation by Clostridium thermosulfurogenes SVM17[J].Malaysian journal of microbiology,2012,7(4):545 -550.
[12]VENKATA R R K D,SRI R R D,Murali Y N.Optimization of medium constituents for Cephalosporin C production using response surface methodology and artificial neural networks[J].Journal of biochemical technology,2009,1(3):69 -74.
[13]李志华.基于PB试验和响应面分析法对谷氨酸棒杆菌CN1021发酵培养基优化[J].中国酿造,2014(2):23 -27.
[14]王永宏,张强,张兴.响应面法优化Xenorhabdus nematophila发酵培养基的研究[J].西北农林科技大学学报(自然科学版),2009(7):140-146.
[15]黄丽金,陆兆新,袁勇军.响应面法优化德氏乳杆菌保加利亚亚种增殖培养基[J].食品科学,2005(5):103 -107.
[16]MUTHU M,LEJLA P,VIJAYARAGHAVAN K.Optimization of growth media for obtaining high-cell density cultures of halophilic archaea(family Halobacteriaceae)by response surface methodology[J].Journal of biochemical technology,2009,100(12):3107 -3112.
