不同代谢葡萄糖水平对绵羊人工瘤胃发酵特性、微生物蛋白质浓度和产气参数的影响
2015-12-21徐进昊李华伟王洪荣
赵 睿 徐进昊 李华伟 王洪荣
(扬州大学动物科学与技术学院,扬州 225009)
在动物体内的三大供能物质中,葡萄糖以其独到的作用和快速的供能性质,在动物体的能量供应中占据着最重要的作用。而反刍动物因其不同于单胃动物的消化道构造,使得其葡萄糖的吸收量处于一个极低的水平,需要动用体内的生糖氨基酸的来补充葡萄糖的不足,导致动物生长缓慢,甚至体重下降[1]。基于以上考虑,卢德勋于1996年在国际会议上首次提出了代谢葡萄糖(MG)这一概念[2]。代谢葡萄糖是指饲粮经动物消化吸收后,可以为动物代谢活动提供葡萄糖的物质,它包括瘤胃发酵产生的丙酸(POEG)部分和进入小肠的过瘤胃淀粉(BSEG)部分。孙海洲等[3]对生长肥育绵羊的不同代谢葡萄糖与代谢蛋白质比例(MG/MP)的研究发现,在1.1倍维持能量水平下,MG/MP的适宜范围为 1.00~1.07;苏鹏程[4]对不同代谢葡萄糖水平饲粮条件下白绒山羊体内蛋白质(氨基酸)的分配规律进行了研究,发现随着代谢葡萄糖水平的提高,白绒山羊体内非必需氨基酸用于葡萄糖异生的量减少,蛋白质在胴体和肌肉中的沉积比例提高。同时苏鹏程等[5]在对不同代谢葡萄糖水平下小肠氨基酸表观消化率进行了研究,发现随着代谢葡萄糖水平的提高,游离氨基酸和必需氨基酸中的精氨酸、异亮氨酸、缬氨酸、苯丙氨酸及赖氨酸的表观消化率降低。宋良荣等[6]对热应激条件下的泌乳奶牛饲喂不同代谢葡萄糖水平的饲粮发现,改变饲粮代谢葡萄糖水平可以调节热应激奶牛的生产性能和生理指标,且代谢葡萄糖水平为99.27 g/kg时效果最好,可以提高奶牛的采食量和产奶量。但是,尚无对不同代谢葡萄糖水平下的瘤胃发酵进行系统性的研究。本试验旨在对不同代谢葡萄糖水平下的人工瘤胃发酵特性、瘤胃微生物蛋白质浓度和产气参数进行研究,为深入研究反刍动物体内葡萄糖代谢提供基础数据和参考。
1 材料与方法
1.1 试验材料
试验所用玉米、豆粕、大豆秸、甘蔗渣均由江苏省姜堰市海伦羊业提供,膨化大豆为河南省神农饲料公司提供,均粉碎过1 mm筛。尿素为上海沪试化工有限公司产分析纯尿素。
1.2 试验设计
采用单因素设计分为4组,代谢葡萄糖水平分别为 125(A)、138(B)、153(C)、168 g/kg(D),每组3个重复。另设1个无底物组,以校正试验误差。发酵底物按照NRC(2001)日增重200 g/d生长羔羊标准配制,底物组成及营养水平见表1。
1.3 试验方法
1.3.1 试验仪器设备
上海精宏DKZ-2B电热水浴恒温器、pHS-3C型pH计、日本岛津GC-14B气相色谱仪、64通路AGRS-Ⅲ型体外发酵产气自动记录装置。

表1 底物组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of substrates(DM basis) %
1.3.2 体外培养
瘤胃液供体动物为4只体重(35±1)kg的杜伯与湖羊杂交F1代,安装有永久性瘤胃瘘管。在瘘管羊晨饲前,利用自制真空负压装置对每只羊采集100 mL瘤胃液,4层纱布过滤,之后将瘤胃液在保温瓶中摇匀混合,在39℃水浴,通CO2。
人工唾液的配制按照Menke等[7]的方法。
每升培养基中含有Na2CO38.82 g、(NH4)2CO30.95 g、Na3PO41.36 g、KHCO31.47 g、MgSO40.14 g、CaCl2·2H2O 16 mg、MnCl2·4H2O 12 mg、CoCl3·6H2O 1.0 mg、FeCl3·H2O 10 mg、Na2S 76 mg 和仞天青1.12 mg。使用前向培养液中充入 CO2,至 pH为6.8。接种前将培养液置于39℃水浴中预热。
按照试验设计称取培养底物600 mg(干物质基础),并于紫外灯下灭菌30 min,每个培养瓶加入人工唾液 40 mL、瘤胃液 20 mL,旋紧瓶塞,39℃恒温水浴培养。分别于培养的 0、2、4、6、8、12、24 h进行取样,每次2 mL。在每次取样后等液体冷却至室温测定pH,之后分装于3支1.5 mL离心管中,-20℃冻存,备测氨氮、挥发性脂肪酸(VFA)和菌体蛋白浓度。
使用AGRS-Ⅲ体外发酵产气记录仪记录产气数据,36 h后停止培养,导出数据。
1.3.3 测定指标与方法
底物粗蛋白质、中性洗涤纤维含量的测定按照贺建华[8]的方法;代谢能、粗脂肪含量参考NRC(2007)[9]查表得到;代谢葡萄糖水平的测定参考兰旭青[10]的方法。培养液 pH的测定使用pHS-3C型pH计;氨氮浓度的测定参照冯宗慈等[11]的方法;微生物的分离按照 Lee等[12]的方法进行,测定使用三氯乙酸法;VFA浓度按照熊本海等[13]的方法测定。
1.3.4 产气模型
根据装置自动记录到的各发酵瓶的产气时间和对应的累积产气量,使用以下公式进行非线性拟合,得出产气参数[14]。

式中:GPt为底物发酵在t时间点(h)的发酵累积产气量(mL/g);A为体外发酵理论最大产气量(mL/g);B为曲线拐点参数;C为达1/2理论最大产气量的时间(h)。
随后使用 Fit Curve软件将各样品在2、4、6、8、12、24 h 时间点的产气量代入 Ørskov 等[15]的产气模型,计算产气参数。模型公式为:

式中:Pt为样品在发酵t时间点的产气量(mL);t为发酵时间(h);a为快速产气量(mL);b为缓慢产气量(mL);c为b的产气速率常数(mL/h);a+b为潜在产气量(mL)。
1.4 数据处理
利用 Excel 2007整理数据,SPSS 19.0的 one way-ANOVA进行单因素方差分析,使用LSD法进行多重比较,P<0.05 为显著差异,P<0.01 为极显著差异。
2 结果
2.1 培养液 p H
由表2可知,各组底物的培养过程中培养液pH在6.23~7.34之间变化,均在瘤胃微生物的最适pH范围(5.8~7.5)内。随时间延长,培养液pH变化趋势为先降低后升高再降低。从不同时间点的数据观察可以发现,各组从同样的培养液pH开始发酵,在 8 h时,A、B组 pH显著高于 C、D组(P<0.05);12 h 时,A、B 组极显著高于 C、D 组(P<0.01);24 h时,A、B 组显著高于 C 组(P<0.05),极显著高于 D 组(P<0.01)。

表2 不同代谢葡萄糖水平对体外发酵培养液p H的影响Table 2 Effects of different metabolic glucose levels on culture fluid pH of in vitro fermentation
2.2 培养液氨氮浓度
由表3可知,随时间的延长,培养液氨氮浓度大致呈先下降再上升的趋势。在2 h时,A组显著低于D组(P<0.05);6 h时,A组显著高于其余3组(P<0.05);12 h时,C组显著高于 D 组(P<0.05),A、B 组与 C、D 组均无显著差异(P>0.05);发酵至24 h时,各组无显著差异(P>0.05)。

表3 不同代谢葡萄糖水平对体外发酵培养液氨氮浓度的影响Table 3 Effects of different metabolic glucose levels on culture fluid NH3-N concentration of in vitro fermentation mg/dL
2.3 培养液MCP浓度
由表4可知,在6 h时,D组培养液细菌蛋白浓度显著高于A、B组(P<0.05);其他时间点各组之间差异不显著(P>0.05)。培养液原虫蛋白浓度在8 h时,A组显著高于B组(P<0.05);其他时间点各组间差异不显著(P>0.05)。培养液MCP浓度在8 h时,A、D 组显著高于B 组(P<0.05);其他时间点各组间差异不显著(P>0.05)。
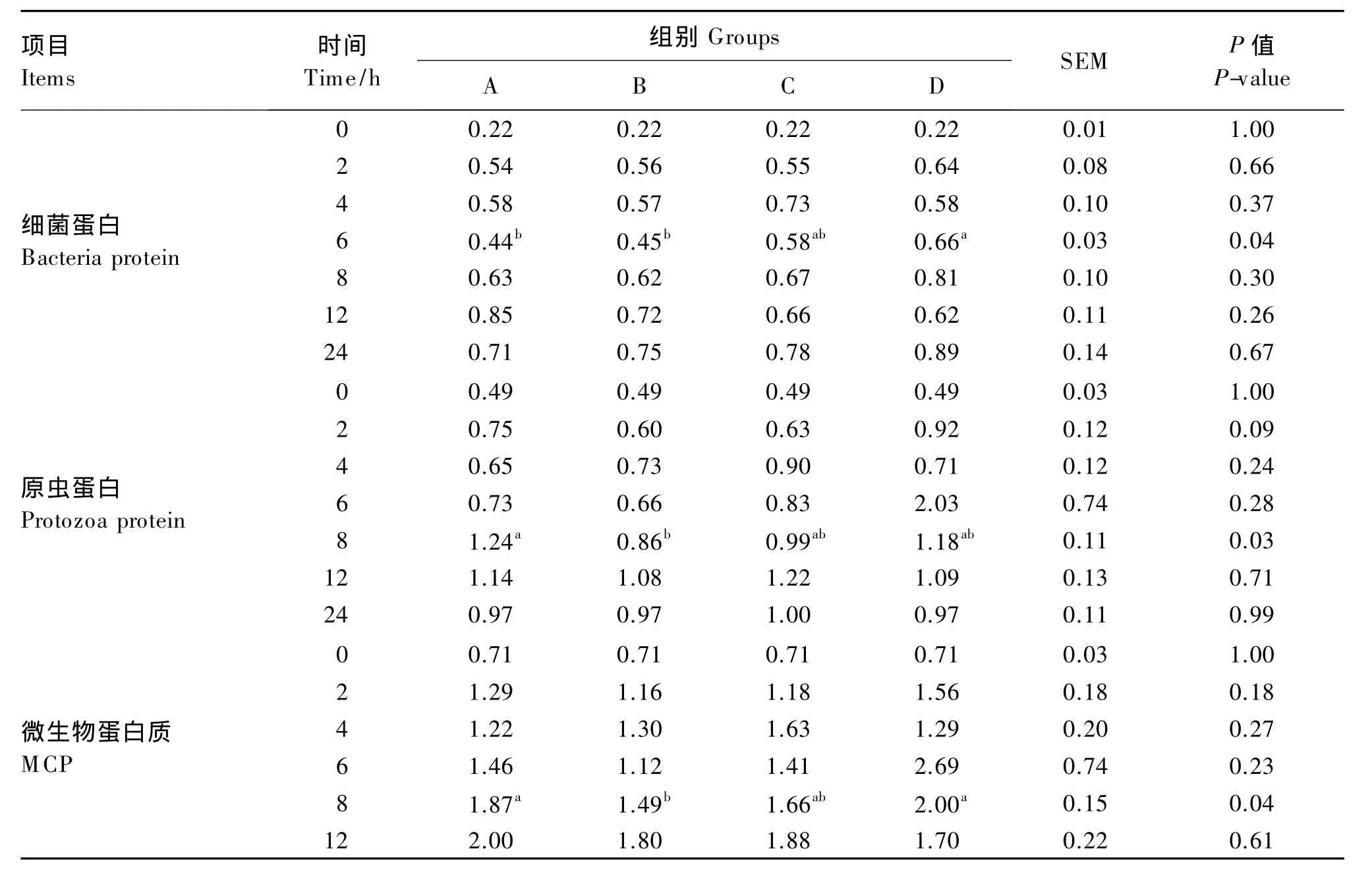
表4 不同代谢葡萄糖对体外发酵培养液MCP浓度的影响Table 4 Effects of different metabolic glucose levels on culture fluid MCP concentration of in vitro fermentation mg/mL
2.4 培养液VFA浓度
由表5可知,不同组的培养液总挥发性脂肪酸(TVFA)、乙酸、丙酸、丁酸浓度均随着时间的延长,总体呈上升趋势。其中,A、B、C组的 TVFA、乙酸、丙酸、丁酸浓度在2~4 h有降低,而D组的降低发生在4~6 h。在之后的培养时间中,TVFA浓度持续上升,培养至24 h时,达到最高浓度。各组培养液乙酸/丙酸随培养时间的延长呈现下降趋势。随着代谢葡萄糖水平的提高,乙酸/丙酸总体呈现下降趋势,在2 h时,D组极显著低于A组(P<0.01),显著低于 B 组(P<0.05),C 组显著低于A组(P<0.05);在8 h时,C组极显著低于A组(P<0.01),显著低于 B 组(P<0.05);在 24 h 时,D组显极著低于 A、B组(P<0.01),显著低于 C组(P<0.05)。

表5 不同代谢葡萄糖水平对体外发酵培养液VFA浓度的影响Table 5 Effects of different metabolic glucose levels on culture fluid VFA concentration of in vitro fermentation
2.5 回归分析
对培养液pH与丙酸浓度进行非线性相关分析可得:pH=7.793-0.194×丙酸+0.006×丙酸2(R2=0.975,P<0.01)。
2.6 产气参数
由表6可知,随着代谢葡萄糖水平的提高,理论最大产气量、拐点参数和达1/2理论最大产气量的时间逐渐降低,组间差异显著或极显著(P<0.05或 P<0.01)。各组潜在产气量无显著差异(P>0.05)。各组24 h产气量随着代谢葡萄糖水平的提高而下降,组间差异极显著(P<0.01)。产气速率常数D组极显著高于A组(P<0.01),显著高于 B、C 组(P<0.05)。
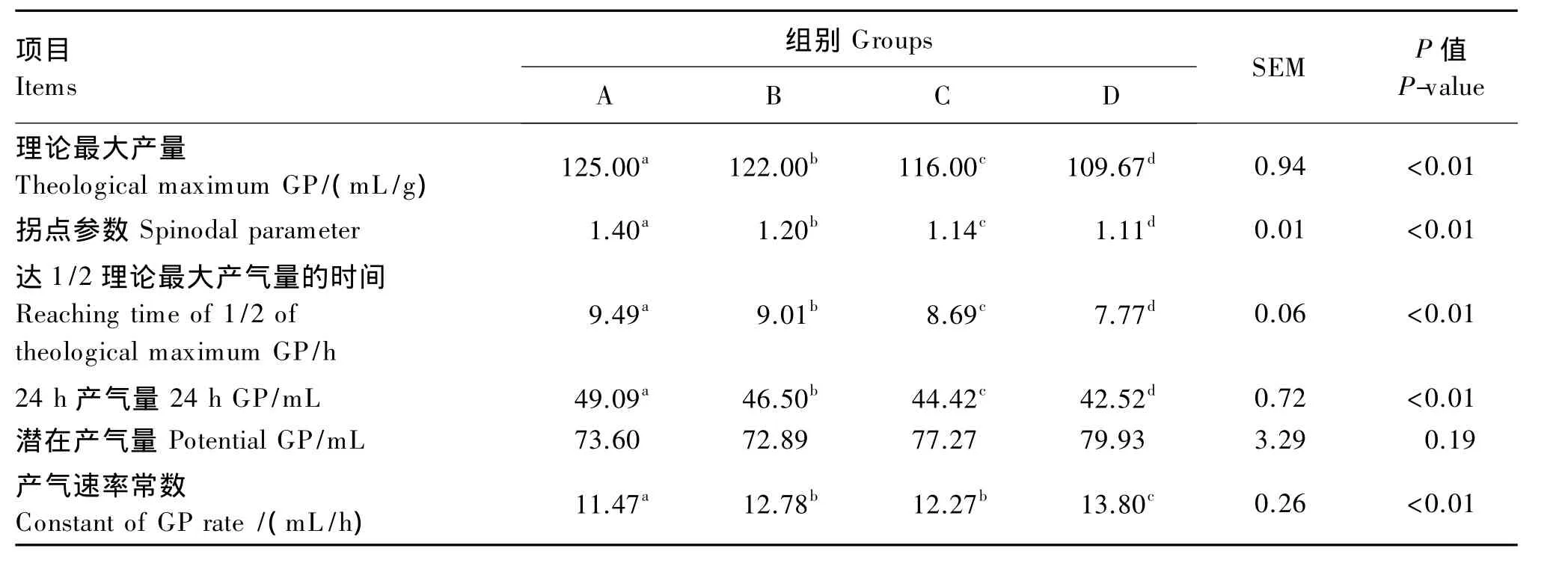
表6 不同代谢葡萄糖水平对体外发酵产气参数的影响Table 6 Effects of different metabolic glucose levels on gas production parameters of in vitro fermentation
3 讨 论
3.1 不同代谢葡萄糖水平对培养液p H的影响
pH可以在一定程度上综合反映瘤胃的发酵情况,瘤胃细菌生长繁殖的适合的pH为6.0~7.0,适合微生物蛋白质合成的 pH为6.3~7.4,当 pH过低时,VFA发生电离,纤维分解菌由于无法将VFA阴离子转运出胞内,积累的VFA阴离子进而对纤维分解菌形成阴离子毒害,导致纤维降解率下降[16-17]。本试验中培养液 pH 在6.23~7.34 之间变动,在瘤胃液pH正常范围内。培养液中VFA的积累是导致pH降低的主要因素,随着代谢葡萄糖水平的提高,培养液pH呈现降低趋势。由于高代谢葡萄糖组发酵产酸速度较快,使得在培养到8 h后,C、D组的pH持续低于A、B组,这与其他学者的研究[18-19]相印证。对TVFA的分析发现,C组24 h的TVFA积累量显著或极显著高于A、B组(P<0.05或 P<0.01)。通过对 pH 与丙酸的双变量相关分析发现,pH与丙酸浓度呈极显著负相关(P<0.01),Pearson 相关性系数为-0.937。观察2 h的氨氮浓度可以发现从A组到D组,氨氮浓度呈上升趋势。马陕红等[20]利用体外发酵试验发现提高底物中的瘤胃降解蛋白质(RDP)可以显著提高培养液的pH(P<0.05),这与试验中发生的现象较为一致。
3.2 不同代谢葡萄糖水平对培养液氨氮浓度的影响
瘤胃中的氨氮是微生物生长繁殖的重要氮源之一。美国康奈尔大学的CNCPS体系根据微生物对发酵底物的利用情况,将瘤胃微生物分为2大类:结构性碳水化合物(SC)分解菌和非结构性碳水化合物(NSC)分解菌。其中SC分解菌发酵植物细胞壁部分,以氨氮作为主要氮源。NSC分解菌分解 NSC,以肽、氨基酸作为主要氮源[21]。在高代谢葡萄糖组添加一定量的尿素,不仅可以中和前期发酵产生的酸性物质,提高培养液pH,还可以为SC分解菌提供充足的氮源,节省饲粮中的优质蛋白质。进一步对pH、丙酸与氨氮之间的关系进行偏相关分析发现,在将氨氮作为控制变量后,pH与丙酸之间的相关系数变成了-0.981(P<0.01)。在发酵至24 h时,底物中可降解部分已大部分被降解,发酵进入平台期,组间氨氮浓度亦差异不显著(P>0.05)。
3.3 不同代谢葡萄糖水平对培养液MCP浓度的影响
MCP是反刍动物重要的蛋白质供应源,可以满足动物每天代谢需要的80%左右。在本试验的发酵过程中,由于不同组之间的碳水化合物及含氮物质的降解速率存在差异,所以在发酵前期,添加尿素的试验组细菌蛋白浓度较高,而原虫蛋白浓度较低。在发酵进行到12 h时,D组氨氮及细菌蛋白浓度降低,但原虫蛋白浓度升高不显著(P>0.05),与之前报道指出的瘤胃液中氨氮浓度低时,纤毛原虫会大量吞噬细菌,导致MCP浓度降低[22]相一致。
3.4 不同代谢葡萄糖水平对培养液VFA浓度的影响
前人在对代谢葡萄糖进行研究时,一直采用单纯底物培养法,并没有对完全饲粮进行体外试验[10,23]。虽然动物的大部分组织对能量供体没有要求,但在最重要的脑、神经、红细胞和心脏组织中,只能利用葡萄糖作为能量的供应体。而反刍动物因为瘤胃的存在,导致大量淀粉和几乎全部的可溶性糖在瘤胃中降解[24],机体可吸收生糖物质减少,使得机体生糖氨基酸大量进行糖异生作用,蛋白质、脂肪沉积减少,在大量饲喂粗饲料的冬春季节甚至掉膘严重[25]。
VFA作为反刍动物重要的能源物质,可以提供动物每天代谢需要的70%~80%,本试验在未提高能量水平的情况下,高代谢葡萄糖组的24 h的TVFA浓度有了较大幅度上升。前人试验发现乙酸浓度与中性洗涤纤维呈显著线性正相关(P<0.05)[26]。而本试验由于中性洗涤纤维水平较为一致,导致各组间乙酸的发酵浓度极为相近。而提高代谢葡萄糖水平使得丙酸浓度大幅上升。在之前对于单独原料的体外培养试验中,能量饲料的丙酸浓度最高,蛋白质饲料次之,粗饲料最低。在本试验中,高代谢葡萄糖组使用的玉米比例较高,使得丙酸发酵量大大提高。其中D组的丙酸发酵在较早的时间便进入平台期,而C组的丙酸浓度持续上升,最终2组的丙酸浓度相近。在本试验中,高代谢葡萄糖水平底物提高了丙酸浓度,使得乙酸/丙酸降低,利于机体蛋白质沉积。
3.5 不同代谢葡萄糖水平对产气参数的影响
在试验中,提高代谢葡萄糖水平使得丙酸浓度也一起升高。而丙酸的产生会消耗培养体系中的氢,使得甲烷排出量下降,进而减少发酵时气体的排出量[27-28]。由数据分析可知,随着代谢葡萄糖水平的提高,理论最大产气量极显著下降(P<0.01),而产气速率常数极显著上升(P<0.01)。使得达1/2理论最大产气量的时间大为缩短。这可能跟高代谢葡萄糖水平的饲粮中含有较多的可溶性碳水化合物有关。由于发酵产生的气体中含有大量的能量,大量发酵气体的排出会导致被动物机体吸收的能量减少,减少气体的排出可以增加被动物吸收的能量。提高代谢葡萄糖水平可以减少理论最大产气量和24 h产气量,从而增加饲粮能量中被动物吸收的比例,提高饲料能量的利用效率。
4 结论
提高代谢葡萄糖水平,可以提高丙酸、总挥发性脂肪酸的浓度,同时可为绵羊提供较多的生糖前体物质。
[1] 冯仰廉.反刍动物营养学[M].北京:科学出版社,2004:340-360.
[2] 卢德勋.动物营养研究进展[M].北京:中国农业大学出版社,1996:14-24.
[3] 孙海洲,卢德勋,张海鹰,等.不同代谢葡萄糖与代谢蛋白质比例的日粮对生长肥育绵羊葡萄糖营养影响的研究[J].动物营养学报,2001,13(1):43-48.
[4] 苏鹏程.不同代谢葡萄糖水平日粮条件下白绒山羊体内蛋白质(氨基酸)分配规律的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2003.
[5] 苏鹏程,卢德勋,孙海洲,等.在氨基酸平衡日粮内不同代谢葡萄糖水平对绒山羊小肠氨基酸表观消化率的影响[J].动物营养学报,2005,17(3):34-38.
[6] 宋良荣,薛白,闫方权,等.饲粮代谢葡萄糖水平对热应激奶牛生产性能和生理指标的影响[J].动物营养学报,2014,26(6):1477-1485.
[7] MENKE K H,STEINGASS H.Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J].Animal Research and Development,1988,28(1):7-55.201402049
[8] 贺建华.饲料分析与检测[M].2版.北京.中国农业出版社,2005:22-32.
[9] NRC.Nutrient requirements of small ruminants:sheep,goats,cervids,and new world camelids[S].Washing-ton,D.C.:National Academies Press,2007.
[10] 兰旭青.奶牛常用饲料MG的测定及玉米加工工艺和粗饲料组合对MG影响的研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2008.
[11] 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].内蒙古畜牧科学,1993(4):40-41.
[12] LEE S S,HA J K,CHENG K J.Relative contributions of bacteria,protozoa,and fungi to in vitro degradation of orchard grass cell walls and their interactions[J].Applied and Environmental Microbiology,2000,66(9):3807-3013.
[13] 翁秀秀.饲喂不同日粮奶牛瘤胃发酵和VFA吸收特性及其相关基因表达的研究[D].博士学位论文.兰州:甘肃农业大学,2013.
[14] 王加启.反刍动物营养学研究方法[M].北京:现代教育出版社,2011:92-95.
[15] ØRSKOV E R,MCDONALD I.The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J].The Journal of Agricultural Science,1979,92(2):499-503.
[16] RUSSELL J B,WILSON D B.Why are ruminal cellulolytic bacteria unable to digest cellulose at low pH?[J].Journal of Dairy Science,1996,79(8):1503-1509.
[17] MONTEILS V,REY M,CAUQUIL L,et al.Random changes in the heifer rumen in bacterial community structure,physico-chemical and fermentation parameters,and in vitro fiber degradation[J].Livestock Science,2011,141(2/3):104-112.
[18] BARGO F,MULLER L D,DELAHOY J E,et al.Milk response to concentrate supplementation of high producing dairy cows grazing at two pasture allowances[J].Journal of Dairy Science,2002,85(7):1777-1792.
[19] 侯志高,王振勇,柴同杰,等.不同精粗比日粮对奶牛机体氧化应激和瘤胃内环境稳定性的影响[J].畜牧兽医学报,2008,39(4):455-459.
[20] 马陕红,昝林森,茹彩霞.可降解蛋白及非蛋白氮对模拟瘤胃体外发酵,营养物质降解率的影响[J].中国畜牧杂志,2006,42(13):36-39.
[21] 李华伟,金海,韦启鹏.CNCPS研究综述——瘤胃发酵[J].畜牧与饲料科学,2011,32(5):31-33.
[22] FACIOLA A P,BRODERICK G A.Effects of feeding lauric acid on ruminal protozoa numbers,fermentation,and digestion and on milk production in dairy cows[J].Journal of Animal Science,2013,91(5):2243-2253.
[23] 韩飞.反刍动物常用饲料丙酸产量和吸收率的测定及其模型化的研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2001:46-48.
[24] 任莹.反刍动物常用饲料过瘤胃淀粉量及其小肠消化率测定及相关技术的研究[D].硕士学位论文.南宁:广西大学,2001.
[25] 张秀梅,曹有才.羊越冬管理的注意事项[J].黑龙江畜牧兽医,2013(4):74-75.
[26] ALLEN M S.Relationship between fermentation acid production in the rumen and the requirement for physically effective fiber[J].Journal of Dairy Science,1997,80(7):1447-1462.
[27] ISLAM M,ABE H,HAYASHI Y,et al.Effects of feeding Italian ryegrass with corn on rumen environment,nutrient digestibility,methane emission,and energy and nitrogen utilization at two intake levels by goats[J].Small Ruminant Research,2000,38(2):165-174.
[28] CHUMPAWADEE S, SOMMART K, VONGPRALUB T,et al.Nutritional evaluation of crop residues and selected roughages for ruminants using in vitro gas production technique[J].Chiang Mai Journal of Science,2006,33(3):371-380.
