复合抗菌肽对断奶仔猪生长性能及血清细胞因子含量的影响
2015-12-21任志华邓又天邓慧丹邓俊良
袁 威 任志华 邓又天 邓慧丹 邓俊良* 胡 洋
(1.四川农业大学动物医学院,动物疫病与人类健康四川省重点实验室,环境公害与动物疾病四川省高校重点实验室,雅安 625014;2.四川华德生物工程有限公司,成都 610000)
现代养猪业中,大多数仔猪在3~4周龄断奶,但是仔猪的免疫功能在7周龄左右才成熟[1]。在这个特殊时期,一些病毒(如猪瘟病毒、猪繁殖与呼吸综合征病毒等)病可导致仔猪高发病率和高死亡率,造成重大的经济损失。因此,如何提高断奶仔猪的免疫功能是很重要的问题。
抗菌肽(AMP)是几十个氨基酸残基组成的小肽。它是从各种植物、动物、组织和细胞分离、提取和纯化出来的具有生物活性的物质[2],具有广泛的功能,包括抗菌、抗病毒、抗真菌、抗肿瘤、抗寄生虫和提高免疫功能等[3-8]。已有研究表明,饲粮中添加抗菌肽能提高小鼠[9]、肉兔[10]、鸡[11-12]和断奶仔猪的免疫功能[13-15]。但目前关于复合抗菌肽对断奶仔猪血清细胞因子含量影响的研究还鲜有报道。本试验在前人试验[13-15]的基础上,研究饲粮中复合抗菌肽水平对断奶仔猪生长性能及血清细胞因子[白介素-2(IL-2)、白介素-4(IL-4)、白介素-6(IL-6)、干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)]含量的影响,初步探讨复合抗菌肽对断奶仔猪机体免疫的调控机制,为今后复合抗菌肽在猪业生产中的应用提供科学依据。
1 材料与方法
1.1 试验材料
试验用复合抗菌肽由四川华德生物工程有限公司提供,由猪防御素(37个氨基酸)和苍蝇抗菌肽(40个氨基酸)混合而成,各占50%;试验用黄芪多糖纯度大于65%,由北京生泰尔生物科技有限公司提供。
1.2 试验动物及饲粮
试验动物为26日龄断奶的杜×长×大三元杂交仔猪;基础饲粮参照NRC(1998)猪的营养需要以及试验猪场的饲粮配方,配制成全价粉状料,其组成及营养水平见表1。
1.3 试验设计与饲养管理
将90头平均体重约为8.28 kg的仔猪按体重相近、公母各占1/2的原则随机分为5组,每组3个重复,每个重复6头猪。Ⅰ组为对照组,饲喂基础饲粮;Ⅱ~Ⅴ组为试验组,分别在基础饲粮中添加400 mg/kg黄芪多糖,250、500和1 000 mg/kg复合抗菌肽。
试验前对猪舍进行消毒,仔猪于21日龄断奶,预饲5 d后进行正式试验,试验期28 d,试验猪采用群饲,饲喂干粉料,日喂3次,每次以吃饱略剩料为宜,自由饮水。其他饲养管理措施和免疫接种按猪场的常规程序进行。
1.4 生长性能指标测定
每周进行1次结料,准确称取饲料重,记录各组仔猪的耗料量;分别于试验第7天(32日龄)、第14天(39日龄)、第21天(46日龄)和第28天(53日龄)进行空腹称重,计算各组的平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
1.5 血清细胞因子含量测定
在试验第7天(32日龄)、第14天(39日龄)、第21天(46日龄)和第28天(53日龄),分别从各重复随机选取2头试验猪前腔静脉采集血2 mL,静置后于3 000 r/min离心15 min制备血清,-20℃ 保 存。血 清 IL-2、IL-4、IL-6、IFN-γ 和TNF-α含量的测定均按武汉基因美生物科技有限公司所生产的试剂盒说明书操作。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.6 数据统计与分析
使用Excel进行数据的前处理,用 SPSS 19.0统计软件进行统计分析,多重比较用Duncan氏法进行。除料重比外,其他数据均用平均值±标准差表示。
2 结果
2.1 复合抗菌肽对断奶仔猪生长性能的影响
从表2可知,在整个试验期间,除33~39日龄Ⅱ组(黄芪多糖组)平均日采食量低于对照组外,其余日龄段各试验组均高于对照组,但均差异不显著(P>0.05)。在整个试验期间,各试验组仔猪平均日增重均高于对照组,除33~39日龄Ⅱ、Ⅲ组和40~46日龄Ⅲ组与对照组差异不显著(P>0.05)外,其余日龄段各试验组均显著或极显著高于对照组(P<0.05 或 P<0.01);除 47~53 日龄Ⅴ组平均日增重高于Ⅱ组但差异不显著(P>0.05)外,其余日龄段Ⅴ组均极显著高于Ⅱ组(P<0.01)。在整个试验期间,各试验组料重比均低于对照组;Ⅱ组和Ⅲ组较为接近,但Ⅳ和Ⅴ组均低于Ⅱ组;复合抗菌肽组(Ⅲ~Ⅴ组)料重比呈剂量依赖性降低。
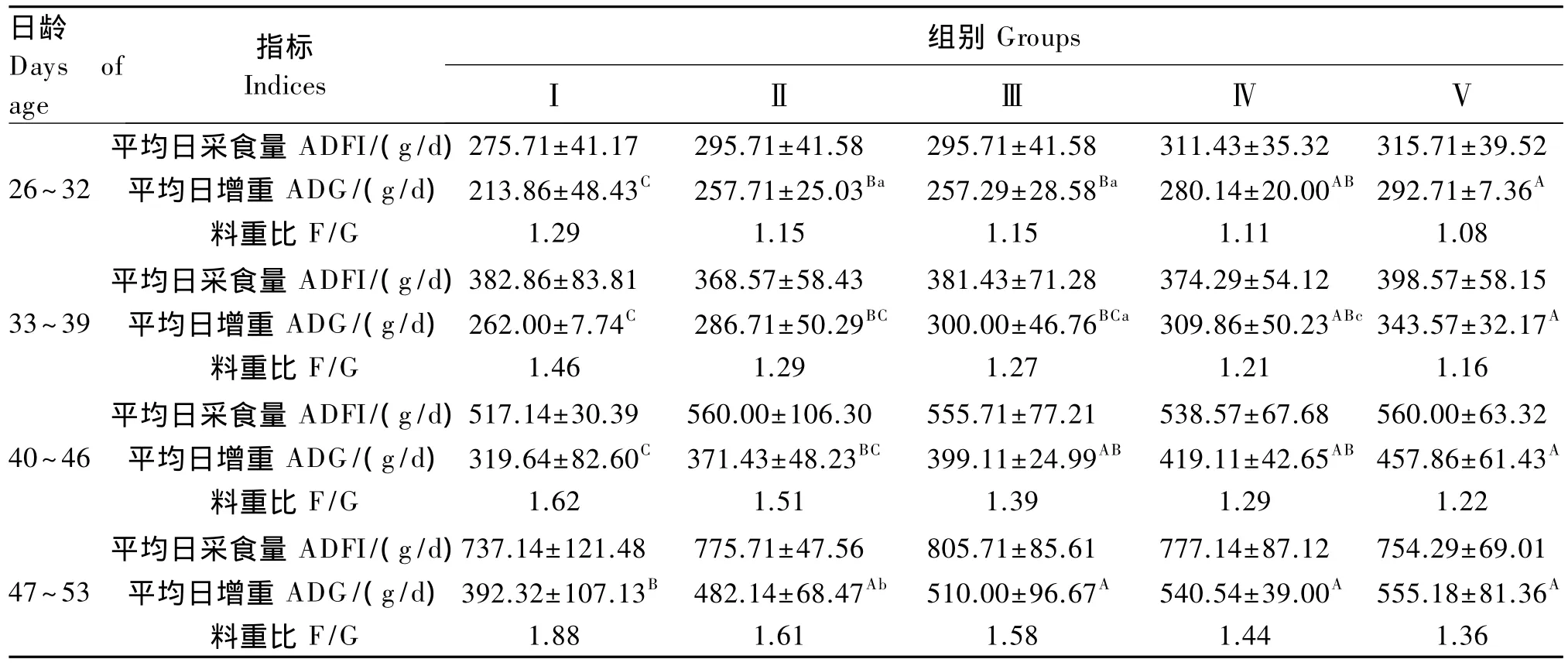
表2 复合抗菌肽对断奶仔猪生长性能的影响Table 2 Effects of complex antibacterial peptide on growth performance of weaned piglets
2.2 复合抗菌肽对断奶仔猪血清 IL-2含量的影响
由表3可知,在各采样日龄,各试验组仔猪血清IL-2含量均高于对照组。在32日龄,Ⅴ组血清IL-2含量极显著高于对照组(P<0.01);在39日龄,Ⅱ、Ⅳ、Ⅴ组血清IL-2含量均极显著高于对照组(P<0.01);在46和53日龄,各试验组血清IL-2含量均极显著高于对照组(P<0.01)。Ⅲ组血清IL-2含量在除32日龄外的各日龄均极显著低于Ⅱ组(P<0.01);Ⅳ组血清IL-2含量在除32日龄外的各日龄均略高于Ⅱ组,但差异不显著(P>0.05);Ⅴ组血清IL-2含量在各日龄均显著或极显著高于Ⅱ组(P<0.05 或 P<0.01)。复合抗菌肽组仔猪血清IL-2含量呈剂量依赖性升高。
2.3 复合抗菌肽对断奶仔猪血清 IL-4含量的影响
由表4可知,除32日龄各组仔猪血清IL-4含量差异不显著(P>0.05)外,各试验组血清IL-4含量在39、46、53日龄均极显著高于对照组(P<0.01)。Ⅲ组血清IL-4含量在除32日龄外的各日龄均极显著低于Ⅱ组(P<0.01);Ⅳ组血清IL-4含量在53日龄显著高于Ⅱ组(P<0.05);Ⅴ组血清IL-4含量在除32日龄外的各日龄均显著或极显著高于Ⅱ组(P<0.05 或 P<0.01)。复合抗菌肽组仔猪血清IL-4含量呈剂量依赖性升高。
2.4 复合抗菌肽对断奶仔猪血清 IL-6含量的影响
由表5可知,除Ⅲ组仔猪血清IL-6含量在32日龄高于对照组但差异不显著(P>0.05)外,各试验组血清IL-6含量在各日龄均极显著高于对照组(P<0.01)。Ⅲ组血清IL-6含量在32和53日龄显著或极显著低于Ⅱ组(P<0.05 或 P<0.01);Ⅳ和Ⅴ组血清IL-6含量在各日龄均显著或极显著高于Ⅱ组(P<0.05 或 P<0.01)。复合抗菌肽组仔猪血清IL-6含量呈剂量依赖性升高。
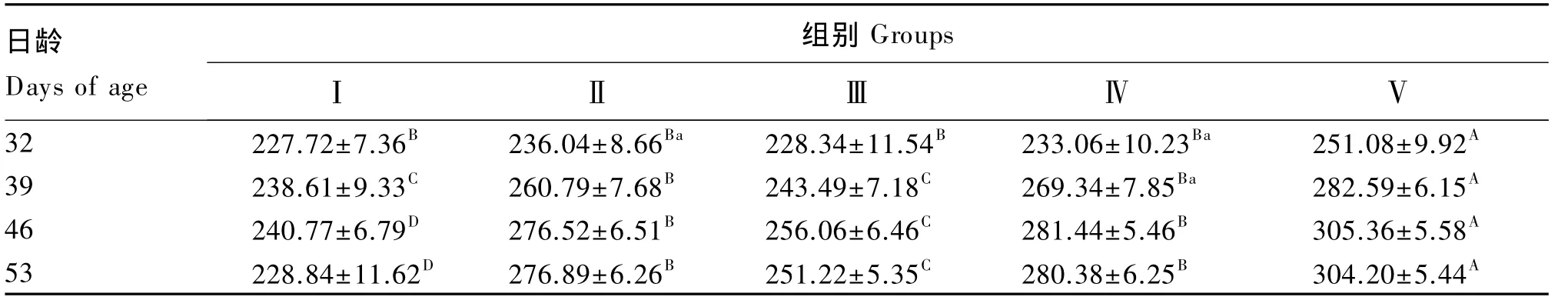
表3 复合抗菌肽对断奶仔猪血清IL-2含量的影响Table 3 Effects of complex antibacterial peptide on serum IL-2 content of weaned piglets ng/L
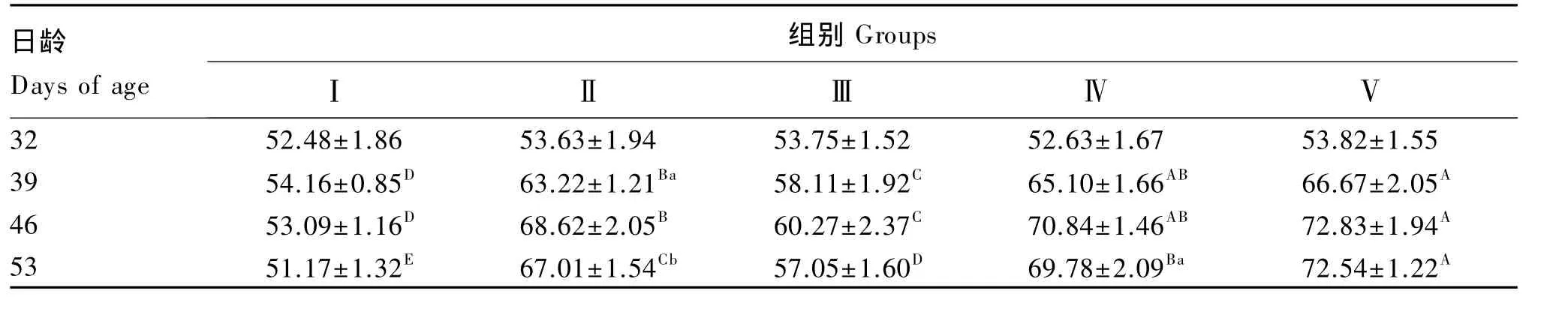
表4 复合抗菌肽对断奶仔猪血清IL-4含量的影响Table 4 Effects of complex antibacterial peptide on serum IL-4 content of weaned piglets ng/L
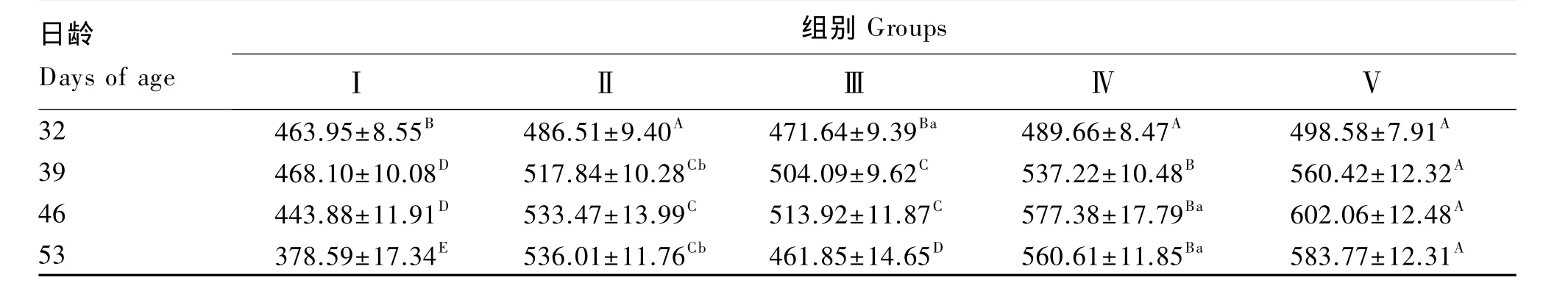
表5 复合抗菌肽对断奶仔猪血清IL-6含量的影响Table 5 Effects of complex antibacterial peptide on serum IL-6 content of weaned piglets ng/L
2.5 复合抗菌肽对断奶仔猪血清IFN-γ含量的影响
由表6可知,各试验组血清IFN-γ含量在各日龄均极显著高于对照组(P<0.01)。Ⅲ组血清IFN-γ含量在各日龄均极显著低于Ⅱ组(P<0.01);除Ⅳ组血清IFN-γ含量在46日龄高于Ⅱ组但差异不显著(P>0.05)外,Ⅳ和Ⅴ组血清 IFN-γ含量在各日龄均极显著高于Ⅱ组(P<0.01)。复合抗菌肽组仔猪血清IFN-γ含量呈剂量依赖性升高。

表6 复合抗菌肽对断奶仔猪血清IFN-γ含量的影响Table 6 Effects of complex antibacterial peptide on serum IFN-γcontent of weaned piglets ng/L
2.6 复合抗菌肽对断奶仔猪血清TNF-α含量的影响
由表7可知,除Ⅱ组仔猪血清TNF-α含量在39日龄以及Ⅲ组仔猪血清TNF-α含量在32、39、46日龄高于对照组但差异不显著(P>0.05)外,各试验组血清TNF-α含量在各日龄均显著或极显著高 于对照组(P<0.05或P<0.01)。Ⅲ组血清TNF-α含量在46和53日龄极显著低于Ⅱ组(P<0.01);Ⅳ组血清TNF-α含量在各日龄均高于Ⅱ组,但差异不显著(P>0.05);Ⅴ组血清 TNF-α 含量在各日龄均显著或极显著高于Ⅱ组(P<0.05或P<0.01)。复合抗菌肽组仔猪血清TNF-α含量呈剂量依赖性升高。

表7 复合抗菌肽对断奶仔猪血清TNF-α含量的影响Table 7 Effects of complex antibacterial peptide on serum TNF-αcontent of weaned piglets ng/L
3 讨论
3.1 复合抗菌肽对断奶仔猪生长性能的影响
研究表明,抗菌肽能有效促进动物生长,从而改善动物的生长性能[16-19]。抗菌肽主要是通过杀灭动物肠道中的有害菌,调节肠道菌群平衡,改善肠绒毛长度,提高黏膜厚度和肠绒毛长度与隐窝深度比值,从而改善小肠黏膜消化结构,增强消化吸收功能,促进动物生长。本试验结果表明,饲粮中添加400 mg/kg黄芪多糖能提高断奶仔猪的平均日采食量和平均日增重,降低料重比,这与Yuan等[20]用100~1 000 mg/kg黄芪多糖饲喂断奶仔猪的研究结果一致;饲粮中分别添加 250、500、1 000 mg/kg复合抗菌肽均能有效提高断奶仔猪平均日采食量和平均日增重,并降低料重比,这与张勇军[21]和王阿荣[22]分别在断奶仔猪饲粮中添加150、300、450 mg/kg 天蚕素抗菌肽和 180、250、320 mg/kg天蚕素抗菌肽的研究结果一致。此外,1 000 mg/kg复合抗菌肽的促生长效果明显优于400 mg/kg黄芪多糖。
3.2 复合抗菌肽对断奶仔猪血清细胞因子含量的影响
细胞因子是由造血系统、免疫系统或炎症反应中的活化细胞产生的高活性多功能的多肽、功能蛋白或糖蛋白,在机体的免疫应答反应、炎症反应、造血、组织修复及胚胎发生和生长发育等诸方面起着关键作用。机体内细胞因子之间构成的“细胞因子微环境”或“细胞因子网络”的失衡,常常与疾病的发生相关[23]。IL-2为辅助性T(Th)1型细胞因子,对于机体的免疫应答起着重要的作用。IL-2的生物活性非常广泛:诱导T细胞增殖分化产生干扰素;增强细胞毒性T淋巴细胞(CTL)和自然杀伤(NK)细胞的杀伤活性;刺激已活化的B细胞增殖,促进免疫球蛋白(Ig)M和IgG的分泌;激活Th细胞再次释放多种辅助因子,以扩大免疫应答;可促使外周血单核细胞释放IFN-γ 和 TNF-α、肿瘤坏死因子-β(TNF-β)[24-25]。IL-4主要由活化的T细胞、单核细胞合成和分泌,肥大细胞和嗜碱性粒细胞也可少量合成[26]。IL-4在调节T、B细胞的分化、活化,以及在促进以Th2细胞为特征的免疫应答过程中发挥重要作用[27]。血液中IL-6主要来源于活化的单核细胞,而局部组织中的IL-6则主要由成纤维细胞或局部巨噬细胞产生。IL-6可促进B细胞增殖和分化;促进浆细胞产生IgG、IgM和IgA,在T细胞中诱导IL-2的产生和白介素-2受体(IL-2R)的表达[28]。IFN-γ主要由细胞细胞和NK细胞产生。IFN-γ可激活巨噬细胞杀死病原微生物,促进其他细胞(CTL、NK细胞等)发挥其细胞毒性作用,诱导皮肤、黏膜的上皮细胞凋亡[29-30];IFN-γ还在Th1型反应过程中充当重要角色,调节主要组织相容性复合体(MHC)Ⅰ型和Ⅱ型蛋白的表达和抗原呈递;IFN-γ还抑制细胞的生长和凋亡,但是可通过诱导激活诱导的细胞死亡来控制免疫反应进程[31]。TNF-α主要由机体多种细胞(如单核巨噬细胞、淋巴细胞、平滑肌细胞、成纤维细胞、内皮细胞、表皮细胞、角质细胞、星形细胞和成骨细胞等)产生和释放[32]。TNF-α可促进 T细胞及其他NK细胞对肿瘤细胞的杀伤活性;作为一种重要的炎症递质,在启动和维持肠组织炎症中起着非常重要的作用[33]。
体外试验表明,人α-防御素能刺激小鼠脾脏细胞增殖并促进其分泌 IL-4、IFN-γ[34],人抗菌肽能通过刺激先天性免疫细胞释放白介素-1β(IL-1β)[35],并能协同 IL-1β 促进人外周血单核细胞产生 IL-6、白介素-10(IL-10)和趋化因子[36]。而 Hancock 等[37]则 认 为 昆 虫 抗 菌 肽CEMA能够抑制RAW细胞中白介素-15(IL-15)的表达。体内试验研究发现,抗菌肽能提高鸡脾脏IL-2 mRNA的表达量,其中200和400 mg/kg抗菌肽组能显著提高其表达量;刘莉如等[38]研究发现,天蚕素抗菌肽能抑制蛋用仔公鸡空肠组织中前炎性细胞因子基因mRNA的表达,其中200、250、300和350 mg/kg抗菌肽均显著抑制IL-6和IFN-γmRNA的相对表达水平,300和350 mg/kg抗菌肽显著抑制TNF-αmRNA的相对表达水平。有关复合抗菌肽对断奶仔猪血清细胞因子含量的影响还未见报道。本试验结果表明:饲粮中添加400 mg/kg黄芪多糖能提高断奶仔猪血清IL-2、IL-4、IL-6、IFN-γ 和 TNF-α 的 含 量,这 与 Yuan等[20]试验得出的在饲粮中添加 324~563 mg/kg黄芪多糖能显著提高断奶仔猪血清中IL-2和IFN-γ的含量(试验期21 d)相一致;而其得出的对血清中IL-4含量无显著影响的结果则与本试验结果不一致,可能与饲喂黄芪多糖的时间长短有关;饲粮中分别添加250、500、1 000 mg/kg复合抗菌肽均能有效提高断奶仔猪血清 IL-2、IL-4、IL-6、IFN-γ和TNF-α的含量,以Ⅴ组效果最为明显,即复合抗菌肽添加量为1 000 mg/kg时效果最好,且添加500、1 000 mg/kg复合抗菌肽时对血清细胞因子含量的提高效果优于400 mg/kg黄芪多糖。这表明复合抗菌肽能通过提高血清IL-2、IL-4、IL-6、IFN-γ和TNF-α的含量来提高断奶仔猪的免疫功能。
4 结 论
饲粮中添加复合抗菌肽能提高断奶仔猪的生长性能,并提高断奶仔猪血清 IL-2、IL-4、IL-6、IFN-γ和TNF-α的含量,从而提高断奶仔猪的免疫功能,以添加量为1 000 mg/kg时效果较好。
[1] WATERS R V,TERRELL T G,JONES G H.Uveitis induction in the rabbit by muramyl dipeptides[J].Infection and Immunity,1986,51(3):816-825.
[2] WANG Z,WANG G S.APD:the antimicrobial peptide database[J].Nucleic Acids Research,2004,32(Suppl.1):D590-D592.
[3] KOCZULLA A R,BALS R.Antimicrobial peptides:current status and therapeutic potential[J].Drugs,2003,63(4):389-406.
[4] HUANG Z J,KINGSOLVER M B,AVADHANULA V,et al.An antiviral role for antimicrobial peptides during the arthropod response to alphavirus replication[J].Journal of Virology,2013,87(8):4272-4280.
[5] ROSSIGNOL T,KELLY B,DOBSON C,et al.Endocytosis-mediated vacuolar accumulation of the human ApoE apolipoprotein-derived ApoEdpL-W antimicrobial peptide contributes to its antifungal activity in candida albicans[J].Antimicrobial Agents and Chemotherapy,2011,55(10):4670-4681.
[6] YAN JX,WANG K R,CHEN R,et al.Membrane active antitumor activity of NK-18,a mammalian NK-lysin-derived cationic antimicrobial peptide[J].Biochimie,2012,94(1):184-191.
[7] TORRENT M,PULIDO D,RIVAS L,et al.Antimicrobial peptide action on parasites[J].Current Drug Targets,2012,13(9):1138-1147.
[8] YU F S,CORNICELLI M D,KOVACH M A,et al.Flagellin stimulates protective lung mucosal immunity:role of cathelicidin-related antimicrobial peptide[J].The Journal of Immunology,2010,185(2):1142-1149.
[9] 耿娟,王永才,陈丽颖.鸭白细胞抗菌肽对小鼠免疫功能的影响[J].河南农业科学,2011,40(4):142-145.
[10] 雷岷,郭志强,任永军,等.天蚕素抗菌肽对肉兔生产性能和免疫器官指数的影响[J].中国饲料,2012(9):25-27.
[11] 王秀青,朱明星,张爱君,等.抗菌肽Cecropin B对鸡生长发育及免疫功能的影响[J].宁夏医科大学学报,2011,32(1):39-41,46.
[12] CHOI SC,INGALE SL,KIM JS,et al.Effects of dietary supplementation with an antimicrobial peptide-P5 on growth performance,nutrient retention,excreta and intestinal microflora and intestinal morphology of broilers[J].Animal Feed Science and Technology,2013,185(1/2):78-84.
[13] WU SD,ZHANG F R,HUANG Z M,et al.Effects of the antimicrobial peptide cecropin AD on performance and intestinal health in weaned piglets challenged with Escherichia coli[J].Peptides,2012,35(2):225-230.
[14] 蒋桂韬,杨俊,邱美珍,等.天蚕素抗菌肽对断奶仔猪生长性能和猪瘟及伪狂犬抗体水平的影响[J].家畜生态学报,2013,34(3):25-29.
[15] YOON J H,INGALE S L,KIM J S,et al.Effects of dietary supplementation of synthetic antimicrobial peptide-A3 and P5 on growth performance,apparent total tract digestibility of nutrients,fecal and intestinal microflora and intestinal morphology in weanling pigs[J].Livestock Science,2014,159:53-60.
[16] 刘莉如.天蚕素抗菌肽对蛋用仔公鸡生长、免疫及相关细胞因子mRNA表达水平影响的研究[D].硕士学位论文.乌鲁木齐:新疆农业大学,2012.
[17] 马卫明,佘锐萍,胡艳欣,等.猪小肠抗菌肽对雏鸡的促生长作用及其机理初探[J].中国农业科学,2006,39(8):1723-1728.
[18] 晏家友.抗菌肽在养猪生产中的应用[J].养猪,2011(4):21-22.
[19] 李丽.抗菌肽Abaecin制备及其对肉鸡生长及免疫影响的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2010.
[20] YUAN SL,PIAO X S,LI D F,et al.Effects of dietary Astragalus polysaccharide on growth performance and immune function in weaned pigs[J].Animal Science,2006,82(4):501-507.
[21] 张勇军.抗菌肽在断奶仔猪日粮中添加效果的研究[D].硕士学位论文.长沙:湖南农业大学,2012.
[22] 王阿荣.天蚕素抗菌肽对断奶仔猪和母猪生产性能的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2011.
[23] 孙卫民,王惠琴.细胞因子研究方法学[M].北京:人民卫生出版社,1999.
[24] 王世若.白细胞介素研究进展[J].西南民族学院学报:自然科学版,1991,17(1):83-86.
[25] 刘彦威,刘娜.白细胞介素的功能及临床应用[J].中国兽医科技,1992,22(12):46-47.
[26] 胡洪慧,王凤山,凌沛学.白细胞介素-4的研究进展[J].中国药学杂志,2005,40(10):721-725.
[27] 李睿.白细胞介素-4的研究进展[J].华北煤炭医学院学报,2011,13(3):329-332.
[28] HIRANO T,TAGA T,NAKANO N,et al.Purification to homogeneity and characterization of human B-cell differentiation factor(BCDF or BSFp-2)[J].Proceedings of the National Academy of Sciences of the United States of America,1985,82(16):5490-5494.
[29] BASINSKI T M,HOLZMANN D,EIWEGGER T,et al.Dual nature of T cell-epithelium interaction in chronic rhinosinusitis[J].Journal of Allergy and Clinical Immunology,2009,124(1):74-80.
[30] ZIMMERMANN M,KORECK A,MEYER N,et al.TNF-like weak inducer of apoptosis(TWEAK)and TNF-αcooperate in the induction of keratinocyte apoptosis[J].Journal of Allergy and Clinical Immunology,2011,127(1):200-207.
[31] AKKOC T,DE KONING P J A,RÜCKERT B,et al.Increased activation-induced cell death of high IFN-γproducing TH1 cells as a mechanism of TH2 predominance in atopic diseases[J].Journal of Allergy and Clinical Immunology,2008,121(3):652-658..
[32] KAPADIA S,LEE J,TORRE-AMIONE G,et al.Tumor necrosis factor-alpha gene and protein expression in adult feline myocardium after endotoxin administration[J].Journal of Clinical Investigation,1995,96(2):1042-1052.
[33] SU C Y,SALZBERG B A,LEWISJD,et al.Efficacy of anti-tumor necrosis factor therapy in patients with ulcerative colitis[J].The American Journal of Gastroenterology,2002,97(10):2577-2584.
[34] TANI K J,MURPHY W J,CHERTOV O,et al.Defensins act as potent adjuvants that promote cellular and humoral immune responses in mice to a lymphoma idiotype and carrier antigens[J].International Immunology,2000,12(5):691-700.
[35] ELSSNER A,DUNCAN M,GAVRILIN M,et al.A novel P2X7receptor activator,the human cathelicidinderived peptide LL37,induces IL-1β processing and release[J].The Journal of Immunology,2004,172(8):4987-4994.
[36] YU J,MOOKHERJEE N,WEE K,et al.Host defense peptide LL-37,in synergy with inflammatory mediator IL-1β,augments immune responses by multiple pathways[J].The Journal of Immunology,2007,179(11):7684-7691.
[37] HANCOCK R E W,LEHRER R I.Cationic peptides:a new source of antibiotics[J].Trends in Biotechnology,1998,16(2):82-88.
[38] 刘莉如等.天蚕素抗菌肽对蛋用仔公鸡生长、免疫及
相关细胞因子mRNA表达水平影响的研究[J].硕 士学位论文.乌鲁木齐:新疆农业大学,2012.
