缺血性脑卒中患者肝损害与肠源性内毒素血症的相关性研究
2015-12-21黄鹿摆斌
黄 鹿 摆 斌
1)湖北孝感市第一人民医院消化内科 孝感 432100 2)湖北孝感市中心医院消化内科 孝感 432100
缺血性脑卒中患者肝损害与肠源性内毒素血症的相关性研究
黄 鹿1)摆 斌2)△
1)湖北孝感市第一人民医院消化内科 孝感 432100 2)湖北孝感市中心医院消化内科 孝感 432100
目的 探讨缺血性脑卒中患者肝损害与肠源性内毒素血症的关系。方法 选择57例缺血性脑卒中患者为研究对象,并选择同期进行体检的健康老年人56例为对照组,测定2组的肝血清谷丙转氨酶(ALT)、天门冬氨酸转氨酶(AST)、血清肿瘤坏死因子-α(TNF-α)和血浆内毒素(LPS)水平,以及肝组织超氧化物歧化酶(SOD)、丙二醛(MDA)和谷胱甘肽过氧化物酶活性(GSH-PX)水平,并观察肠源性内毒素和上述指标改变的关系。结果 经统计学分析显示,研究组中血清ALT、AST、TNF-α和血浆内毒素LPS分别为(81.47±6.82)U/L、(175.72±12.63)U/L、(0.54±0.06)μg/L、(0.47±0.02)eu/mL,与对照组(35.62±4.69)U/L、(102.37±9.89)U/L、(0.09±0.04)μg/L、(0.07±0.01)eu/mL相比,差异有统计学意义(P <0.05);研究组SOD(74.28±9.44)和GSH-PX(10.46±3.47)水平均显著低于对照组(135.53±13.51)、(22.53±5.38),MDA水平(17.68±8.52)高于对照组(7.76±2.65),差异有统计学意义(P<0.05);研究组病人全血黏度(包括切变率10、切变率60、切变率150)、血浆黏度和红细胞比积均显著高于对照组(P<0.05)。相关性分析表明,LPS水平与SOD、GSH-PX呈显著负相关(P<0.05);LPS水平与血清ALT、AST和TNF-α水平呈显著正相关(P<0.05);血浆LPS水平与MDA呈显著正相关(P<0.05);LPS水平与全血黏度(包括切变率10、切变率60、切变率150)、血浆黏度和红细胞比积均呈显著正相关(P <0.05)。结论 缺血性脑卒中患者出现肝脏和肠黏膜的损害,肝损害与肠源性内毒素血症密切相关。
缺血性脑卒中;肝损害;肠源性内毒素血症;相关性
缺血性脑卒中(cerebral ischemic stroke,CIS)又称脑梗死(cerebral infarction,CI),是指局部脑组织因血液循环发生障碍,缺血、缺氧而导致的软化坏死[1]。脑卒中是威胁人类健康的三大疾病之一,已为我国第一致病死因,病死率高达20%~30%。缺血性脑卒中常会发生许多脏器功能损伤,严重时可引发多器官功能衰竭而增加致残率和病死率[2]。其中,肝脏和胃肠道是常见的受损脏器,也是全身发生氧化应激反应的初始和扩大的脏器。近年来,人们对于缺血性脑卒中的研究越来越多,但缺血性脑卒中患者的肝损害与肠源性内毒素血症相关性的研究甚少,本文就此展开研究,现将实验方法及结果报道如下。
1 资料与方法
1.1 一般资料 选择57例缺血性脑卒中患者作为研究对象,男31例,女26例;年龄47~79岁,平均(61.65±11.42)岁。缺血性脑卒中诊断按照第4届全国脑血管病学术会议制定的脑梗死发作诊断标准,所有患者入院后均进行头部CT检查并复查,确定病灶部位和大小,其中脑梗死病灶位于基底节区27例,半卵圆中心区域13例,皮质17例。选择同期进行体检的健康老年人56例为对照组,男33例,女23例;年龄49~81岁,平均(59.78±9.82)岁。2组性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 患者选择标准(1)急性缺血性脑卒中患者均为首次发病,并于发病24h内入院接受治疗;(2)有动脉粥样硬化史;(3)梗死病灶均为基底节区、半卵圆中心以及皮质的单发病灶;(4)入院前1个月内无感染史或外伤手术史;(5)无严重心、肝、肾功能障碍;(6)无血液系统、肿瘤或自身免疫系统疾病;(7)近1个月未接受过其他治疗的患者。
1.3 检测项目 采用酶学方法检测肝血清谷丙转氨酶(ALT)、天门冬氨酸转氨酶(AST),ELISA法检测血清内毒素(LPS),硫代巴比妥酸法测定丙二醛(MDA),化学发光法测定肝组织超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶活性(GSH-PX)水平,具体操作按试剂盒说明书进行。
1.4 统计学分析 采用SPSS 17.0软件进行统计学分析,所有检测资料用±s表示,组内比较采用配对样本t检验,组间差异采用两独立样本t检验,相关数据间进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 血清ALT、AST、TNF-α及血浆LPS水平比较 研究组血清ALT、AST、TNF-α和血浆LPS水平与对照组相比,差异有统计学意义(P<0.05),且血浆LPS水平与血清ALT、AST和TNF-α呈显著正相关(P<0.05)。见表1。
2.2 2组肝组织SOD、MDA和GSH-PX水平比较 研究组SOD和GSH-PX水平均显著低于对照组,LPS水平与SOD、GSH-PX水平呈显著负相关(P<0.05);研究组MDA高于对照组,差异有统计学意义(P<0.05),LPS水平与MDA呈显著正相关(P<0.05)。见表2。
表1 血清ALT、AST、TNF-α及血浆LPS水平比较(±s)

表1 血清ALT、AST、TNF-α及血浆LPS水平比较(±s)
检测指标 研究组(n=57)对照组(n=56) F值P值ALT(U/L) 81.47±6.82 35.62±4.69 12.46<0.05 AST(U/L)175.72±12.63 102.37±9.89 7.81<0.05 TNF-α(μg/L)0.54±0.06 0.09±0.04 14.65<0.05 LPS(eu/mL)0.47±0.02 0.07±0.01 8.69<0.05
表2 2组肝组织SOD和MDA水平比较(±s,IU/L)
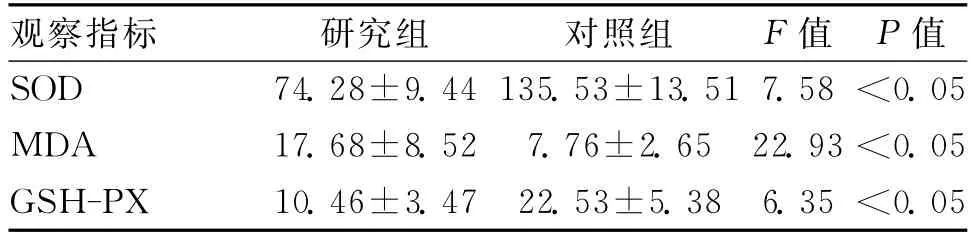
表2 2组肝组织SOD和MDA水平比较(±s,IU/L)
观察指标 研究组 对照组 F值P值SOD 74.28±9.44 135.53±13.51 7.58<0.05 MDA 17.68±8.52 7.76±2.65 22.93<0.05 GSH-PX 10.46±3.47 22.53±5.38 6.35<0.05
2.3 血液流变学变化 研究组病人全血黏度(包括切变率10、切变率60、切变率150)、血浆黏度和红细胞比积均显著高于对照组(P<0.05)。LPS水平与全血黏度(包括切变率10、切变率60、切变率150)、血浆黏度和红细胞比积均呈显著正相关(P<0.05)。见表3。
表3 2组血液流变学比较(±s)
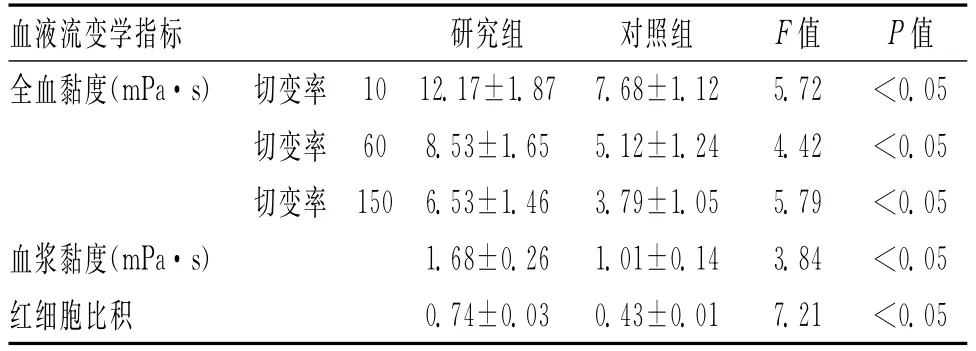
表3 2组血液流变学比较(±s)
血液流变学指标 研究组 对照组 F值 P值全血黏度(mPa·s) 切变率 10 12.17±1.87 7.68±1.12 5.72 <0.05切变率60 8.53±1.65 5.12±1.24 4.42 <0.05切变率150 6.53±1.46 3.79±1.05 5.79 <0.05血浆黏度(mPa·s) 1.68±0.26 1.01±0.14 3.84 <0.05红细胞比积 0.74±0.03 0.43±0.01 7.21 <0.05
3 讨论
脑卒中是世界上仅次于恶性肿瘤和心血管疾病的严重致死性疾病,也是最常见的致残性疾病之一[3]。缺血性脑卒中急性早期便会出现脏器损伤,如肠道、肝、肾、心、肺等受到损伤。其中,肝脏作为人体的最大代谢器官,导致在缺血性脑卒中急性早期肝脏损伤的敏感性比其他脏器高很多,同时由于肝脏作为损伤后的炎症反应的放大器官,对脑组织会造成二次或多次打击,故肝损伤和脑损伤可能互为因果,互相促进,导致恶性循环[4-6]。虽然缺血性脑卒中导致的肝损伤的发病机制目前还不清楚,一般认为是一个多细胞参与和多种介质共同作用的复杂的病理生理过程。
缺血性脑卒中患者由于肝缺血、感染以及毒性物质等因素导致肝功能损害,导致内毒素灭活功能降低,同时肠黏膜屏障受损,使大量肠源性内毒素进入血液,形成肠源性内毒素血症,内毒素又可加重肝损害,从而导致肝功能不全甚至肝功能衰竭[7]。氧化应激在缺血性脑卒中患者肝损害中也有重要作用,缺血性脑卒中患者肝脏内自由基含量增加,当其含量超过机体自由基的清除能力时即可造成肝损害。自由基清除剂SOD、脂质过氧化代谢产物MDA是世界上公认的能较好反映体内自由基水平以及脂质过氧化损伤程度的指标[7-8];另外,在发生脑卒中时,清除自由基的一些酶系(如谷胱甘肽-谷胱甘肽还原酶系统等)活性也降低,对自由基的清除效率降低,也会使体内自由基增多。
本研究显示,研究组血清ALT、AST、TNF-α和血浆LPS水平与对照组相比,差异有统计学意义(P<0.05),且血浆LPS水平与血清ALT、AST和TNF-α呈显著正相关(P <0.05);证实缺血性脑卒中患者有肠黏膜屏障的损伤和肠源性内毒素血症,并与脑卒中后肝损害的发生密切相关。研究组SOD和GSH-PX水平均显著低于对照组,相关性分析表明,LPS水平与SOD、GSH-PX水平呈显著负相关(P<0.05);研究组MDA高于对照组(P<0.05),相关性分析表明,LPS水平与MDA呈显著正相关(P<0.05),表明LPS、SOD、GSH-PX和MDA通过级联或协同作用,引起或加重肝损害;研究组全血黏度(包括切变率10、切变率60、切变率150)、血浆黏度和红细胞比积均显著高于对照组(P<0.05)。相关性分析表明,LPS水平与全血黏度、血浆黏度和红细胞比积均呈显著正相关(P<0.05)。
综上所述,缺血性脑卒中患者出现肝脏和肠黏膜的损害,肝损害与肠源性内毒素血症密切相关,由于肝脏的特殊功能,肝损害可与肠源性内毒素血症相互影响,一方面可导致肠、血屏障功能受损,细菌和内毒素“逃逸”,进一步加重肠源性内毒素血症;另一方面,肝脏能通过合成和分泌多种炎性介质,反过来加重肝和肠黏膜的损伤。
[1]陈宁,丁琪,袁志华,等.阿托伐他汀对老年缺血性脑卒中患者氧化低密度脂蛋白和超氧化物歧化酶的影响[J].中国临床保健杂志,2013,16(1):23-25.
[2]徐欣萍,安傅,邹军,等.缺血性脑卒中大鼠肝损害及与肠源性内毒素血症的关系研究[J].湖南中医药大学学报,2012,32(6):7-10.
[3]王玮.进展性脑卒中危险因素的临床分析[J].中国老年学杂志,2013,33(23):5 811-5 814.
[4]任卫英,张顺财,涂传涛,等.肝硬化大鼠小肠微绒毛形态和超微结构的改变与肠源性内毒素血症的关系[J].复旦学报(医学版),2008,35(1):125-127.
[5]胡兵.肝硬化肠源性内毒素血症的研究进展[J].临床和实验医学杂志,2012,11(4):313,316.
[6]冯丽丽,汪晓军.肝硬化时肠源性内毒素血症形成机制的研究进展[J].中国中西医结合消化杂志,2013,21(9):496-498.
[7]王全楚,程正祥,邓应彪,等.创伤应激性肝损害与肠源性内毒素血症关系的研究[J].实用医药杂志,2010,27(3):201-202.
[8]祖红梅,赵鹏飞.自制中药汤剂联合乳果糖保留灌肠治疗肝衰竭肠源性内毒素血症临床观察[J].山东医药,2013,53(31):72-73
(收稿2014-04-06)
R743.3
A
1673-5110(2015)06-0057-02
△通讯作者:摆斌,E-mail:medsci-ww@qq.com
