灵芝菌丝体多糖的分离纯化及其单糖组成分析与分子量测定
2015-12-20王海燕陈尚卫江南大学食品学院江苏无锡40江南大学食品科学与技术国家重点实验室江苏无锡40
王海燕 戴 军 陈尚卫(.江南大学食品学院,江苏 无锡 40;.江南大学食品科学与技术国家重点实验室,江苏 无锡 40)
灵芝(G.lucidum)属担子菌纲、多孔菌目、灵芝科、灵芝属[1],按其生长过程可分为菌丝体、子实体和孢子粉3个阶段。中国灵芝属真菌有75种,常见的有赤芝、紫芝、黑芝、松杉灵芝等。近年来,研究发现灵芝具有降血糖[2,3]、降血脂[4]、免疫调节[5]、抗肿瘤[6]、抗氧 化[7]等保健功 能,其主 要功效成分为多糖和三萜[8]。
作为灵芝的主要活性物质之一,灵芝多糖类产品受到人们青睐。野生灵芝极为有限,传统的固体培养基培植法受到生产周期长、生产效率低等制约,无法实现大规模工业化生产;液体深层发酵灵芝菌丝体多糖具有含量高、培养周期短、可大规模生产和易于标准化等优点[9],因此其成为研究热点。
目前,关于灵芝菌丝体多糖的研究主要包括发酵优化、结构分析和活性检测等方面[10-12]。本试验为考察前期优化的赤芝菌种在最佳发酵条件下得到的赤芝菌丝体粗多糖的组成特性,对该粗多糖分离纯化后分别利用高效体积排阻色谱(HPSEC)、PMP柱前衍生化反相高效液相色谱(RP—HPLC)和多角度光散射(SEC—MALLS)等技术分别研究了各级分多糖的单糖组成、分子量分布以及链构象特性,为进一步对该赤芝多糖进行构效关系研究和产品研发提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
赤芝菌丝体多糖样品:本实验室自制;
阴离子交换凝胶:DEAE-Sepharose CL-6B型,美国 GE Healthcare公司;
葡聚糖标准品:Dextran系列,美国Sigma公司;
甘露糖、鼠李糖等12种单糖标准品:>97%,美国Sigma-Aldrich公司;
乙腈:色谱纯,美国Tedia公司;
1-苯基-3-甲基-5-吡唑啉酮(PMP):99%,美国Acros Organics公司;
三氟乙酸:化学纯,国药集团化学试剂有限公司;
盐酸、苯酚、硫酸、三氯甲烷、无水乙醇、硝酸钠、甲醇和氢氧化钠:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
高效液相色谱仪:Waters 1525型,美国Waters公司;
液相色谱系统:Aligent 1200型,安捷伦科技有限公司;
多角度激光光散射仪:DAWN8型,美国Wyatt公司;
可见光分光光度计:722N型,上海精密科学仪器有限公司;
自动收集器及玻璃层析柱(3.2cm×25cm):BSZ-100型,上海沪西分析仪器厂;
旋转蒸发仪:RE52-2型,上海亚荣生化仪器公司;
恒温水浴锅:HH-2型,江苏省金坛市新航仪器厂。
1.2 方法
1.2.1 灵芝菌丝体粗多糖的分离纯化 脱蛋白、脱色后,将灵芝菌丝体多糖配制为浓度50mg/mL的水溶液。样品上DEAE-Sepharose Fast Flow柱(3.2cm×25cm),用自动收集器前后分2次各收集洗脱液100管,第1次以pH 7.8的0.02mol/L Tris—HCl溶液为洗脱液,第2次以0.01~1.00mol/L NaCl溶液和0.02mol/L Tris—HCl溶液梯度洗脱,流速为8mL/min,每分钟收集1管,每5管(每管取0.2mL,共1.0mL)用苯酚硫酸法[13]于490nm处测多糖的吸光值。收集主要峰组分,用截留分子量为3.5×103Da的透析袋透析48h除盐后冷冻干燥得GLMP1、GLMP2和GLMP3。
1.2.2 级分多糖的高效体积排阻色谱法(HPSEC)分析 色谱条件参考文献[14],GLMP1、GLMP2和GLMP3分别配成浓度约为10mg/mL的水溶液,过0.45μm微孔滤膜后进样分析。
1.2.3 级分多糖的单糖组成分析
(1)样品的完全酸水解:将多糖级分别溶于水配成浓度约为5mg/mL的溶液,吸取500μL溶液于具塞试管中,加入2mol/L TFA溶液500μL,充分混匀后充入N2封管,置于110℃烘箱中水解120min,取出冷却至室温,加入同体积的甲醇,氮气吹干,重复3次后以1mL超纯水溶解。
(2)混合单糖标样PMP衍生化:取100μL的混合单糖标准液(各单糖质量浓度均为3mg/mL左右)与等体积0.6mol/L NaOH溶液混合均匀,取50μL上述混合液于5mL具塞试管中,加入0.5mol/L的PMP甲醇溶液50μL,旋涡混匀;70℃下反应100min中,取出冷却至室温,加0.3mol/L的HCl溶液60μL中和pH,加水定容至1mL,再加入的1mL氯仿,振荡使两相充分接触,静置后弃去有机相,重复3次以除去多余的PMP试剂,将衍生化后的溶液过0.45μm微孔滤膜,进样分析。级分多糖样品水解产物的PMP衍生化方法与混标衍生化方法相同。
(3)RP—HPLC色谱条件:检测器:二极管阵列检测器(DAD);色 谱 柱:ZORBAX Eclipse XDB-C18(250mm×4.6mm i.d.,5μm);流动相:0.1mol/L pH 6.7磷酸盐缓冲液—乙腈(V/V=83/17);检测波长:245nm;柱温:30℃;流速:1mL/min;进样体积:20μL
1.2.4 SEC—MALLS分析
(1)SEC—MALLS—RI体系:采用尺寸排除色谱和多角度光散射仪联用装置(SEC—MALLS)测试试样的重均分子量(Mw)、多分散系数(Mw/Mn)及均方根旋转半径(RMS)。多角度激光光散射仪(MALLS)波长为633nm,用茁霉多糖(Mw=1.18×104,Mw/Mn=1.10)做为标样进行归一化。尺寸排除色谱装置分别使用水体系的Shodex OHpak SB-805HQ和Shodex OHpak SB-804HQ 两根色谱柱串 联 和 示 差 折 光 检 测 器 (RI-150,Thermo Finnigan,USA)。
(2)测试条件:流动相:0.2mol/L的 NaCl水溶液;流速:0.5mL/min;测试温度:25℃;进样量:200μL。
(3)样液制备:多糖级分分别溶于0.2mol/L的NaCl水溶液中,样品浓度为1mg/mL。进样前样品及流动相经过0.2μm滤膜过滤。
2 结果与分析
2.1 灵芝菌丝体多糖的分离纯化
通过DEAE-Sepharose Fast Flow柱的洗脱液以管数为横坐标,吸光值为纵坐标绘制洗脱曲线(图1),按照出峰顺序先后收集得到3个多糖级分分别命名为GLMP1、GLMP2和GLMP3,级分组分透析除盐后冻干供后续分析。
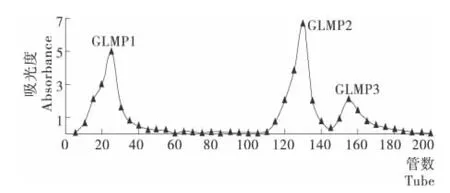
图1 灵芝菌丝体多糖通过DEAE-Sepharose Fast Flow柱洗脱曲线Figure 1 Elution curve of Ganoderma lucidummycelium polysaccharide on DEAE-Sepharose
2.2 级分多糖的高效体积排阻色谱法(HPSEC)分析
纯度的概念是随着分离分析手段的进展而不断发展的,多糖是结构复杂的生物大分子,它的纯度只代表多糖在某一链长的平均分布,因此通常意义上的多糖纯度是指多糖在一定分子量范围的均一分布[15]。高效体积排阻色谱(HPSEC)具有快速、高分辨率和重现性好的优点,是目前最常见的鉴定多糖纯度的方法。由图2可知,除少量杂峰外3个级分均为单一对称的峰型,可以视为均一的多糖。
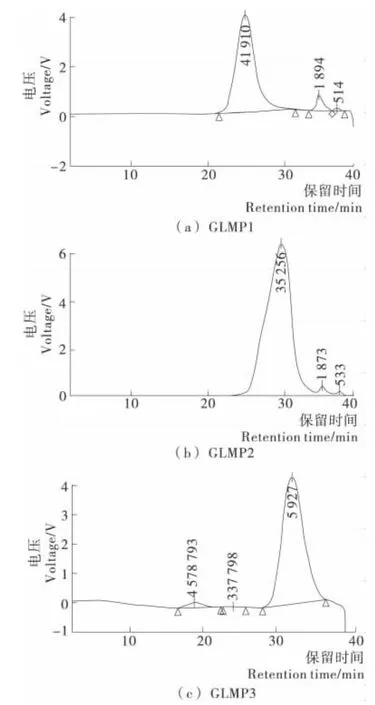
图2 GLMP1、GLMP2和GLMP3的HPSEC图谱Figure 2 HPSEC elution profile of GLMP1,GLMP2and GLMP3
根据HPSEC图中峰面积的百分比可知,3个级分多糖的纯度分别为93.58%,97.64%,99.19%,少量杂峰为分子量0.5×103Da左右的多糖小分子。同时,以不同分子量的葡聚糖标准品为标样,根据标样的保留时间和对应分子量做出分子量校正曲线,再由软件计算出级分多糖样品的相对重均分子量(Mw)见表1。

表1 3个级分多糖的相对重均分子量及纯度结果Table 1 The relative Mwand purity results of three polysaccharide fractions
2.3 单糖组成分析结果
12种单糖标样的PMP衍生化RP—HPLC色谱图见图3,在该色谱条件下12个单糖峰的分离效果较好。
GLMP1、GLMP2和GLMP3的单糖组成见图4~6,与图3中标准品的保留时间对照可知,GLMP1、GLMP2和GLMP3均含有甘露糖(Man)、鼠李糖(Rha)、半乳糖醛酸(GalUA)、葡萄糖(Glu)、半乳糖(Gal)、木糖(Xyl)、阿拉伯糖(Ara)和岩藻糖(Fuc)。Ferreira等[16]研究发现液体深层发酵灵芝多糖的单糖组成中Ara来自于发酵液多糖而非菌丝体多糖。
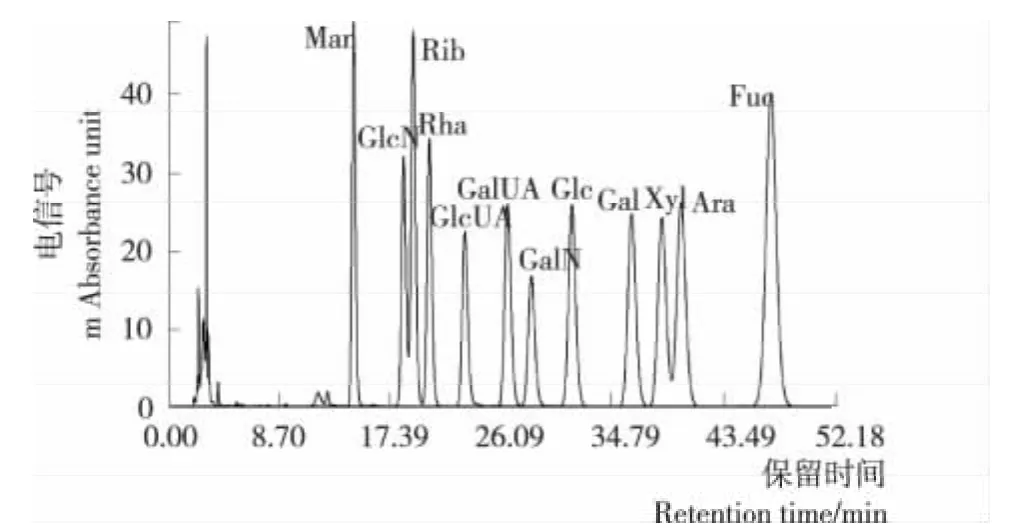
图3 12种单糖PMP衍生物的RP—HPLC图谱Figure 3 Chromatograms of PMP derivatives of twelve kinds of monosaccharides by RP—HPLC
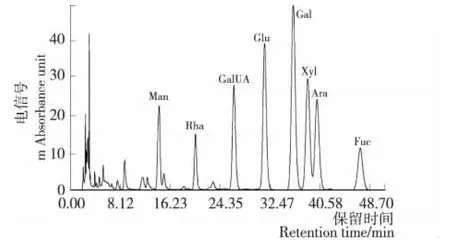
图4 GLMP1PMP柱前衍生化的RP—HPLC图谱Figure 4 RP—HPLC chromatograms of GLMP1by PMP derivatives
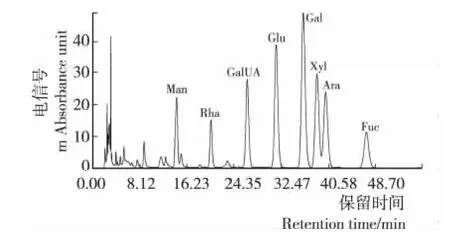
图5 GLMP2PMP柱前衍生化的RP—HPLC图谱Figure 5 RP—HPLC chromatograms of GLMP2by PMP derivatives
由表2可知,3个多糖级分均含有 Man、Rha、GalUA、Glu、Gal、Xyl、Ara和Fuc,但它们的单糖摩尔比差异较大。分子量最大的GLMP1中Xyl最多,其次是Gal、Ara和Fuc,前期研究[17]表明Xyl有助于提高多糖的抗氧化活性。GLMP2含Gal最多,其次是Xyl、Glc和Ara且这3种单糖含量接近,单糖组成分析中Gal含量较多的多糖可以显著地增强免疫活性[18]。分子量最小的GLMP3中Glc含量最多,其次是Gal,而其他6种单糖含量较少。分子量大的GLMP1和GLMP2中单糖组成种类更丰富,并且表征高生物活性的单糖含量更高。
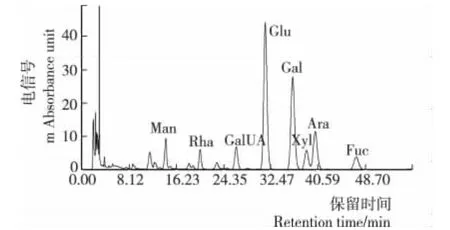
图6 GLMP3PMP柱前衍生化的RP—HPLC图谱Figure 6 RP—HPLC chromatograms of GLMP3by PMP derivatives

表2 3个级分多糖的单糖组成(摩尔比)Table 2 Monosaccharide composition of three polysaccharide fractions
2.4 多糖级分的液相色谱—多角度激光散射联用(SEC—MALLS)分析
通过示差折光(RI)检测器信号和光散射(90°)获得3个多糖级分的色谱图,见图7。SEC—MALLS经普适校正测定GLMP1、GLMP2和GLMP3的绝对重均分子量(Mw)分别为4.526×105,4.603×104,3.760×103g/mol,这与2.2中所测得的相对重均分子量有一定差异。HPSEC方法中,葡聚糖和多糖样品结构有一定的差异性,以葡聚糖为标样测得的相对重均分子量误差更大,不能准确表示级分多糖的分子量。SEC—MALLS直接测出多糖样品图谱中每个点的绝对分子量,无需进行任何色谱柱标定和标准品参考,测定结果更精确。
此外,分子量分布情况可由Mw/Mn的比值显示,当该值越大时,分子量分布就越宽即分散度就越大。对于窄的分子量分布,其Mw/Mn比值接近1[19]。由表3可知,3个多糖级分的Mw/Mn比值分 别为1.559,1.360,1.125,表 明GLMP1和GLMP2中度分散,而GLMP3分子量分布区间较窄。另外,ASTRA软件分析可获得样品的构象,即由分子旋转半径RMS与分子摩尔数之间的关系曲线可得,该关系曲线用α表示。Wyatt[19]认为当α值小于或等于0.33时大分子是一个紧密均匀的球形构象;而α值在0.2~0.4可以说明大分子为高支化的紧缩链构象;直线斜率在0.5~0.6,表明大分子是一个无规则线团构象。3个级分多糖的α值皆在0.3~0.4,表明 GLMP1、GLMP2和 GLMP3均为紧密且具有高度分枝结构的大分子聚合物,其中GLMP2可能是球形构象。
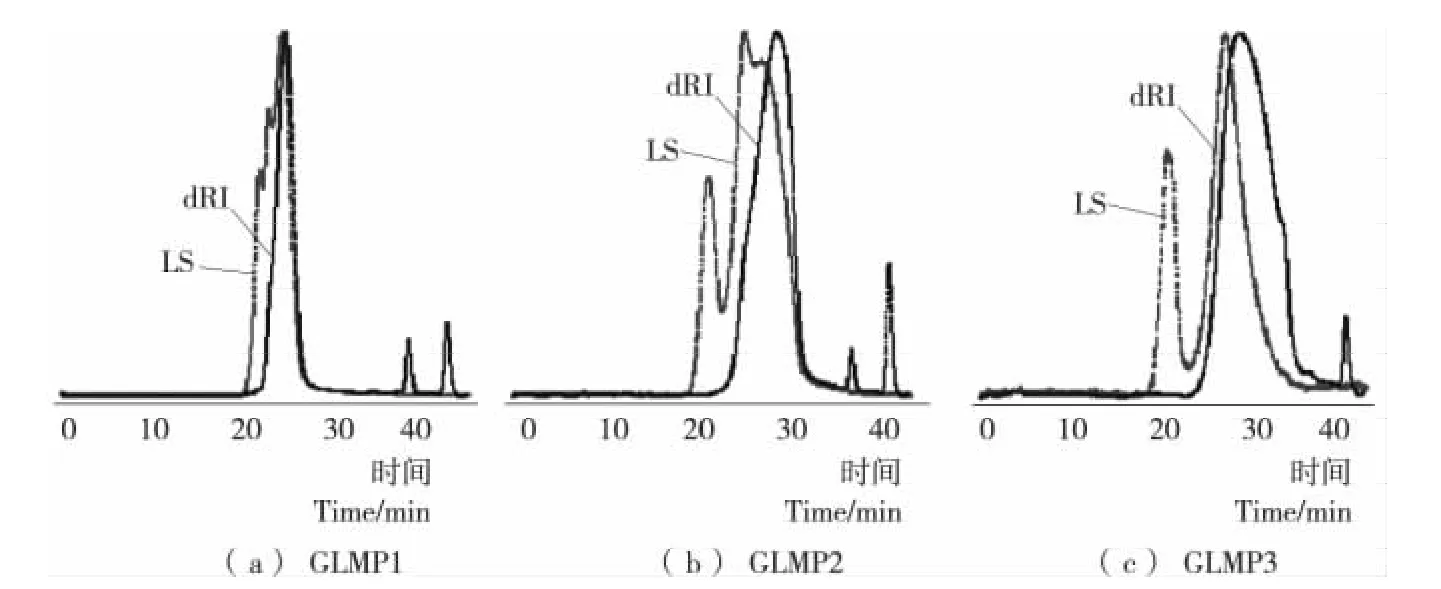
图7 级分多糖的光散射(LS)和RI检测器的色谱图Figure 7 Chromatograms obtained by SEC with LS and RI of three polysaccharide fractions

表3 SEC—MALLS—RI测定多糖级分的分子特性Table 3 Molecular characteristics of three polysaccharide fractions by SEC—MALLS—RI
3 结论
前期优化后的赤芝菌种经液体深层发酵,获得的灵芝菌丝体粗多糖经DEAE-Sepharose CL-6B分离纯化得到3个多糖级分GLMP1、GLMP2和GLMP3,HPSEC检测3个级分多糖纯度都较高,可视为均一的多糖级分。PMP衍生化RP—HPLC结果显示GLMP1、GLMP2和GLMP3均含有Man、Rha、GalUA、Glu、Gal、Xyl、Ara和 Fuc,与之前报道的灵芝菌丝体多糖的单糖组成略有差异[20],这可能跟灵芝菌种、培养条件等因素有关。采用SEC—MALLS—RI测试GLMP1、GLMP2和GLMP3的绝对重均分子量(Mw)分别为4.526×105,4.603×104,3.760×103g/mol,并且根据分子旋转半径与分子摩尔数的关系曲线斜率α可知,3个多糖级分构象可能均为高度紧缩且具有分支结构的聚合物。本研究为赤芝菌丝体多糖的构效关系研究提供结构基础,有利于该多糖的产品开发。
1 毛健,马海乐.灵芝多糖的研究进展[J].食品科学,2010,31(1):295~299.
2 Shi Min,Zhang Zhen-ya,Yang Ying-nan.Antioxidant and immunoregulatory activity of Ganoderma lucidum polysaccharide(GLP)[J].Carbohydrate Polymers,2013,95(1):200~206.
3 Jia Jie,Zhang Xi,Hu Yong-shan,et al.Evaluation of in vivo antioxidant activities of Ganoderma lucidum polysaccharides in STZ-diabetic rats[J].Food Chemistry,2009,115(1):32~36.
4 Yang Qian,Wang Si-wang,Xie Yan-hua,et al.HPLC analysis of Ganoderma lucidum polysaccharides and its effect on antioxidant enzymes activity and Bax,Bcl-2expression[J].International Journal of Biological Macromolecules,2010,46(2):167~172.
5 Seto S W,Lam T Y,Tam H L,et al.Novel hypoglycemic effects of Ganoderma lucidum water-extract in obese/diabetic(+db/+ db) mice[J].Phytomedicine,2009,16(5):426~436.
6 衣艳君,徐承水.灵芝降血脂作用的实验研究[J].安徽师范大学报,2001,24(1):52~53.
7 Peng Yan-fei,Zhang Li-na,Zeng Fan-bo,et al.Structure and antitumor activities of the water-soluble polysaccharides from Ganoderma tsugae mycelium[J].Carbohydrate Polymers,2005,59(3):385~392.
8 Boh B,Berovic M,Zhang Jing-song,et al.Ganoderma lucidum and its pharmaceutically active compounds[J].Biotechnology Annual Review,2007(13):265~301.
9 李云,曾东方.食用菌液体深层发酵的研究热点[J].食品工业科技,2006,27(7):198~201.
10 贺红.灵芝液体深层发酵技术研究进展及展望[J].基层中药杂志,2000,14(2):48~49.
11 Nie Shao-ping,Zhang Hui,Li Wen-juan,et al.Current development of polysaccharides from Ganoderma:Isolation,structure and bioactivities[J].Bioactive Carbohydrates and Dietary Fibre,2013,1(1):10~20.
12 毛健,马海乐.灵芝多糖的研究进展[J].食品科学,2010(1):295~299.
13 张惟杰 糖复合物生化研究技术[M].浙江:浙江大学出版社,1994:32,89,256.
14 孙小梅,戴军,陈尚卫,等.灵芝子实体多糖提取方法优化及不同来源赤芝子实体的多糖分子质量比较[J].食品与发酵工业,2014,40(7):212~217.
15 方积年.多糖的分离纯化及其纯度鉴别与分子量测定[J].药学通报,1984,19(10):46~49.
16 Ferreira I C F R,Heleno S A,Reis F S,et al.Chemical features of Ganoderma polysaccharides with antioxidant,antitumor and antimicrobial activities[J].Phytochemistry,2014,10(11):3~17.
17 Wang Jun-long,Guo Hong-yun,Zhang Ji,et al.Sulfated modification,characterization and structure antioxidant relationships of Artemisia sphaerocephala polysaccharides[J].Carbohydrate Polymers,2010,81(4):897~905.
18 Li Yan-qun,Fang Lu,Zhang Ke-chang.Structure and bioactivities of a galactose rich extracellular polysaccharide from submergedly cultured Ganoderma lucidum[J].Carbohydrate Polymers,2007,68(2):323~328.
19 Wyatt P J.Light scattering and the absolute characterization of macromolecules[J].Analytica chimica acta,1993,272(1):1~40.
20 罗立新,周少奇,姚汝华.灵芝多糖的结构分析[J].分析实验室,1998,17(4):17~21.
