醒酒玉米低聚肽的分离制备及其氨基酸序列分析
2015-12-20陈尚卫江南大学食品学院江苏无锡141江南大学食品学院食品科学与技术国家重点实验室江苏无锡141
马 伟 戴 军 陈尚卫 朱 松(1.江南大学食品学院,江苏 无锡 141;.江南大学食品学院食品科学与技术国家重点实验室,江苏 无锡 141)
玉米低聚肽是以玉米蛋白为主要原料,用酶解法(蛋白酶)生产的相对分子量小于1 000、主要成分为肽的粉末状物质[1],2010年经中华人民共和国国家卫生和计划生育委员会批准作为新资源食品开始使用。玉米低聚肽中富含丙氨酸、亮氨酸、谷氨酸和脯氨酸等[2],其特殊的氨基酸组成和连接方式赋予玉米肽多种生物活性,如促进酒精代谢[3]、保护酒精性/化学性肝损伤[4,5]、抗疲劳[6]、抗肿瘤[7]、抑制血管紧张素转换酶活性[8]等。
Yamaguchi等[1,3]首先用碱性蛋白酶水解玉米蛋白,得到了有生物活性的玉米肽,并发现其具有促进酒精代谢作用,并对其醒酒机理进行了初步研究。结果表明:玉米肽的醒酒作用源于它可以显著性提高血清中丙氨酸、亮氨酸的浓度,从而产生稳定的辅酶(NAD+),进而加速血液中乙醇在肝脏中的代谢。
目前,关于具有醒酒活性玉米低聚肽的报道多集中于玉米蛋白粉的酶解条件的优化,而关于其醒酒活性肽的氨基酸序列报道较少,仅 Ma Zhi-li等[9]给出了一种醒酒活性肽的氨基酸序列为 Q-L-L-P-F。为进一步研究醒酒活性肽的构效关系,进而为开发高醒酒活性玉米低聚肽产品提供理论依据,本研究将自制的玉米低聚肽产品经凝胶过滤色谱和反相色谱分离分级,以及醒酒活性筛选,获得醒酒活性较强的级分;该级分再经超高效液相色谱—四级杆—飞行时间串联质谱联用分析,以获得其氨基酸序列。
1 材料与方法
1.1 材料与仪器
1.1.1 试验原料
玉米蛋白粉(corn gluten meal,CGM):粗蛋白含量为62.87%,中食都庆(山东)生物技术有限公司。
1.1.2 试验动物
昆明种健康小白鼠,体重(25±2)g,雄性,苏州中医院研究所。
1.1.3 主要试剂
中温 α淀粉酶 BAN 480L:480KNU/g,丹麦 Novo公司;
Alcalase 2.4L:2.4AU/g,丹麦 Novo公司;
氧化型辅酶I(NAD+):上海国药集团;
乙醇脱氢酶ADH:310U/mg,美国Sigma公司;
SephadesG-15:葡聚糖凝胶,美国GE公司;
乙腈:色谱纯,美国Fisher公司;
甲酸:色谱纯,美国ROE公司;
乙醇、正丁醇:优级纯,国药集团化学试剂有限公司;
NaOH、Na2HPO4、NaH2PO4、KH2PO4、明胶、焦磷酸钠、盐酸、三氟乙酸、无水乙醇等:分析纯,国药集团化学试剂有限公司。
1.1.4 主要仪器设备
高速冷冻离心机:Avanti J-E型,美国Beckman公司;
双光紫外可见分光光度计:TU-1900型,北京普析通用仪器有限公司;
气相色谱仪:GC-2010型,日本岛津公司;
恒流泵:HL-2型,上海沪西分析仪器有限公司;
电脑全自动部分收集器:BSZ-100型,上海沪西分析仪器有限公司;
紫外检测器:HD-3型,上海沪西分析仪器有限公司;
色谱工作站:SEPU3000型,杭州普惠科学仪器有限公司;
冷冻干燥机:SCIENTZ-10N型,宁波新芝生物科技有限公司;
高效液相色谱仪:Waters 2545型,美国沃特公司;
超高效液相色谱—飞行时间质谱联用仪:Wates Acquity UPLC-Waters MALDI Synapt Q-TOF型,美国沃特公司。
1.2 方法
1.2.1 玉米低聚肽的制备 因原料中蛋白质含量不高,故先用中温淀粉酶对原料脱淀粉,然后以脱淀粉玉米蛋白粉为原料进行酶水解得到玉米粗肽液,再经过除杂和脱盐,最后进行低温喷雾干燥得到玉米低聚肽成品(COP)。玉米低聚肽的制备工艺流程:

1.2.2 玉米低聚肽的理化指标 按 QB/T 4707—2014执行。
1.2.3 体外醒酒活性——乙醇脱氢酶(ADH)活力的测定
参照文献[10]修改如下:取5mL小管,加入pH 8.8的焦磷酸钠缓冲液1.5mL,27mmol/L氧化型辅酶I(NAD+)1.0mL,体积分数为 11.5%的乙醇溶液 0.5mL,试样(0.1mg/mL COP溶液或超纯水)0.1mL,混匀后置于25℃水浴锅中温浴5min,之后向管中加入25℃温浴的ADH(0.25U/mL)0.1mL。混匀后立即测定其吸光度(A340nm)值,每隔10s读数一次,直至每分钟吸光度的增大值达到稳定为止。取最初线性部分计算每分钟还原型辅酶Ⅰ(NADH)的生成量,ADH的活力(U)以每分钟生成1μmol NADH时所需的酶量表示。ADH酶活按式(1)计算:

式中:
EADH——ADH酶活,U;
ΔA——340nm处每分钟吸光度的增加值;
3.2——反应液总体积,mL;
W——酶液中含酶量,mg/mL;
6.2——NADH在340nm处的摩尔吸光系数。
1.2.4 玉米低聚肽醒酒动物试验 醒酒动物试验及量效关系试验参照文献[11]。将昆明种雄性小鼠,饲养1周后随即分为5组,每组10只。5组分别为空白组(阴性对照)、模型组(阳性对照)、COP低剂量组(0.2mg/g·BW)、COP中剂量组(0.4mg/g·BW)、COP高剂量组(0.8mg/g·BW)。采用灌胃的方式给予COP,灌胃前禁食12h,空白组和模型组分别给予等体积的生理盐水。30min后除空白组外,其余4组均灌胃50%(V/V)乙醇0.012mL/g·BW,空白组则灌胃等体积的生理盐水,两次灌胃总体积不超过0.03mL/g·BW。1h后眼眶取血,将所取血样于37℃水浴恒温30min,立即以4 000r/min离心5min取血清,在血清中加入等体积的10%TCA和4μL/mL的正丁醇(内标物),再以4 000r/min离心5min,取上清液供测定血清中乙醇浓度用。
将上述处理好的血清样品用气相色谱法测定乙醇的浓度,色谱条件:检测器:FID,温度250℃;DB-23毛细管色谱柱:60m×320mm×25μm,柱温70℃;流量:氢气47mL/min,空气400mL/min,氮气1.5mL/min。
1.2.5 凝胶过滤色谱分离COP 色谱分离柱自装,填料为Sephadex G-15,柱尺寸:60cm×2.6cm;洗脱液:超纯水;洗脱流速:1.0mL/min;上样量:COP 15mL(30mg/mL);检测波长:220nm。结合SEPU3000色谱工作站给出的色谱图,每6min收集1管,按照分子量大小分为不同级分,将各级分经冷冻干燥后得到固形物,然后分别测定其体外醒酒活性,活性最强的级分用于后续进一步分离纯化。
1.2.6 制备型反相高效液相色谱分离纯化 将经冷冻干燥制得的1.2.5中活性最强的级分,用 Waters 2545制备型高效液相色谱(RP—HPLC)进一步分离纯化。色谱柱为 Waters xBridgeTMPrep C18(250mm×19mm,5μm);柱温为室温(20℃左右),进样量500μL,样品浓度50mg/mL,流动相流速10mL/min,紫外检测波长220nm;流动相:A为乙腈(0.05%TFA),B为超纯水(0.05%TFA);梯度洗脱条件:0~30min,5%A~20%A;30~50min,20%A~50%A;50~53min,50%A;53~55min,50%A~5%A;55~60min,5%A。将集分经冷冻干燥后得到固形物,分别测定其ADH激活率。ADH激活率按式(2)计算:

式中:
R——ADH激活率,%;
E加肽——玉米低聚肽组ADH酶活,U;
E空白——空白组ADH酶活,U。
1.2.7 UPLC—Q—TOF—MS分离分析 将1.2.6中体外醒酒活性最强的冻干组分,经UPLC—Q—TOF—MS进一步分离分析。
(1)液相条件:Wates Acquity UPLC超高效液相色谱仪,色谱柱为 Waters xBridgeTMBEH 130C18(150mm×2.1mm,1.7μm);柱 温 45 ℃,进 样 量 1μL,进 样 浓 度0.1mg/mL,流动相流速0.3mL/min,PDA检测器,流动相:A为乙腈,B为超纯水(0.1%甲酸);洗脱条件:0~1min,2%A;1~23min,2%A~40%A;23~25min,40%A~80%A;25~26min,80%A;26~30min,80%A~2%A。
(2)质谱条件:Waters MALDI Synapt Q—TOF,离子化方式ESI+;毛细管电压3.0kV;取样锥孔电压30V;离子源温度100℃;脱溶剂温度400℃;脱溶剂气流500L/h;锥孔气流50L/h;碰撞能量6/25V;倍增器电压1 800V。
1.2.8 统计学处理 采用SPSS软件,所有数据以平均值(3次重复)或者以平均值±标准差表示,组间经t检和方差分析对试验结果进行显著性分析。
2 结果与分析
2.1 玉米低聚肽的理化指标
由表1可知,通过比较可以发现自制玉米低聚肽的各项值均优于QB/T 4707—2014中的要求。

表1 玉米低聚肽理化指标Table 1 Physical and chemical indicators of corn oligopetides%
2.2 体外醒酒试验
经ADH活力测定,自制玉米低聚肽COP的体外醒酒活性——ADH激活率为(41.73±1.9)%,优于市售某玉米低聚肽的ADH激活率(35.69±1.4)%,说明自制的玉米低聚肽COP具有高效的体外醒酒活性。
2.3 玉米低聚肽醒酒动物试验
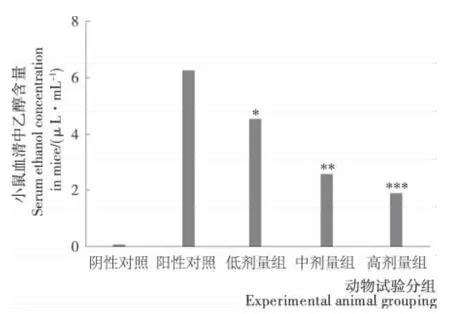
图1 不同剂量玉米低聚肽对小鼠血清中乙醇含量的影响Figure 1 Effect of corn peptides on serum ethanol concentration in mice
由图1可知,与阳性对照组比较,随着灌胃COP剂量的增加,小鼠血清中乙醇含量不断降低,当COP的剂量为0.2mg/g·BW时,小鼠血清中乙醇含量显著降低(P<0.05),当COP的剂量为0.4mg/g·BW时,小鼠血清中乙醇含量极显著降低(P<0.01),当COP的剂量为0.8mg/g·BW 时,血醇含量降低达到极显著水平(P<0.001),乙醇含量降低率达到70.02%。通过动物试验表明,COP在小鼠体内有高醒酒活性,同时不难发现玉米低聚肽的剂量与小鼠血清中乙醇含量的降低呈现明显的量效关系。
2.4 凝胶过滤色谱分离分级
凝胶过滤色谱(Sephadex G-15)分离COP的洗脱曲线见图2。按照分子量大小分为5个级分,分别定义为COPⅠ、COPⅡ、COPⅢ、COPⅣ、COPⅤ。5个级分中COPⅢ的体外醒酒活性最强,其ADH激活率为(37.82±1.7)%。多次收集COPⅢ,经旋转蒸发浓缩及冷冻干燥后得到固形物用于后续分离纯化。
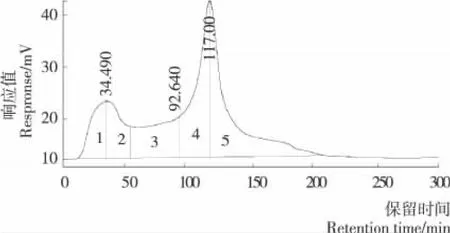
图2 Sephadex G-15分离COPFigure 2 Separation of COP by Sephadex G-15
2.5 制备型RP—HPLC分离分级
将经凝胶过滤色谱(Sephadex G-15)分离得到的活性较強级分COPⅢ进一步进行反相色谱分离,可分成如图3所示的21个级分。分别收集这21个级分,经旋转蒸发浓缩及冷冻干燥后测定其体外醒酒活性,结果见图4。
由图4可知,17号级分的体外醒酒活性最高,其ADH激活率为(45.73±2.3)%,组 分 14,15,16,19,20,21 的ADH激活率均超过25%~40%。17号级分用于下一步UPLC—Q—TOF—MS分析,以期得到其氨基酸序列。

图3 制备反相高效液相分离COPⅢ色谱图Figure 3 The chromatogram of COPⅢseparated by Preparative RP—HPLC
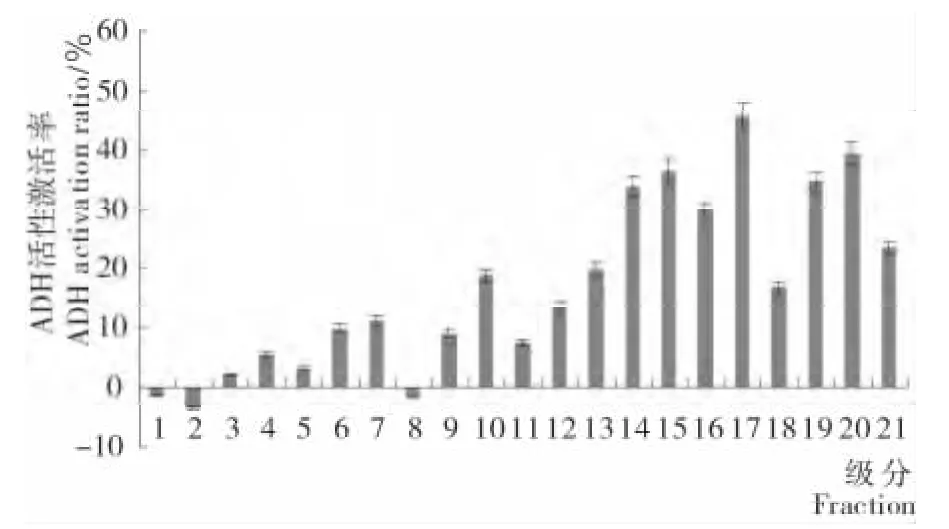
图4 反相高效液相分离组分的体外醒酒活性Figure 4 The antialcoholism activity in vitro of the fractions separated by RP—HPLC
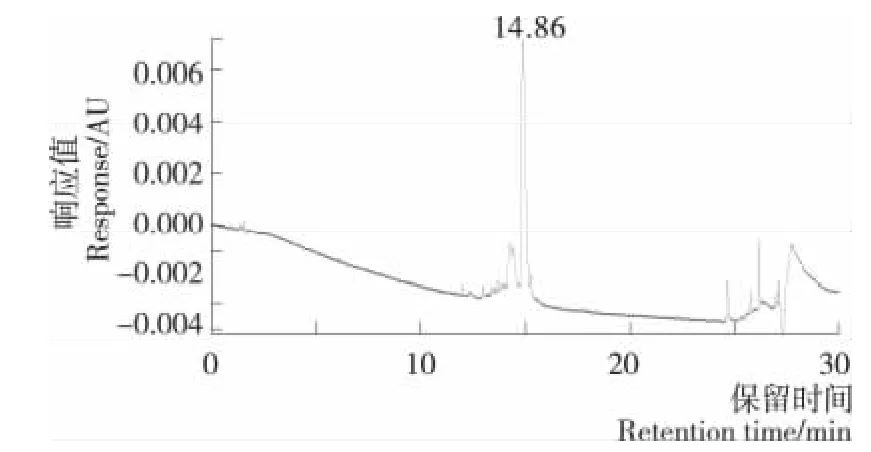
图5 COPⅢ-17级分的反相超高效液相色谱图Figure 5 The RP—UPLC profile of COPⅢ-17
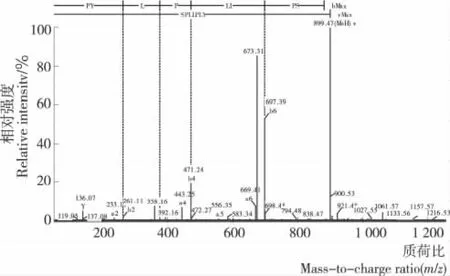
图6 COPⅢ-17主峰(RT=14.86)的 Q—TOF二级质谱图(m/z=899.5)Figure 6 MS/MS spectrum of the major component of COPⅢ-17
2.6 活性级分的氨基酸序列分析
将17号级分经UPLC—Q—TOF—MS分离分析,得到UPLC—UV图谱和其主成分(RT=14.86min)的Q—TOF二级质谱图,见图5、6。采用Biolynx软件对该主成分的碎片离子进行解析,得到其氨基酸序列为P-Y-L-P-L-L-P-S,断裂模式见图6。
3 结论
经体外ADH活性试验及动物试验表明,在本研究给出的水解条件下制得的玉米低聚肽产品COP具有较高的体内外醒酒活性,COP的剂量与小鼠血醇含量的降低呈现明显的剂量—效应关系。经UPLC—Q—TOF—MS分析,初步得到最强活性组分的分子量为899.5,其氨基酸序列为:P-Y-LP-L-L-P-S。本研究为进一步开发玉米蛋白资源及高醒酒活性玉米低聚肽产品提供了新的依据。
1 Yamaguchi M,Takada M,Nozaki O,et al.Preparation of cornpeptide from corn gluten meal and its administration effect on alcohol metabolism in stroke-prone spontaneously hypertensive rats[J].Journal of Nutritional Science and Vitaminology,1996,42(3):219~231.
2 Yamaguchi M,Takeuchi M,Ebihara K.Inhibitory effect of peptide prepared from corn gluten meal on 7,12-dimethylbenz[a]anthracene-induced mammary tumor progression in rats[J].Nutrition Research,1997,17(7):1 121~1 130.
3 Yamaguchi M,Nishikiori F,Ito M,et al.The effects of corn peptide ingestion on facilitating alcohol metabolism in healthy men[J].Bioscience,Biotechnology and Biochemistry,1997,61(9):1 474~1 481.
4 Zhang Feng,Zhang Jia-li,Li Yong.Corn oligopeptides protect against early alcoholic liver injury in rats[J].Food and Chemical Toxicology,2012,50(6):2 149~2 154.
5 Yu Guo-cai,Lv Jie,He Hui,et al.Hepatoprotective effects of corn peptides against carbon tetrachloride-induced liver injury in mice[J].Journal of Food Biochemistry,2012,36(4):458~464.
6 李晶.玉米肽抗疲劳作用的实验研究[J].食品与机械,2004,20(1):11~12.
7 Li Jiang-tao,Zhang Jiu-liang,He Hui,et al.Apoptosis in human hepatoma HepG2cells induced by corn peptides and its antitumor efficacy in H22tumor bearing mice[J].Food and Chemical Toxicology,2013(51):297~305.
8 Yang Yan-jun,Tao Guan-jun,Liu Ping,et al.Peptide with anglotensin I-Converting enzyme inhibitory activity from hydrolyzed corn gluten meal[J].Journal of Agricultural and Food Chemistry,2007,55(19):7 891~7 895.
9 Ma Zhi-li,Zhang Wen-jun,Yu Guo-cai,et al.The primary structure identification of a corn peptide facilitating alcohol metabolism by HPLC—MS/MS[J].Peptides,2012,37(1):138~143.
10 Madhusudhan M C,Raghavarao K S M S,Sanjay Nene.Integrated process for extraction and purification of alcohol dehydrogenase from Baker s yeast involving precipitation and aqueous two phase extraction[J].Biochemical Engineering Journal,2008,38(3):414~420.
11 隋玉杰.玉米肽的制备条件及其醒酒护肝机理研究[D].武汉:华中农业大学,2006.
