佛手瓜果实发育过程中的品质变化
2015-12-20杜小琴四川农业大学食品学院四川雅安6504成都市农林科学院农产品研究所四川成都630
李 玉 秦 文 杜小琴 刘 继(.四川农业大学食品学院,四川 雅安 6504;.成都市农林科学院农产品研究所,四川 成都 630)
佛手瓜(Sechium edule)为葫芦科佛手瓜属多年生攀缘草本植物[1],其果实嫩脆多汁,具有低脂、低热量和丰富的矿物质元素、氨基酸和维生素等特点[2],是一种深受人们喜爱的保健蔬菜。四川省荥经县有机蔬菜种植基地培育的绿皮无刺佛手瓜,具有生长快、产量高、色泽鲜艳、营养价值高等特点。在雨水充足、气候适宜的四川盆地,佛手瓜生长迅速,一般在花后14d果实就已经开始出现颜色泛黄、质地坚硬老化的现象,此时期的果实已不适于采收贮藏和鲜食。不同生长期的果实品质特性存在差异,采收期是影响佛手瓜贮藏和货架期间果实品质的重要因素,瓜农一般根据种植经验和市场的需求确定果实的采收期,采收时期具有不规范性和盲目性,缺乏科学依据,直接影响了果实的品质和耐贮性。
目前,国内外学者对佛手瓜的研究颇多,研究内容主要集中在佛手瓜的高产栽培技术[3]、营养成分分析[4]和有益因子的提取[5]方面,而对果实在生长发育过程中品质变化规律的研究却鲜有报道。叶陈亮等[6]研究了佛手瓜果实的生长进程及生理生化变化,得出嫩瓜具有较高的营养价值和食用品质,同时提出了食用瓜采收的最适时期。为进一步探讨佛手瓜发育过程中的品质变化,增加佛手瓜果实成熟生理的理论基础,确定佛手瓜的最佳采收期,本试验拟以花后第2~14天的佛手瓜果实为试材,对不同发育期果实中的相关品质指标进行测定,并对其变化规律进行分析总结,以期为佛手瓜的品质育种及适时采收提供一定理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
佛手瓜:于2014年8月20日10:00~11:00采自四川省荥经县港森农业有限公司有机蔬菜种植基地;
浓盐酸:优级纯,四川西陇化工有限公司;
茚三酮、氢氧化钠、柠檬酸钠等:优级纯,上海国药集团化学试剂有限公司;
氢氧化钠、氯化钡、乙醇、丙酮、三氯乙酸、2,6-二氯酚靛酚、抗坏血酸等:分析纯,成都市科龙化工试剂厂;
蒽酮:分析纯,天津市科密欧化学试剂有限公司。
1.1.2 主要仪器设备
全自动氨基酸分析仪:L-8900型,日本日立公司;
电子天平:BS210S型,赛多利斯北京天平有限公司;
质构仪:TA.XT Plus型,英国SMS公司;
纵观古今,不少人用其一生来诠释“意义”。鲁迅高呼“无穷的远方,无数的人们,都和我有关”,将自己之生,系于他人之生;诺尔曼·白求恩断然告别了在加拿大的优渥生活,于救死扶伤中体现自己的价值;阿尔贝特·施韦泽在非洲的土地上坚韧前行,以一个个脚印向世间询问来此的意义,成就生命之惊鸿。
高速冷冻离心机:Heraeus Multifuge X3R型,美国Thermo公司;
紫外/可见分光光度计:UV-3000型,上海美谱达仪器有限公司;
氮吹仪:MTN-2800D,北京华瑞博远科技发展有限公司;
电热恒温水浴锅:HWS24型,上海一恒科技有限公司;
电热恒温鼓风干燥箱:DHG-9245A型,上海一恒科技有限公司。
1.2 方法
1.2.1 水分含量的测定 按GB 50093—2012《食品中水分的测定》执行。
1.2.2 硬度的测定 采用质构仪测定,选择P/5探头(直径5mm),测前、测中、测后上行速度均为3mm/s,深度10mm,测定部位为果实的头部、中部和尾部。
1.2.3 纤维素含量的测定 根据文献[7]。
1.2.4 叶绿素、Vc含量、呼吸强度的测定 根据文献[8]。
1.2.5 氨基酸含量的测定 按 GB/T 5009.124—2003《食品中氨基酸的测定》执行。
1.2.6 数据处理 所有测定平行3次,取平均值。各指标数据均使用SPSS 19.0软件进行差异性显著分析和相关性分析,利用Origin 8.0软件进行绘图。
2 结果与分析
2.1 果实生长进程与呼吸强度的变化
以花后果实的生长时间和果实鲜重作图,以平均单果鲜重表示佛手瓜果实的生长进程,该果实的生长过程呈S型生长大周期。由图1可知,佛手瓜果实在花后前4d生长缓慢,此后开始迅速生长,且全程只有一个迅速生长期,在第10天后进入缓慢生长期,总体呈慢—快—慢的单S型生长曲线,该生长特点与苹果、梨、茄子等果实的生长曲线相似[9]。呼吸作用是生命活动的基本特征,果实在生长发育的不同阶段呼吸代谢强度及其变化特点不同。果实在花后第4天呼吸速率高达39.49mg/(kg·h),此后快速下降,在第8天达到最低值6.28mg/(kg·h)。这是由于在细胞快速分裂的幼果期,果实呼吸速率很高,当细胞分裂逐渐停止,果实体积增大时呼吸速率开始下降。果实进入成熟期后,呼吸速率再次升高,花后第12天果实出现呼吸高峰(11.73mg/(kg·h))。佛手瓜果实呼吸速率的这一变化趋势与跃变型果实的呼吸变化曲线相似,而叶陈亮等[6]研究得出佛手瓜为非呼吸跃变型果实,该问题还有待于进一步探究。
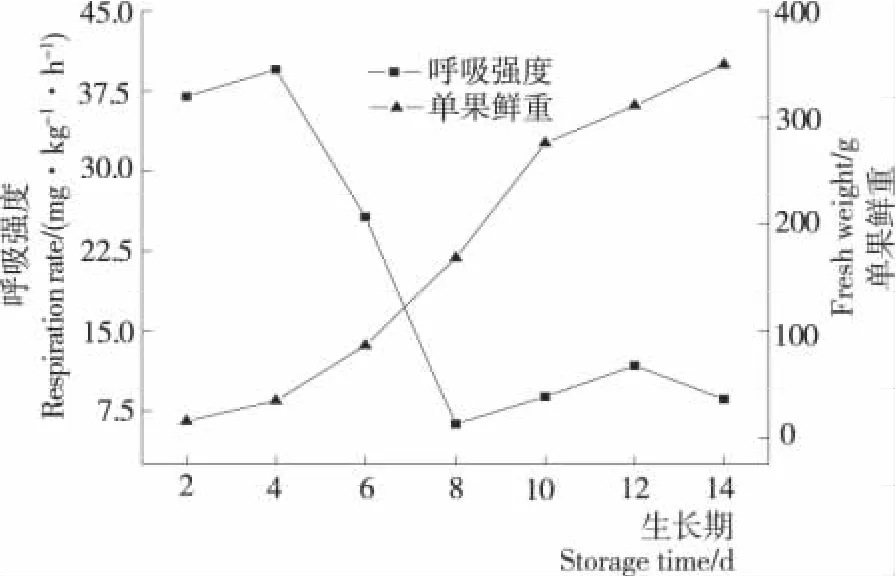
图1 不同生长期果实的生长和呼吸速率变化Figure 1 Variations of growth and respiration rate at different growth periods of chayote
2.2 果实生长发育过程中Vc和叶绿素含量的变化
Vc又称抗坏血酸,既是果实的营养物质又是果实组织内的还原剂。佛手瓜含有多种维生素,其中Vc含量最高[4],它的含量变化反映了果实组织内的生理动态,在不同的生长期Vc含量随之发生相应变化。由图2可知,果实在花后2~4d的幼果期Vc含量相对较高,果实进入膨大期后,体积快速增大,Vc含量随之下降。第14天果实Vc含量降至2.69mg/100g,仅为初始值的26.27%。有研究[10]表明,Vc和抗坏血酸氧化酶(AO)与细胞膨大和分裂有着紧密的关系。在果实膨大期,AO活性增强,将Vc氧化成单脱氢抗坏血酸;此外,果实迅速生长期消耗的大量葡萄糖会造成Vc合成前体缺乏[11]以致Vc合成量下降,以上两点可能是果实生长发育阶段Vc含量不断减少的主要原因。叶绿素是植物叶绿体内参与光合作用的重要色素,对植物的生长及农作物产量的形成具有极其重要的作用[12]。有些果实保持绿色是果实鲜度和健壮的标志,失去绿色或变黄是成熟衰老的标志。图2显示,佛手瓜果实在花后前6d叶绿素含量相对较高,果实颜色青亮鲜艳,此后随着果实的快速生长开始减少,但在第12天之前果皮颜色没有明显的变化。这可能是因为在果实膨大期果实体积增大较快,白色瓜肉相对较多,导致叶绿素测定结果不断减小。在花后第14天,叶绿素含量为1.53mg/kg,与初始值相比下降了85.21%,此时期果皮泛黄,说明果实已进入成熟期,叶绿素的合成停止,原有的叶绿素开始减少,瓜皮绿色消退。
2.3 果实生长发育过程中水分、硬度和纤维素含量的变化

图2 不同生长期佛手瓜Vc和叶绿素含量的变化Figure 2 Changes in Vc content and chlorophyll content at different growth stages of chayote
水分是植物的主要构成成分,在植物的生命活动中具有十分重要的意义。植物细胞的分裂和伸长都必须在水分充足的条件下才能进行,只是细胞伸长对缺水更为敏感[9]。由表1可知,佛手瓜果实在花后第2天的水分含量为93.736%,此后随着细胞的分裂和伸长,果实含水量不断增加,在第8天达到95.064%,与其他生长期果实含水量相比差异显著(P≤0.05)。生长末期,果实含水量降低至91.734%,这与果实生长后期生长速率下降、新陈代谢速度减缓有关,可见不同生长发育期,果实的含水量不同。
硬度作为反映果实生长发育过程中品质变化的重要指标,它的大小取决于果实的组织结构和化学成分。由表1可知,果实在花后整个生长期间硬度呈上升趋势。在花后的前8d,果实硬度变化不明显(P>0.05),之后随着果实生长硬度开始逐渐增大。在花后第10天,果实硬度高达17.997kg/cm2,是初始值的1.55倍,与其他各组数据差异显著(P≤0.05);4d之后果实硬度上升了60.38%,高达28.863kg/cm2,与其他生长期果实硬度相比差异性达到显著水平(P≤0.05)。由于硬度是人们日常选购佛手瓜的重要品质指标,适当大小的硬度会增加果实的耐贮性,但硬度过大会造成不易烹饪、口感粗糙等问题,果实的商品性和食用性严重下降,故佛手瓜果实不适于在花后10d之后再进行采收。
纤维素是影响果蔬质地与食用品质的重要物质,是构成植物细胞壁的主要成分,同时也是维持人体健康不可缺少的辅助成分。表1显示,果实花后初期纤维素含量较低,此时的果实中纤维素多为水合纤维素,果实组织质地柔软、脆嫩。此后随着果实逐渐生长纤维素含量不断增加,在第6天达到1.730%,为初始值的1.55倍。这可能是因为处于细胞快速分裂期的果实需要合成大量的纤维素来作为细胞壁的骨架成分。在果实细胞膨大期,纤维素含量保持相对平稳状态,在第14天上升至1.878%,与其他生长期果实纤维素含量相比差异显著(P≤0.05),表明衰老期的果实中纤维素与半纤维素、木质素、角质、栓质等形成了复合纤维素,果实组织老化变得粗糙坚硬、食用品质下降[13]。
2.4 果实发育过程中氨基酸含量的动态变化分析
2.4.1 氨基酸总量的变化规律 天然食物蛋白质中的氨基酸有20多种,不仅提供机体合成蛋白质的重要原料,还为促进机体生长、进行正常代谢和维持生命活动提供了物质基础。其中20种氨基酸是组成蛋白质的基本单位,按营养功能划分,8种为必需氨基酸,12种为非必需氨基酸[14]。由表2可知,佛手瓜果实中氨基酸丰富,至少含有17种氨基酸(色氨酸在酸水解过程中遭到破坏,未检出)。花后第2天的果实氨基酸总量高达811.451mg/100g,与其他生长期果实相比差异性达到极显著水平(P≤0.01),其中谷氨酸的含量最高,其次是天冬氨酸。随着果实的不断生长发育,果肉中氨基酸总量呈缓慢的下降趋势,到花后的第10天,其含量水平下降了13.37%,但高于相同成熟度的火龙果、苹果、甜橙等水果的总氨基酸含量[15]。在果实发育至花后第14天,其总氨基酸含量已降至431.678mg/100g,表明果实在成熟衰老进程中其总氨基酸含量水平呈不断下降趋势,这与Zhang Yan-zi等[16]研究的‘哈尼脆’苹果在生长发育过程中的氨基酸含量变化趋势一致,师江等[17]也研究发现油茶籽仁中氨基酸总量随着采摘时间的推迟有降低的趋势。值得注意的是,在果实生长到花后第6~10天,果实中的精氨酸含量跃升至最高,此后开始大幅下降;Somkuwar等[18]也发现无籽葡萄在快速生长期精氨酸含量会达到最大值,到成熟采收期时开始急剧下降。有研究[19]表明,精氨酸会随着植物生长发育进程而变化,它可在精氨酸脱羧酶(ADC)的催化下形成多胺(PA),通过多胺诱导调节植物细胞分裂与果实发育。
表1 不同生长期佛手瓜果实3个品质指标变化Table 1 Changes of three quality indexes of chayot in different growth stages

表1 不同生长期佛手瓜果实3个品质指标变化Table 1 Changes of three quality indexes of chayot in different growth stages
同列小写字母不同表示差异显著(P≤0.05)。
生长期/d测定指标水分含量/% 硬度/(kg·cm-2) 纤维素含量/%2 93.736±0.302b 11.606±0.701cd 1.113±0.153c 4 93.665±0.025b 11.443±0.261c 1.583±0.156ab 6 94.240±0.015ab 12.287±0.618cd 1.730±0.163ab 8 95.064±0.232a13.655±0.497c 1.587±0.066ab 10 94.186±0.030ab 17.997±0.709b 1.409±0.072bc 12 93.904±0.263b 17.716±0.546b 1.501±0.067ab 14 91.734±0.719c 28.863±1.082a1.878±0.073a
2.4.2 必需氨基酸的组成分析 食品中必需氨基酸含量的多少是评价食品蛋白质营养价值的重要指标。如果必需氨基酸摄入不足,其它氨基酸就不可能被充分吸收利用,从而降低了总蛋白质的生物价,因此蛋白质中必需氨基酸的含量越高,其营养价值越大[4]。在佛手瓜果实中检测出以下7种人体必需氨基酸:Thr、Val、Phe、Met、Ile、Leu、Lys。由表2可知,佛手瓜果实随生长期的延长其EAA(必需氨基酸含量)整体呈下降趋势,在花后第14天,果实EAA降为初始值的55.04%,这与 Li Wei-qin等[20]研究的山楂果在生长发育过程中的必需氨基酸的含量变化趋势一致。经计算,各生长期果实E/T(必需氨基酸占氨基酸总量的百分比)值为37.506%~42.778%时,E/N(必需氨基酸含量与非必需氨基酸含量之比)值为0.601~0.748,均高于不同生长期米邦塔仙人掌中的 E/T 值(34%~36%)和 E/N 值(0.50~0.55)[21]。1973年FAO/WHO联合专家委员会提出的理想蛋白质的标准是E/T在40%左右,E/N在0.60以上[22],因此佛手瓜果实中的蛋白质符合理想蛋白质的标准,可见佛手瓜是一种理想的优质植物蛋白来源。此外,不同生长期果实中的赖氨酸一直保持着相对较高的含量水平,经常食用佛手瓜可弥补米、面、玉米等主食中缺少的赖氨酸。除8种人体必需氨基酸外,儿童生长还需有精氨酸和组氨酸。表2显示,果实中CE/T(儿童必需氨基酸含量占氨基酸总量的百分比)值随果实的生长发育呈先上升后下降的趋势。在果实的快速生长的第6~10天,CE/T值相对较高(15.875%~17.392%),是李果实的3~6倍[22],此时期的佛手瓜可作为儿童的理想食品。
表2 佛手瓜中水解氨基酸的含量Table 2 Content of hydrolysis amino acids in chayote mg/100g
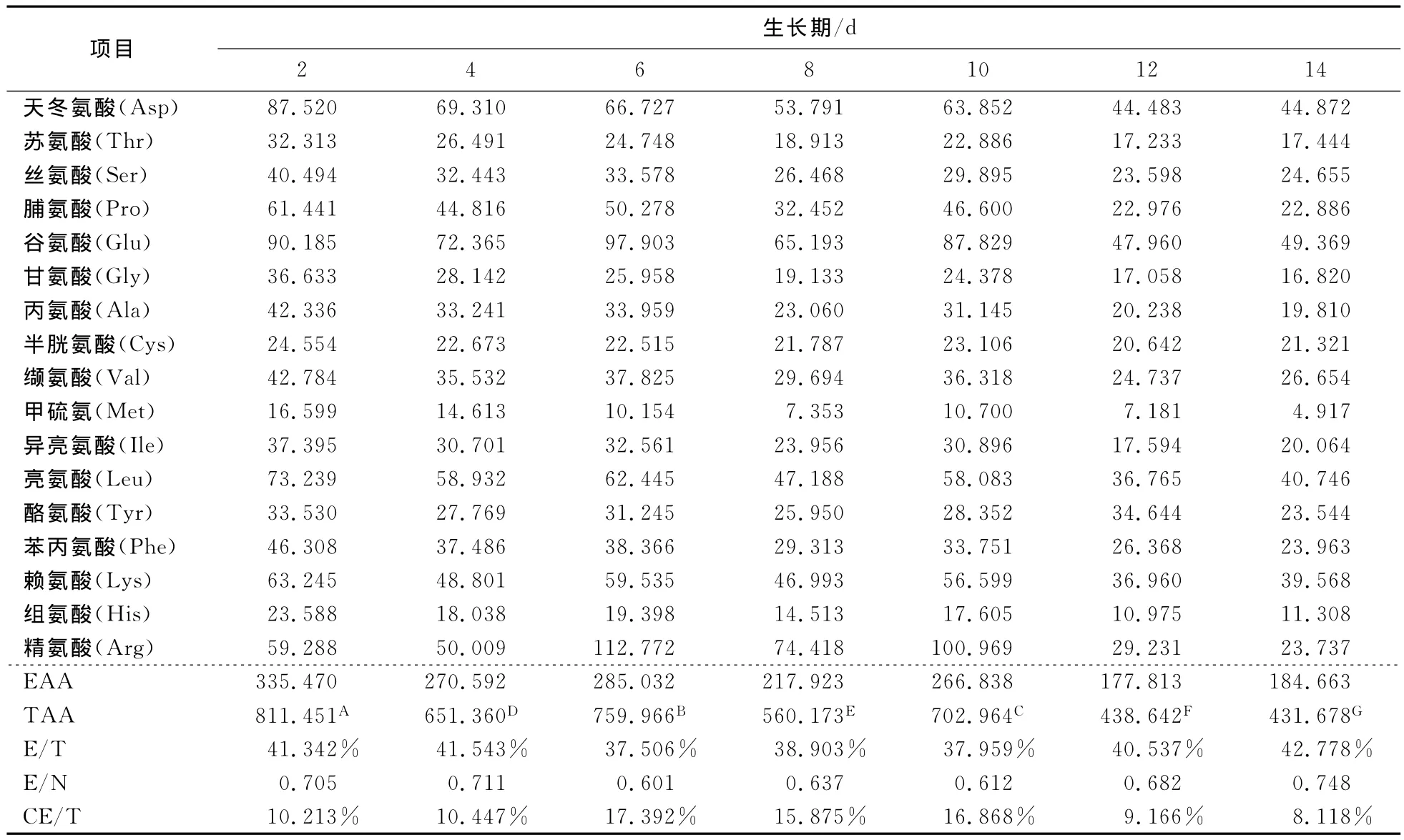
表2 佛手瓜中水解氨基酸的含量Table 2 Content of hydrolysis amino acids in chayote mg/100g
同行大写字母不同表示组间差异极显著(P≤0.01);EAA表示必需氨基酸含量;TAA表示氨基酸总量;E/T表示必需氨基酸占氨基酸总量的百分比;E/N表示必需氨基酸含量与非必需氨基酸含量之比;CE/T表示儿童必需氨基酸含量占氨基酸总量的百分比。
项目生长期/d 2 4 6 8 10 12 14天冬氨酸(Asp) 87.520 69.310 66.727 53.791 63.852 44.483 44. 872苏氨酸(Thr) 32.313 26.491 24.748 18.913 22.886 17.233 17.444丝氨酸(Ser) 40.494 32.443 33.578 26.468 29.895 23.598 24.655脯氨酸(Pro) 61.441 44.816 50.278 32.452 46.600 22.976 22.886谷氨酸(Glu) 90.185 72.365 97.903 65.193 87.829 47.960 49.369甘氨酸(Gly) 36.633 28.142 25.958 19.133 24.378 17.058 16.820丙氨酸(Ala) 42.336 33.241 33.959 23.060 31.145 20.238 19.810半胱氨酸(Cys) 24.554 22.673 22.515 21.787 23.106 20.642 21.321缬氨酸(Val) 42.784 35.532 37.825 29.694 36.318 24.737 26.654甲硫氨(Met) 16.599 14.613 10.154 7.353 10.700 7.181 4.917异亮氨酸(Ile) 37.395 30.701 32.561 23.956 30.896 17.594 20.064亮氨酸(Leu) 73.239 58.932 62.445 47.188 58.083 36.765 40.746酪氨酸(Tyr) 33.530 27.769 31.245 25.950 28.352 34.644 23.544苯丙氨酸(Phe) 46.308 37.486 38.366 29.313 33.751 26.368 23.963赖氨酸(Lys) 63.245 48.801 59.535 46.993 56.599 36.960 39.568组氨酸(His) 23.588 18.038 19.398 14.513 17.605 10.975 11.308精氨酸(Arg) 59.288 50.009 112.772 74.418 100.969 29.231 23.737 EAA 335.470 270.592 285.032 217.923 266.838 177.813 184.663 TAA 811.451A 651.360D 759.966B 560.173E 702.964C 438.642F 431.678G E/T 41.342% 41.543% 37.506% 38.903% 37.959% 40.537% 42.778%E/N 0.705 0.711 0.601 0.637 0.612 0.682 0.748 CE/T 10.213% 10.447% 17.392% 15.875% 16.868% 9.166% 8.118%
2.5 果实品质指标间相关性分析
果实在生长发育过程中时刻都在进行复杂的新陈代谢和生理生化的变化。试验测定的各项品质指标在果实发育过程中均呈现不同的变化趋势,且有些相互之间具有一定相关性。由表3可知,果实的呼吸强度、Vc含量与果实鲜重之间存在显著的负相关关系(P≤0.05),相关系数分别为-0.776与-0.865。说明随着果实重量的增加,果实呼吸强度、Vc含量呈随之减小的趋势。此外,果实叶绿素含量、硬度与果实鲜重的相关系数分别为-0.980与0.880,说明果实在走向成熟衰老过程中,叶绿素降解严重而果实硬度上升幅度较大,二者呈显著的负相关性(r=-0.835,P≤0.05)。同时,果实呼吸强度、叶绿素与Vc含量存在极显著的正相关关系(P≤0.01),相关系数高达0.937和0.901。这可能是由于幼果期的果实呼吸旺盛,新陈代谢快,果实抗氧化能力强,Vc、叶绿素含量较高,但各项品质变化均随着果实的逐渐成熟而减弱。
由果实水分含量与硬度的相关性(r=-0.773,P≤0.05)和纤维素含量与硬度的相关性(r= 0.863,P≤0.05)可知,随着果实的生长发育,果实中水分含量逐渐减少而纤维素含量随之增加,导致了果实硬度在生长后期的急剧增大。相关性分析显示,氨基酸含量与果实鲜重呈显著的负相关性(r= -0.832,P≤0.05),与叶绿素含量存在显著的正相关关系(r=0.851,P≤0.05),这可能是因为在植物体内叶绿素是和叶绿素结合蛋白一起结合在内囊体膜上,随着果实走向成熟衰老,果实中自由基含量水平越来越高,叶绿素与叶绿素结合蛋白开始被降解,果实中叶绿素和氨基酸含量也随之下降[23]。
表3 品质指标间相关性分析表Table 3 Correlation analysis among different quality indexes
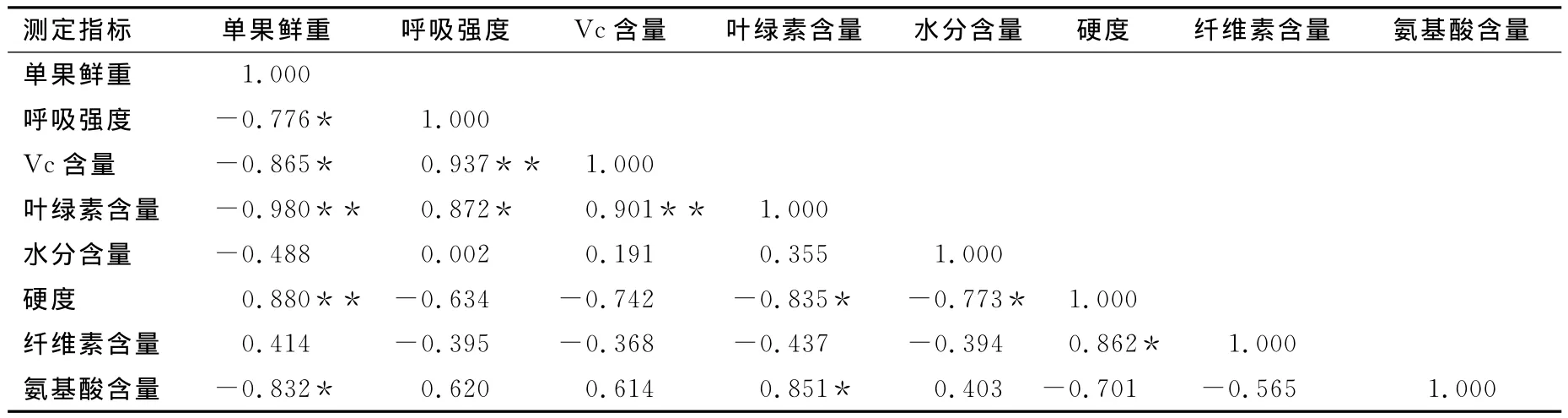
表3 品质指标间相关性分析表Table 3 Correlation analysis among different quality indexes
*表示在P≤0.05水平上显著相关;**表示在P≤0.01水平上显著相关。
测定指标 单果鲜重 呼吸强度 Vc 1.000呼吸强度 -0.776* 1.000 Vc含量 -0.865* 0.937** 1.000叶绿素含量 -0.980** 0.872* 0.901** 1.000水分含量 -0.488 0.002 0.191 0.355 1.000硬度 0.880** -0.634 -0.742 -0.835* -0.773* 1.000纤维素含量 0.414 -0.395 -0.368 -0.437 -0.394 0.862* 1.000氨基酸含量 -0.832* 0.620 0.614 0.851*含量 叶绿素含量 水分含量 硬度 纤维素含量 氨基酸含量单果鲜重0.403 -0.701 -0.565 1.000
3 结论
掌握果实的生长动态和品质变化规律是制定优质高产培育措施和确定最佳采收期的理论依据。试验结果表明,佛手瓜果实发育呈慢—快—慢的单S型生长曲线,花后第6~10天为佛手瓜果实的快速生长期,该时期细胞呼吸代谢旺盛,营养物质消耗快,需水肥多,生产中应抓住这个关键时期,加强水肥管理,以期达到优产、丰产的目的。硬度是佛手瓜重要的外观品质指标,二者显著的负相关性不利于果实的长期生长,严重地影响了佛手瓜的销售和食用情况。Vc和氨基酸是佛手瓜主要的营养指标,果实氨基酸总量在第10天后开始急剧下降,极大地降低了果实营养价值;同时,生长至第10天的佛手瓜重量和体积已经相对较大,继续生长会造成枝蔓负载过重,影响后茬果实的生长发育。故从品质和产量两方面来看,佛手瓜的最佳采摘期应控制在花后第10天之前。但从贮藏特性和经济角度考虑,若佛手瓜采摘过早,则果实含水量较高、皮嫩易破、呼吸代谢旺盛,导致果实耐贮性差;而且果实没有充分生长,重量和体积相对较小,经济价值较低,不利于农户长期种植。综合以上各种因素,佛手瓜的最适采收期应为花后第10天,此时的佛手瓜已经具有成熟果的商品价值。
1 张福平,张喜春.佛手瓜多酚氧化酶酶学特性研究[J].食品科学,2010,31(1):161~164.
2 Cadena-I Iguez J,Arévalo-Galarza L,Ruiz-Posadas L M,et al.Quality evaluation and influence of 1-MCP onSechium edule(Jacq.)Sw.fruit during postharvest[J].Postharvest Biology and Technology,2006,40(2):170~176.
3 黄建伟.佛手瓜高产栽培技术[J].安徽农学通报,2013,19(14):57~58.
4 张奇志,邓欢英,林丹琼,等.佛手瓜果实的营养保健成分研究[J].中国食物与营养,2007(7):45~47.
5 Ordoňez A A L,Gomez J D,Vattuone M A,et al.Antioxidant activities ofSechium edule(Jacq.)Swartz extracts[J].Food Chemistry,2006,97(3):452~458.
6 叶陈亮,黄碧琦.佛手瓜果实的生长进程及生理生化变化[J].福建农学院学报,1993,22(3):356~360.
7 王晶英.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003:16~18.
8 曹建康.果蔬采后生理生化实验指导[M].北京:中国轻工业,2007:32~48.
9 李合生.现代植物生理学[M].北京:高等教育出版社,2006:31~40.
10 Ashino H,Shimamura M,Nakajima H,et al.Novel function of ascorbic acid as an angiostatic factor[J].Angiogenesis,2003,6(4):259~269.
11 常尚连,于贤昌,于喜艳.西瓜果实发育过程中糖分积累与相关酶活性的变化[J].西北农业学报,2006,15(3):138~141.
12 王平荣,张帆涛,高家旭,等.高等植物叶绿素生物合成的研究进展[J].西北植物学报,2009,29(3):629~636.
13 赵丽芹,张子德.园艺产品贮藏加工学[M].北京:中国轻工业出版社,2014:14~16.
14 蒋滢.氨基酸的应用[M].北京:世界图书出版公司,1996:17~21.
15 王彬.火龙果果实发育规律及果实品质分析[D].长沙:湖南农业大学,2008.
16 Zhang Yan-zi,Li Peng-min,Cheng Lai-liang.Developmental changes of carbohydrates,organic acids,amino acids,andphenolic compounds in‘Honeycrisp’apple flesh[J].Food Chemistry,2010,123:1 013~1 018.
17 师江,刘兴勇.基于营养成分的变化确定油茶最佳采摘期[J].食品与机械,2014,30(1):71~74.
18 Somkuwar R G,Bahetwar A,Khan I,et al.Changes in growth,photosynthetic activities,biochemical parameters and amino acid profile of Thompson Seedless grapes(Vitis viniferaL.)[J].Journal of Envi,2014,35(6):1 157~1 163.
19 Kalac P,KrausováP.A review of dietary polyamines:Formation,implications for growth and health and occurrence in foods[J].Food Chemistry,2005,90(1~2):219~230.
20 Li Wei-qin,Hu Qing-ping,Xu Jian-guo.Changes in physicochemical characteristics and free amino acidsof hawthorn(Crataegus pinnatida)fruits during maturation[J].Food Chemistry,2015,175:50~56.
21 姚芳,夏文水.不同生长期仙人掌的营养及生理活性成分分析[J].食品与机械,2006,22(3):80~82.
22 颜孙安,钱爱萍,姚清华,等.闽产李果实氨基酸组成及其营养分析[J].热带亚热带植物学报,2012,20(6):571~577.
23 王利斌,姜丽,石韵,等.气调贮藏对四季豆生理生化特性的影响[J].食品科学,2013,34(8):289~293.
